Pictet-Spengler-Reaktion
Die Pictet-Spengler-Reaktion ist eine chemische Reaktion zur Herstellung von Heterocyclen. β-Arylethylamine, wie zum Beispiel Tryptamin, cyclisieren mit einem Aldehyd unter Wasserabspaltung. Die Reaktion wird in der Regel Säure-katalysiert und in der Hitze durchgeführt.[1][2] Besonders reaktive Aromaten geben schon unter physiologischen Bedingungen gute Ausbeuten.[3] Bei der Pictet-Spengler-Reaktion handelt es sich um einen Spezialfall der Mannich-Reaktion.
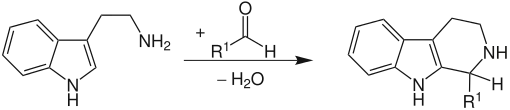
Die Reaktion wurde im Jahr 1911 von Amé Pictet (1857–1937) und Theodor Spengler (1886–1965) beschrieben und hat sich zu einer wichtigen Reaktion für die Synthese von Alkaloiden und von pharmazeutischen Wirkstoffen entwickelt.
Besonders nucleophile β-Arylethylamine wie z. B. in Indolderivaten oder in Pyrrolderivaten ergeben unter milden Bedingungen die Ringschlussprodukte in guten Ausbeuten. Wenig nucleophile Arylreste wie z. B. ein Phenylrest im β-Phenethylamin führen hingegen zu schlechten Ausbeuten bzw. benötigen hohe Temperaturen und starke Säuren. Die von Pictet und Spengler publizierte Reaktion wurde mit β-Phenethylamin und dem Formaldehyd-dimethylacetal mit Salzsäure durchgeführt und als Produkt wurde Tetrahydroisochinolin erhalten.
Wie die Mannich-Reaktion ergeben die unreaktiveren Ketone entweder nur geringe Ausbeuten oder gehen überhaupt keine gewünschte Reaktion ein.
Die Pictet-Spengler-Reaktion wurde erfolgreich in der Festphasensynthese in der kombinatorischen Chemie angewandt.[4] Die analoge Reaktion mit Aryl-β-ethanol (anstatt des Amins) wird Oxa-Pictet-Spengler-Reaktion genannt.
Reaktionsmechanismus
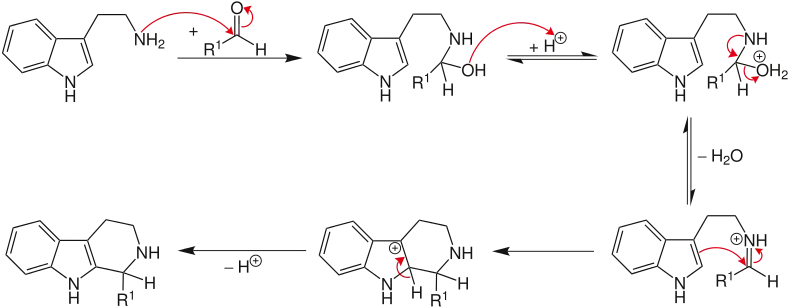
Der Aldehyd reagiert zunächst mit dem Amin. Nach einer Protonierung und anschließender Wasserabspaltung entsteht ein Iminiumion. Die Triebkraft der Reaktion ist die Elektrophilie des Iminiumions, das nun von dem elektronenreicheren, aromatischen Ring angegriffen werden kann. Nach Abspaltung eines Protons (unter Rearomatisierung) wird der Heterocyclus erhalten.[5] Die Reaktion ist eine 6-endo-trig Reaktion, die nach den Baldwin-Regeln bevorzugt ist.
Varianten
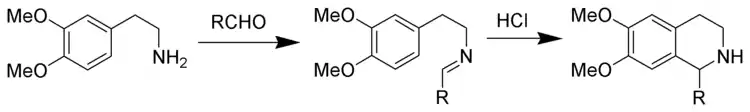
Tetrahydroisochinolin-Synthese nach Pictet-Spengler
Nach dem Prinzip der Pictet-Spengler-Reaktion können Tetrahydroisochinoline synthetisiert werden. Die Reaktionsbedingungen sind vergleichsweise drastisch, es werden höhere Temperaturen und stärkere Säuren wie Salzsäure, Trifluoressigsäure oder gar Supersäuren benötigt.[6]
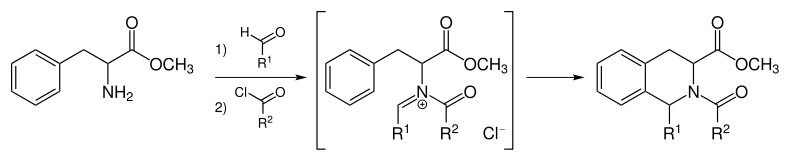
N-Acyliminium-Variante der Pictet-Spengler-Reaktion
Reaktionsträge Aromaten können unter milden Bedingungen zur Reaktion gebracht werden. Dabei wird ausgenutzt, dass ein N-Acyliumiminiumion ein ausgezeichnetes Elektrophil ist. Durch Umsetzung eines Acylierungsmittels (z. B. ein Säurechlorid oder -anhydrid) wird das Amin aktiviert und die Reaktion findet über das N-Acyliumiminiumion als reaktives Zwischenprodukt statt.[7]
Tadalafil wurde über die N-Acyliminium Pictet-Spengler-Reaktion hergestellt.[8]
Siehe auch
Einzelnachweise
- Amé Pictet, Theod. Spengler: Über die Bildung von Isochinolin-derivaten durch Einwirkung von Methylal auf Phenyl-äthylamin, Phenyl-alanin und Tyrosin. In: Berichte der deutschen chemischen Gesellschaft. Band 44, Nr. 3, Juli 1911, S. 2030, doi:10.1002/cber.19110440309 (zenodo.org).
- Wilson M. Whaley Tuticorin R. Govindachari: The Pictet‐Spengler Synthesis of Tetrahydroisoquinolines and Related Compounds. In: Organic Reactions. Band 6, 1951, S. 151–190, doi:10.1002/0471264180.or006.03.
- Georg Hahn, Hermann Ludewig: Synthese von Tetrahydro-harman-Derivaten unter physiologischen Bedingungen, I. (vorläuf.) Mitteil. In: Berichte der deutschen chemischen Gesellschaft. Band 67, Nr. 12, 5. Dezember 1934, S. 2031, doi:10.1002/cber.19340671221.
- Thomas E. Nielsen, Morten Meldal: Solid-Phase Synthesis of Pyrroloisoquinolines via the Intramolecular N-Acyliminium Pictet−Spengler Reaction. In: Journal of Combinatorial Chemistry. Band 7, Nr. 4, Juli 2005, S. 599–610, doi:10.1021/cc050008a.
- Eric D. Cox, James M. Cook: The Pictet-Spengler condensation: a new direction for an old reaction. In: Chemical Reviews. Band 95, Nr. 6, September 1995, S. 1797–1842, doi:10.1021/cr00038a004.
- Akihiro Yokoyama, Tomohiko Ohwada, Koichi Shudo: Prototype Pictet−Spengler Reactions Catalyzed by Superacids. Involvement of Dicationic Superelectrophiles. In: The Journal of Organic Chemistry. Band 64, Nr. 2, Januar 1999, S. 611–617, doi:10.1021/jo982019e.
- Bruce E. Maryanoff, Han-Cheng Zhang, Judith H. Cohen, Ignatius J. Turchi, Cynthia A. Maryanoff: Cyclizations of N-Acyliminium Ions. In: Chemical Reviews. Band 104, Nr. 3, März 2004, S. 1431–1628, doi:10.1021/cr0306182.
- Dominique Bonnet, A. Ganesan: Solid-Phase Synthesis of Tetrahydro-β-carbolinehydantoins via the N-Acyliminium Pictet−Spengler Reaction and Cyclative Cleavage. In: Journal of Combinatorial Chemistry. Band 4, Nr. 6, November 2002, S. 546–548, doi:10.1021/cc020026h.