Aminoxide
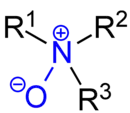
Als Aminoxid, genauer Amin-N-oxid, wird eine Gruppe chemischer Verbindungen bezeichnet, welche die funktionelle Gruppe R3N+–O− – manchmal auch als R3N→O (früher auch, allerdings falsch, R3N=O) geschrieben – enthält. Aminoxide existieren als Derivate tertiärer aliphatischer Amine und aromatischer Stickstoffverbindungen wie z. B. Pyridin.
Eigenschaften
Aminoxide sind sehr polar und daher häufig Feststoffe. Aminoxide mit kleiner molarer Masse sind sehr gut in Wasser und schlecht in unpolaren organischen Lösungsmitteln löslich.
Aminoxide sind schwache Basen mit einem pKa-Wert von etwa 4,5. Die korrespondierende Säure ist R3N+–OH.
Aminoxide mit drei unterschiedlichen Alkylresten sind optisch aktiv, da bei ihnen im Gegensatz zu den zugrundeliegenden Aminen keine Inversion (Umkehrung der Konfiguration) möglich ist.
Vorkommen
Aminoxide finden sich als Osmolyt und als Oxidationsprodukte tertiärer Amine in der Natur. So enthält z. B. Fleisch von Seefischen pro kg 40 bis 120 mg Trimethylamin-N-oxid (TMAO). Nach dem Tod der Tiere wird es bakteriell zu Trimethylamin abgebaut, das den typischen unangenehmen Fischgeruch verursacht.[1]
Herstellung
Aminoxide werden durch Oxidation der entsprechenden Amine mit Wasserstoffperoxid[2] oder Persäuren (wie meta-Chlorperbenzoesäure, Peressigsäure, Peroxomonoschwefelsäure) hergestellt.[3]
Verwendung
Amin-N-oxide finden als Schutzgruppe für Amine, als Syntheseintermediat, als Oxidationsmittel (z. B. N-Methylmorpholin-N-oxid) oder zur Modulation der Elektronenverteilung aromatischer stickstoffhaltiger Verbindungen in der elektrophilen Substitution Anwendung. Aminoxide mit einer lang- und zwei kurzkettigen Alkylgruppen, wie etwa N-Dodecyl-N,N-dimethylaminoxid C12H25(CH3)2NO werden als Tenside eingesetzt.[4]
Aminoxide können zur Titration von Kohlenstoff-Bor-Bindungen[5] und zur Aufarbeitung von Hydroborierungen und L-Selektrid-Reduktionen[6] verwendet werden.
Reaktionen
- Pyrolytische Eliminierungen von Aminoxiden beim Erhitzen auf 150 bis 200 °C – die sogenannte Cope-Eliminierung.
- Reduktion zu den Aminen mit Lithiumaluminiumhydrid, Natriumborhydrid, katalytischer Hydrierung, Zink oder Eisen und Essigsäure und Phosphortrichlorid.
- Pyridin-N-oxide können mit Elektrophilen am Ring alkyliert werden.
- Die Meisenheimer-Umlagerung zur Herstellung von O-Alkylhydroxylaminen.[7][8]
- Spaltung von Aminoxiden mit Acetanhydrid zu den Acetamiden und Formaldehyd (Polonovski-Reaktion)[9][10][11]
Einzelnachweise
- Eintrag zu Trimethylamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
- N. Meyer, W. Wykypiel, D. Seebach: Catalytic Osmium Tetroxide Oxidation of Olefins: cis-1,2-Cyclohexanediol In: Organic Syntheses. 58, 1978, S. 43, doi:10.15227/orgsyn.058.0043; Coll. Vol. 6, 1988, S. 342–348 (PDF).
- Shaker Youssif: In Recent trends in the chemistry of pyridine N-oxides 2001 Link.
- Eintrag zu nichtionische Tenside. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
- Christoph Elschenbroich: Organometallchemie. 5. Auflage, Teubner Wiesbaden 2005, ISBN 3-519-53501-7.
- K. Oesterreich, D Spitzner: In Short total synthesis of the spiro[4.5]decane sesquiterpene (–)-gleenol Tetrahedron 2002, 58, 4331–4334.
- J. Meisenheimer, Ber. 1919, 52, 1667.
- Michael B. Smith, Jerry March: In March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure Wiley-Interscience, 5th edition, 2001, ISBN 0-471-58589-0.
- D. Grierson: In Organic Reactions 1990, 39, 85–295.
- M. Polonovski, M. Polonovski, Bull. Soc. Chim. France 41, 1190 (1927).
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis; Elsevier Academic Press, Burlington-San Diego-London 2005, 1. Edition; ISBN 0-12-369483-3.
Literatur
- Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2.
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9.