Enantioselektive Katalyse
Die enantioselektive Katalyse oder auch asymmetrische Katalyse beschäftigt sich mit der Herstellung von enantiomerenreinen chemischen Verbindungen aus achiralen Startmaterialien durch eine chemische Reaktion. Zu diesem Zweck wird eine chirale (und enantionmerenreine) Verbindung als Katalysator eingesetzt.
Prinzip
Das Prinzip der enantioselektiven Katalyse beruht auf dem Einsatz von chiralen Katalysatoren, meist Übergangsmetallkomplexe mit chiralen Liganden und prochiralen Substraten. Die Chiralität der Produkte wird dabei von der Stabilität des Übergangszustands (Katalysator-Substrat-Komplex), der mit diesem Komplex gebildet wird, bestimmt. Passen die enantiotopen Halbräume von Katalysator und Edukt zusammen (matched pair), dann ist der Übergangszustand energetisch niedriger als wenn die Halbräume sterisch nicht gut zusammen passen (mismatched pair). Die beiden möglichen Übergangszustände haben deshalb unterschiedliche Stabilitäten und daraus resultierende verschiedene Produktbildungsgeschwindigkeiten. Dadurch wird ein Enantiomer bevorzugt gebildet. Die Enantioselektivität kann durch den Enantiomerenüberschuss (enantiomeric excess bzw. ee-Wert) oder das Enantiomerenverhältnis (er-Wert) angegeben werden.
Chirale Liganden und Katalysatoren
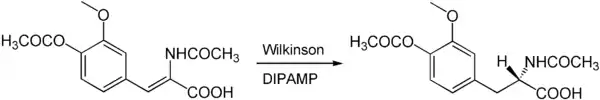
Da Chiralität nicht aus den Nichts erzeugt werden kann, muss bei jeder enantioselektiven Reaktion ein chirales Auxiliar (chiraler Hilfsstoff) beteiligt sein. Da bei der homogenen Katalyse Katalysatoren immer in geringen Mengen (0,1–20 Mol.-%) eingesetzt werden und ein Katalysator viele Zyklen durchlaufen kann, werden durch ihn viele Produkt-Moleküle mit definierter Konformation erzeugt. Die Chiralität der Liganden des Katalysators stammt oft aus chiralen Molekülen, die enantiomerenrein in der Natur so vorkommen und aus Pflanzen oder Tieren isoliert werden können, dem sogenannten chiral pool. Als Beispiel sei hier die Aminosäure L-Prolin genannt. Häufiger werden aber speziell künstlich designte Liganden eingesetzt. Ein Beispiel ist die enantioselektive Hydrierung mit dem chiral modifizierten Wilkinson-Katalysator:
Enantiotope Halbräume
- Besitzt ein Molekül eine -Achse, dann hat es zwei homotope Halbräume, das heißt, es entsteht ein Racemat bei Anlagerung einer achiralen Gruppe an das Molekül, falls kein chirales Auxiliar beteiligt ist.
- Gehört ein prochirales Molekül zur Punktgruppe , dann hat es zwei enantiotope Halbräume, d. h., es bilden sich bei der Anlagerung einer achiralen Gruppe zwei Enantiomere
- Moleküle, die zur Punktgruppe gehören, bilden bei Anlagerung einer chiralen Gruppe Diastereomere, man spricht hier von diastereotopen Halbräumen
Industrielle Anwendung
Der Monsanto-Prozess zur Herstellung von (L)-DOPA legte im Jahr 1974 den Grundstein für die industrielle enantioselektive Katalyse. Die mengenmäßig größten Anwendungen sind die Synthese von Metolachlor und der Takasago-Prozess zur Menthol-Herstellung. Weitere enantioselektive Verfahren sind die Sharpless-Epoxidierung (Glycidol, Disparlure) und die enantioselektive Cyclopropanierung zur Darstellung von Cilastatin und Pyrethroiden.[1]
Beispiele
In den letzten Jahrzehnten wurden mehrere Nobelpreise für Chemie für enantioselektive Katalysen vergeben.
Oxidationen
- Jacobsen-Epoxidierung
- Sharpless-Epoxidierung von Allylalkoholen (Nobelpreis (2001): Barry Sharpless)
Reduktionen
- Enantioselektive Hydrierung mit BINAP (Nobelpreis (2001): Ryoji Noyori)
- Enantioselektive Hydrierung (Nobelpreis (2001): William S. Knowles)
- Reduktion mit BINAL-H
Einzelnachweise
- Bernd Schäfer: Menthol. In: Chemie in unserer Zeit. Band 47, Nr. 3, 2013, S. 174–182, hier S. 178, doi:10.1002/ciuz.201300599.