Syringaldehyd
Syringaldehyd, seltener auch Syringaaldehyd[2] (3,5-Dimethoxy-4-hydroxybenzaldehyd, FEMA 4049[1]) ist eine organisch-chemische Verbindung mit der Summenformel C9H10O4. Es ist ein Derivat des Benzaldehyds mit einer zusätzlichen Hydroxy- und zwei Methoxygruppen als Substituenten. Der Name des Aldehyds stammt von der lateinischen Bezeichnung des Flieders (Syringa).
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
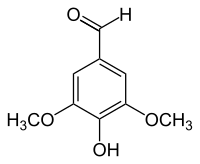 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Syringaldehyd | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C9H10O4 | ||||||||||||||||||
| Kurzbeschreibung |
Blassgelbe Nadeln[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 182,17 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| pKS-Wert |
7,0 ± 0,2[3] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte und Vorkommen
Der Aldehyd wurde erstmals 1889 aus dem im Flieder Syringa vulgaris vorkommenden Glucosid Syringin durch Oxidation und Hydrolyse gewonnen.[2] Syringaldehyd kommt natürlich auch in Ananas, Bier, Weinbrand, Rum, vielen verschiedenen Whisky-Sorten, Sherry, gerösteter Gerste und Hartholzrauch vor.[5]
 Gemeiner Flieder
Gemeiner Flieder Strukturformel von Syringin
Strukturformel von Syringin
(β-D-Glucosid des Sinapylalkohols)
Gewinnung und Darstellung
Natürliche Quellen
Syringaldehyd entsteht – oft neben erheblichen Mengen Vanillin – beim oxidativen Abbau von Lignin[6][7][8], allerdings mit stark schwankenden Ausbeuten, die entscheidend von der verwendeten Biomasse und den Reaktionsbedingungen abhängen.
Chemische Synthesen
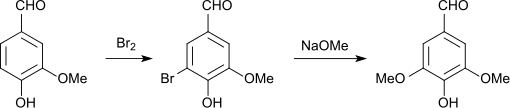
Auf chemischem Wege kann Syringaldehyd durch Reaktion von Vanillin mit Iod zum 5-Iodvanillin und nucleophiler Substitution des Iods durch eine Methoxygruppe in Gegenwart eines Kupfer-Katalysators dargestellt werden.[9] Wesentlich wirtschaftlicher ist der Weg über 5-Bromvanillin, das aus Vanillin entweder durch vollständige Bromierung in Gegenwart eines Imids in zweiphasigem wässrig organischem Lösungsmittelgemisch und Rückoxidation von HBr mit Chlor[10] oder homogen in 95%iger Ausbeute[11] in Methanol erhältlich ist. Brom-Methanol-Gemische sind allerdings selbst reaktiv[12].
Der Austausch des Bromatoms gegen eine Methoxygruppe gelingt durch Elektronentransferkatalyse durch Kupfersalze unter vergleichsweise milden Reaktionsbedingungen (3 Stunden bei 125 °C) in Methanol/Natriummethanolat im Autoklaven unter Katalyse mit einem System aus basischem Kupfercarbonat und Kohlendioxid in 99%iger Ausbeute.[13] oder in Dimethylformamid mit Natriummethanolat mit Kupfer(I)-chlorid in einer Gesamtausbeute von 86 % bezüglich Vanillin.[11] Einfachere, drucklose Reaktionsführung der Übergangsmetall-induzierten nucleophilen Substitution erlaubt erst der Einsatz von Kupfer(I)komplexen in DMF[10].
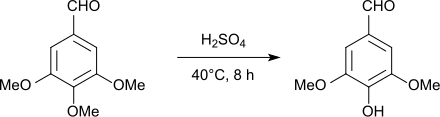
Alternativ ist Syringaldehyd durch regioselektive Demethylierung von 3,4,5-Trimethoxybenzaldehyd im Sauren mit Schwefelsäure[14] in 96%iger Ausbeute, mit Aluminiumchlorid[15] in 95%iger Ausbeute und im Basischen mit wässrigem Dimethylamin unter Druck in 72%iger Ausbeute[16] zugänglich.
Ebenfalls möglich ist die Synthese durch die Duff-Reaktion.[17]
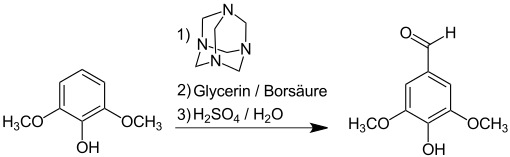
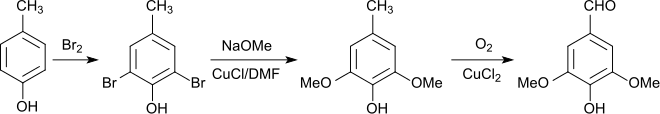
Ausgehend von dem industriell verfügbaren p-Kresol wird Syringaldehyd in einer dreistufigen Synthese über 2,6-Dibrom-4-methylphenol (96,5 % Ausbeute), 2,6-Dimethoxy-4-methylphenol (84 %) und Oxidation der Methylgruppe (91 %) in einer Gesamtausbeute von 63 bis 67 % erhalten.[18]
Eigenschaften
Physikalische Eigenschaften
Syringaldehyd ist ein in blassgelben Nadeln kristallisierender[2] Feststoff, der nahezu unlöslich in Wasser ist[4][5] sich aber in Ethanol, Diethylether und Eisessig löst.[2] Es schmilzt bei 110–113 °C[5] und siedet bei 192–193 °C bei Unterdruck (19 hPa).[2]
Chemische Eigenschaften
Die Substanz leitet sich strukturell sowohl vom Benzaldehyd als auch vom Syringol (2,6-Dimethoxyphenol) ab. Infolge seines bifunktionalen Charakters ist Syringaldehyd sehr reaktionsfreudig. Durch Veretherung, Veresterung oder Aldolkondensation sind sehr viele Derivate synthetisierbar.
Der pKs-Wert der phenolischen OH-Gruppe des Syringaldehyds beträgt 7,0 ± 0,2.[3] Dieser Wert ist gegenüber dem Syringol mit 9,98[19] deutlich niedriger. Die elektronenziehende Aldehydgruppe erhöht durch ihren −M-Effekt die OH-Acidität; die phenolische OH-Bindung wird zunehmend polarisiert. Ähnlich verhält es sich im Vergleich von 4-Hydroxybenzaldehyd mit einem pKs-Wert von 7,66[20] zu Phenol mit 9,99[20], sowie von Vanillin mit einem pKs-Wert von 7,40[20] zu Guajacol (2-Methoxyphenol) mit 9,98.[20]
Strukturelle und namentliche Verwandte
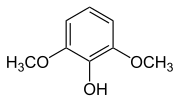 | 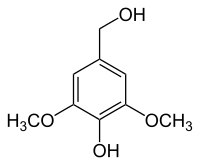 |  | 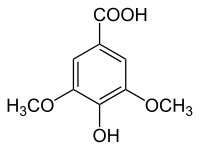 | 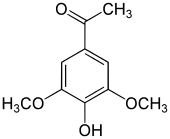 |
| Syringol | Syringaalkohol | Syringaldehyd | Syringasäure | Acetosyringon |
Verwendung
Der Aldehyd wird als Zwischenprodukt in chemischen Synthesen und als Duftstoff in der Parfümerie eingesetzt.[2]
Syringaldehyd findet wegen seiner vielfältigen Bioaktivitäten ebenso wie wegen seiner Brauchbarkeit als Molekülbaustein für diverse Wirkstoffsynthesen zunehmendes Interesse.[21] Als natürliches Antioxidans hemmt Syringaldehyd wirksam die Oxidation von ungesättigten Ölen und Lecithinen.[22]
Syringaldehyd wirkt zudem hemmend auf das Wachstum der Xylit-produzierenden Hefe Candida guilliermondii.[23] Die bisher bestimmten antimikrobiellen und enzymhemmenden Wirksamkeiten von Syringaldehyd sind gegenüber Standardvergleichssubstanzen relativ schwach.[21] Da Syringaldehyd auch bei der Pyrolyse von Lignin, z. B. beim Verbrennen von Hartholz entsteht, kann Syringaldehyd als molekularer Marker für Rauchemissionen in die Atmosphäre verwendet werden.[24][25]
Syringaldehyd ist ein Ausgangsstoff für 3,4,5-Trimethoxybenzaldehyd[10], einer Schlüsselverbindung zur Synthese des Antibiotikums Trimethoprim. Nach einer neueren Vorschrift[26] wird die Zielverbindung aus p-Kresol über das Natriumsalz des Syringaldehyds in einer Gesamtausbeute von 67,4 % erhalten.
Die Knoevenagel-Reaktion von Syringaldehyd mit Bis(2-ethylhexyl)malonat (durch Umesterung von Malonsäurediethylester mit 2-Ethylhexanol) in Gegenwart von Piperidin-Essigsäure liefert in 91%iger Ausbeute Bis(2-ethylhexyl)-3,5-dimethoxy-4-hydroxy-benzylidenmalonat (DESM, Oxynex ST).[27]
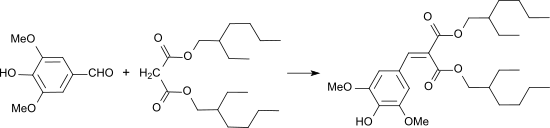
Es wird als Photostabilisator und Antioxidans in kosmetischen Zubereitungen verwendet, insbesondere zur Stabilisierung von UV-Filtern, wie z. B. Avobenzon in Sonnenschutzmitteln.[28]
Die katalytische Hydrierung der Benzylidenfunktion führt zu Bis(2-ethylhexyl)-3,5-dimethoxy-4-hydroxy-benzylmalonat (HDBM, Ronacare AP)[29], das die durch UV-, VIS- und Nahinfrarot-Licht ausgelöste Bildung reaktiver Sauerstoffradikale (ROS) wirksam unterdrückt und daher Anwendung in Kosmetika mit Lichtschutzfunktion findet.[30]
Weblinks
Einzelnachweise
- Eintrag zu FEMA 4049 in der Datenbank der Flavor and Extract Manufacturers Association of the United States.
- Eintrag zu Syringaaldehyd. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. März 2017.
- Feng Xu: Effects of Redox Potential and Hydroxide Inhibition on the pH Activity Profile of Fungal Laccases, Journal of Biological Chemistry, Vol. 272, No. 2, S. 924–928 (PDF).
- Datenblatt 3,5-Dimethoxy-4-hydroxybenzaldehyd (PDF) bei Merck, abgerufen am 29. Januar 2012.
- Datenblatt Syringaldehyde, ≥ 98 % bei Sigma-Aldrich, abgerufen am 14. März 2017 (PDF).
- R. Sun, J. Tomkinson, F.C. Mao, X.F. Sun: Physicochemical characterization of lignins from rice straw by hydrogen peroxide treatment. In: J. Appl. Polym. Sci. Band 79, Nr. 4, 2001, S. 719–732, doi:10.1002/1097-4628(20010124)79:4<719::AID-APP170>3.0.CO;2-3.
- J. Zhang, H. Deng, L. Lin: Wet Aerobic Oxidation of Lignin into Aromatic Aldehydes Catalysed by a Perovskite-type Oxide: LaFe1-xCuxO3 (x=0, 0.1, 0.2). In: Molecules. Band 14, 2009, S. 2747–2757, doi:10.3390/molecules14082747.
- P.C. Rodrigues Pinto, E.A. Borges da Silva, A.E. Rodrigues: Insights into Oxidative Conversion of Lignin to High-Added-Value Phenolic Aldehydes. In: Ind. Eng. Chem. Res. Band 50, Nr. 2, 2010, S. 741–748, doi:10.1021/ie102132.
- J.M. Pepper, J.A. MacDonald: The synthesis of syringaldehyde from vanillin. In: Can. J. Chem. Band 31, Nr. 5, 1953, S. 476–483, doi:10.1139/v53-064.
- EP 155 335 (1985) Ahrens K.-H. Liebenow W., Grafe I. (Ludwig Heuman & Co GmbH); Verfahren zur Herstellung von 3,5-Dimethoxy-4-alkoxybenzaldehyden.
- Percy S. Manchand, Peter S. Belica, Harry S. Wong: Synthesis of 3,4,5-Trimethoxybenzaldehyde, in: Synth. Commun., 1990, 20 (17), S. 2659–2666 (doi:10.1080/00397919008051474).
- Paul T. Bowman, Edmond I. Ko, and Paul J. Sides: A Potential Hazard in Preparing Bromine-Methanol Solutions , in: Journal of the Electrochemical Society, 1990, 137, S. 1309–1311 Archivierte Kopie (Memento vom 22. April 2017 im Internet Archive).
- D. Nobel: The copper-carbon dioxide system, a new mild and selective catalyst for the methoxylation of non-activated aromatic bromides. In: J. Chem. Soc., Chem. Commun. 1993, S. 419–420, doi:10.1039/C39930000419.
- I.A. Pearl, D.L. Beyer: Reactions of Vanillin and its Derived Compounds. XVII. A Synthesis of Syringaldehyde from Vanillin. In: J. Am. Chem. Soc. Band 74, Nr. 17, 1952, S. 4262–4263, doi:10.1021/ja01137a006.
- S. Madhavi, Design, synthesis, biochemical and biological evaluation of benzocyclic and enediyne analogs of combretastatins as potential tubulin binding ligands in the treatment of cancer, Ph.D. Thesis, Baylor University, 2007, S. 102 (Abstract (Memento vom 4. März 2016 im Internet Archive)).
- Patent US20110245544A1: Process for preparing hydroxy-substituted aromatic aldehydes. Angemeldet am 1. April 2011, veröffentlicht am 6. Oktober 2011, Anmelder: BASF SE, Erfinder: K. Ebel, S. Rüdenauer.
- C. F. H. Allen, Gerhard W. Leubner: Syringic Aldehyde In: Organic Syntheses. 31, 1951, S. 92, doi:10.15227/orgsyn.031.0092; Coll. Vol. 4, 1963, S. 866 (PDF).
- A.K. Tripathi, J.K. Sama, S.C. Taneja: An expeditious synthesis of syringaldehyde from p-cresol. In: Indian J. Chem. 49B, 2010, S. 379–381 (PDF).
- Ragnar, M.; Lindgren, C. T., Nilvebrant N.-O.: pKa-values of Guaiacyl and Syringyl Phenols Related to Lignin, J. Wood Chem. Technol. 2000, 20(3), S. 277–305 (doi:10.1080/02773810009349637, Auszug).
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- M.N.M. Ibrahim, R.B. Sriprasanthi, S. Shamsudeen, F. Adam, S.A. Bhawani: A concise review of the natural existence, synthesis, properties, and applications of syringaldehyde. In: Bioresources. Band 7, Nr. 3, 2012, S. 4377–4399 (Abstract).
- O.G. Boundagiou, S.A. Ordoudi, M.Z. Tsimidou: Structure–antioxidant activity relationship study of natural hydroxybenzaldehydes using in vitro assays. In: Food Res. Int. Band 43, Nr. 8, 2010, S. 2014–2019, doi:10.1016/j.foodres.2010.05.021.
- C. Kelly, O. Jones, C. Barnhart, C. Lajoie: Effect of furfural, vanillin and syringaldehyde on Candida guilliermondii growth and xylitol biosynthesis. In: Appl. Biochem. Biotechnol. Band 148, Nr. 1–3, 2008, S. 97–108, doi:10.1007/s12010-007-8103-1.
- A.L. Robinson, R. Subramanian, N.M. Donahue, A. Bernardo-Bricker, W.F. Rogge: Source Apportionment of Molecular Markers and Organic Aerosol. 2. Biomass Smoke. In: Environ. Sci. Technol. Band 40, Nr. 24, 2006, S. 7811–7819, doi:10.1021/es060782h.
- M.A. Bari, G. Baumbach, B. Kuch, G. Scheffknecht: Air Pollution in Residential Areas from Wood-fired Heating. In: Aerosol Air Qual. Res. Band 11, 2011, S. 749–757, doi:10.4209/aaqr.2010.09.0079.
- Y.-F. Ji, Z.-M. Zong, X.-Y. Wei: Efficient and convenient synthesis of 3,4,5-trimethoxybenzaldehyde from p-cresol. In: Synth. Commun. Band 32, Nr. 18, 2002, S. 2809–2814, doi:10.1081/SCC-120006464 (erowid.org).
- Patent US6602515B1: Photo stable organic sunscreen compounds with antioxidant properties and compositions obtained therefrom. Angemeldet am 16. Juli 2001, veröffentlicht am 5. August 2003, Anmelder: EM Industries, Erfinder: R.T. Chaudhuri.
- R.K. Chaudhuri, Z. Lascu, G. Puccetti, A.A. Deshpande, S.K. Paknikar: Design of a photostabilizer having built-in antioxidant functionality and its utility in obtaining broad-spectrum sunscreen formulations. In: Photochem. Photobiol. Band 82, Nr. 3, 2006, S. 823–828, doi:10.1562/2005-07-15-RA-612.
- Patent US8106233B2: Antioxidant Compounds. Angemeldet am 21. März 2006, veröffentlicht am 31. Januar 2012, Anmelder: Merck Patent GmbH, Erfinder: T. Rudolph, H. Buchholz.
- T. Rudolph, S. Eisenberg, J. Grumelard, B. Herzog: State-of-the-art Light Protection against Reactive Oxygen Species. In: SOFW-Journal. Band 140, Nr. 3, 2014, S. 9–14 (shopsofw.com).
