3,4,5-Trimethoxybenzaldehyd
3,4,5-Trimethoxybenzaldehyd ist eine organisch-chemische Verbindung mit der Summenformel C10H12O4. Es ist ein Derivat des Benzaldehyds mit drei zusätzlichen Methoxygruppen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
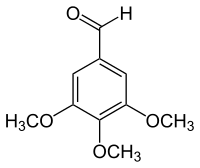 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3,4,5-Trimethoxybenzaldehyd | ||||||||||||||||||
| Andere Namen |
TMBA | ||||||||||||||||||
| Summenformel | C10H12O4 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 196,20 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Chloroform[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Nur noch von historischer Bedeutung ist die Gewinnung aus natürlicher Gallussäure durch Methylierung[3] und Rosenmund-Reduktion[4] Natürliche Quellen wie Lignin oder Vanillin benutzen auch Verfahren über 5-Bromvanillin, die mittels Elektronentransferkatalyse entweder 5-Hydroxyvanillin[5] oder Syringaldehyd[6] ergeben. Methylierung mit Dimethylsulfat und Natriumcarbonat führt zu 3,4,5-Trimethoxybenzaldehyd.
Mit keinem natürlichen Ausgangsmaterial startet der Weg über p-Kresol, das durch Kernbromierung und Seitenkettenoxidation über mehrere Stufen zu Trimethoxybenzaldehyd ebenfalls über Syringaldehyd[7] in einer Gesamtausbeute von ca. 63 % führt.[8]
Verwendung
3,4,5-Trimethoxybenzaldehyd wird als Zwischenprodukt für die Synthese des Antiobiotikums Trimethoprim sowie von Phenylethylaminen (z. B. Mescalin)[9] benötigt.
Einzelnachweise
- Datenblatt 3,4,5-Trimethoxybenzaldehyde, 98% bei Sigma-Aldrich, abgerufen am 7. November 2014 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-504.
- A. S. Chida, P. V. S. N. Vani, M. Chandrasekharam, R. Srinivasan, A. K. Singh: SYNTHESIS OF 2,3-DIMETHOXY-5-METHYL-1,4-BENZOQUINONE: A KEY FRAGMENT IN COENZYME-Q SERIES. In: Synthetic Communications. Band 31, Nr. 5, 2001, S. 657–660, doi:10.1081/SCC-100103252.
- M. Nierenstein: Zur Darstellung des Trimethylgallusaldehyds. In: Journal für Praktische Chemie. 132, 1931, S. 200, doi:10.1002/prac.19311320113.
- Patent DE 2 248 337 (1972); Pius Anton Wehrli; (F. Hoffmann-La Roche); Verfahren zur Herstellung von 3,4,5-Trimethoxybenzaldehyd.
- Patent EP 155 335 (1985) Ahrens K.-H. Liebenow W., Grafe I. (Ludwig Heuman & Co GmbH): Verfahren zur Herstellung von 3,5-Dimethoxy-4-alkoxybenzaldehyden.
- A.K. Tripathi, J.K. Sama, S.C. Taneja: An expeditious synthesis of syringaldehyde from p-cresol. In: Indian J. Chem. 49B, 2010, S. 379–381 PDF.
- Asim Kumar Mukhopadhyay: Industrial Chemical Cresols and Downstream Derivatives. (Verlag Marcel Dekker); New York 2005; ISBN 0-8247-5954-0; Seiten 81–83
- Karl Kindler, Wilhelm Peschke: Über neue und über verbesserte Wege zum Aufbau von pharmakologisch wichtigen Aminen VI. Über Synthesen des Meskalins. In: Archiv der Pharmazie. Band 270, Nr. 7, 1932, S. 410–413, doi:10.1002/ardp.19322700709.