Xylit
Xylit (auch Xylitol) ist ein Trivialname für ein Stereoisomer des Zuckeralkohols Pentanpentol. Als Lebensmittelzusatzstoff trägt es die Bezeichnung (E 967) und dient als Zuckeraustauschstoff. Die Entdeckung geht auf den späteren Nobelpreisträger Emil Fischer zurück.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
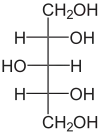 | ||||||||||||||||||||||
| Xylit in der Fischer-Projektion | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Xylit | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C5H12O5 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, süß schmeckende Kristalle[4] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 152,15 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,52 g·cm−3[5] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
216 °C[6] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Die Besonderheit an Xylit ist seine in verschiedenen klinischen Studien nachgewiesene kariostatische und antikariogene Wirkung. Auf einige Säugetiere, vor allem Hunde, wirkt Xylit dagegen toxisch, was zu seiner tiermedizinischen Bedeutung führt.
Entdeckung
Xylit wurde erstmals um 1890 von Emil Fischer und seinem Doktoranden Rudolf Stahel aus Buchenholzspänen isoliert, vgl. altgriechisch ξύλον xýlon, deutsch ‚Holz‘. Ihre Entdeckung, die sie Xylit nannten, veröffentlichten sie 1891.[9] Etwa zur gleichen Zeit wie Fischer und Stahel isolierte der französische Chemiker M. G. Bertrand aus Weizen- und Haferhalmen eine Art Xylitsirup.[10][11][12]
Vorkommen und Herstellung

Xylit ist neben Sorbitol als natürlicher Zuckeralkohol Bestandteil vieler Gemüsesorten wie u. a. Blumenkohl und Früchte wie Pflaumen, Erdbeeren oder Himbeeren, wobei der Anteil kleiner als 1 % der Trockenmasse ist.[13] Auch in der Rinde bestimmter Holzarten wie z. B. Birke und Buche ist Xylit enthalten.
Anders als der alternative Name Birkenzucker suggeriert, wird im großen Stil hergestelltes Xylit nicht aus Birken gewonnen.[14] Die industrielle Herstellung von Xylit beruht auf Xylanen (Holzgummi) aus landwirtschaftlichen Reststoffen wie Maiskolbenresten (Maisspindeln), Stroh, Getreidekleien oder Zuckerrohr-Bagasse; diese kommen auch in Birkenholz und -rinde in anderen Laubhölzern vor. Aus diesen wird Xylose bei Temperaturen von bis 200 °C und unter Einsatz von Schwefelsäure oder Natronlauge freigesetzt. Die Xylose wird dann mit einem Katalysator unter hohem Druck zu Xylit umgesetzt. Biotechnologische Verfahren wie der Einsatz von Hefen wie etwa Candida tropicalis sind möglich, werden jedoch noch nicht im großtechnischen Maßstab verwendet. Die industrielle Herstellung ist aufwendig, weshalb Xylit ein verhältnismäßig teurer Zuckeraustauschstoff ist.[2]
Als Zwischenprodukt werden im menschlichen Körper während des Kohlenhydratabbaus täglich 5 bis 15 Gramm Xylit in der Leber hergestellt.
Eigenschaften
Chemisch ist Xylit ein Pentitol und gehört zu den Zuckeralkoholen. Das Molekül ist pseudoasymmetrisch und liegt in einer achiralen meso-Form vor. Die andere achirale Form von Pentitol ist Ribitol, die chirale Form Arabitol.
Xylit hat einen ähnlichen Geschmack wie Saccharose,[15] ist aber etwas[16] süßer. Im Vergleich zu Sorbit hat es die doppelte Süßkraft.[17] Löst sich Xylit im Mund im Speichel, entzieht es der Umgebung Wärme und erzeugt auf der Zunge einen Kühleffekt (endotherme Lösungswärme) von −153,2 J/g, der ähnlich beschrieben wird wie der Effekt von Menthol.
Der physiologische Brennwert von 10 kJ/g (2,4 kcal/g) ist 40 % geringer als bei Haushaltszucker (Saccharose). Der Stoffwechselweg im menschlichen Körper läuft nahezu unabhängig von Insulin ab.[4][18] Werden bei Saccharose Insulinwerte von ca. 110 pmol/l erreicht, sind es bei Xylit nur noch 50 pmol/l. Es beeinflusst den Blutzucker- und Insulinspiegel daher geringfügiger als Saccharose. Xylit wird deswegen von Menschen mit Diabetes Mellitus als Ersatz für Saccharose verwendet.
Xylit ist hitzestabil und karamellisiert nur, wenn es mehrere Minuten auf über 200 °C erhitzt wird. Bei Temperaturen um ca. 100 °C findet keine Karamellisierung statt. Im reinen Zustand liegt es in Form von hygroskopischen Kristallen vor.[5]
Xylit kann anstelle von Zucker sowohl beim Backen als auch beim Kochen eingesetzt werden, es weist keinerlei Beigeschmack auf. Die Konsistenz ist sehr ähnlich, allerdings ist Xylitol in warmem Zustand besser löslich als kalt. Einzige Einschränkung: Hefeteige gehen mit Xylit nicht auf. Verzichten sollte man außerdem darauf, den Zuckeraustauschstoff mit anderen Süßungsmitteln wie Aspartam, Saccharin oder Sorbit zu mischen – er ist dann eventuell nicht mehr gut verträglich.
Xylit ist ein Molekül, das viel Wasser zu binden vermag. Es wird im Dünndarm nur passiv, also langsam und unvollständig resorbiert. Bei regelmäßiger Einnahme kann die Resorptionsrate im Dünndarm durch Enzyminduktion erhöht werden. Bei Einnahme von mehr als 0,5 g Xylit pro kg Körpergewicht kann eine abführende Wirkung auftreten, welche nach Adaption des Organismus (nach 3–4 Wochen Gewöhnungszeit) verschwinden kann. Im Rahmen von Studien wurde die Einnahme von 200 g Xylit täglich problemlos vertragen. Bei Sorbit besteht diese Anpassung nicht, daher wirkt Sorbit immer abführend. Xylit wird im Körper über den Pentosephosphatweg metabolisiert.[19]
Im Dickdarm wird das restliche Xylit (etwa zwei Drittel der eingenommenen Menge) durch Bakterien zerlegt und zu kleinen Fettsäurebestandteilen abgebaut und resorbiert. Diese werden zu Kohlenstoffdioxid (CO2) und Wasser verstoffwechselt.
Medizinische Bedeutung

Studien
Anfang der 1970er Jahre wurden mögliche kariesreduzierenden Eigenschaften des Zuckeralkohols entdeckt. An der Universität Turku (Finnland) wurden in den Jahren 1972 bis 1975 zwei kleine klinische, nichtrandomisierte Studien (bekannt als Turku-Zuckerstudien) durchgeführt, die eine Reduktion von Karies belegen konnten.[20][21][22] Während der ersten, zweijährigen Studie wurde Zucker (Saccharose) in allen Lebensmitteln durch Fructose oder Xylit ersetzt. Die Zunahme des DMFS-Index lag bei 7,2 in der Saccharose-Gruppe, bei 3,8 in der Fructose-Gruppe und bei 0,0 in der Xylit-Gruppe. Die zweite Studie war eine einjährige Kaugummistudie, bei der ca. 100 Teilnehmer xylit- oder saccharosehaltige Kaugummi erhalten haben. Im Vergleich zur Saccharosegruppe wurde bei den Xylitprobanden eine Reduktion der Karieszuwachsrate um mehr als 82 % ermittelt. Der Kaueffekt konnte ausgeschlossen werden, da beide Gruppen die gleiche Menge Kaugummi konsumierten.
Diese Effekte werden dadurch erklärt, dass die kariogenen Bakterien der Art Streptococcus mutans Xylit nicht verstoffwechseln können und damit absterben. Sie werden auch daran gehindert, sich als Plaquebakterien an die Zahnoberfläche anzuheften. Als optimale Xylitmenge wurden zwischen 5 und 10 Gramm pro Tag in mehreren Portionen ermittelt. In einer weiteren Turku-Studie aus dem Jahr 2000 wurden die Wechselwirkungen zwischen Müttern, die regelmäßig xylithaltige Kaugummis kauten, und ihren Kindern (bis 2 Jahre alt) untersucht.[23] Ein Ergebnis der Studie war, dass der regelmäßige Konsum von Xylit-Kaugummis durch die Mütter den Befall mit Streptococcus mutans bei den Kindern signifikant hemmt.
Eine Doppelblind-Studie aus dem Jahr 2013 mit 538 Personen, die 5 Gramm Xylit pro Tag bekamen, fand hingegen keine vorbeugende Wirkung gegen Karies bei Patienten mit einer ausreichenden Fluoridaufnahme.[24]
Eine Metastudie der Cochrane Collaboration aus dem Jahr 2015 hat eine mögliche Verringerung von Karies bei Kindern durch fluorhaltige Zahnpasta mit Xylit (im Vergleich zu nur fluoridhaltiger Zahnpasta) untersucht.[25] Schlussfolgerungen über eine vorbeugende Wirkung seien aufgrund der schlechten Qualität der Belege und methodischer Mängel wenig aussagekräftig.[26] Aussagekraft über andere xylithaltige Produkte ist durch die sehr schlechte Qualität ebenfalls nicht gegeben.
Insgesamt ist ein karieshemmender Nutzen größtenteils unklar.[26][27]
Mechanismus und Resistenz
Xylit wird bei Streptococcus mutans über das Phosphoenolpyruvat-Phosphotransferasesystem (PEP-PTS) unter Verbrauch von PEP in die Zelle transportiert, dabei entsteht Xylit-5-phosphat.[28] Xylit-5-phosphat beeinflusst die Enzyme der Glykolyse (wie die Phosphofructokinase), was zu einer Wachstumshemmung von S. mutans führt. Außerdem wird es durch eine intrazelluläre Phosphatase zu Xylit wieder dephosphoryliert und unter Energieverbrauch aus der Zelle transportiert. Somit tritt Xylit in einem Substratzyklus („Leerzyklus“) ein, was zu einer Entleerung der Energiespeicher führt. Auch dies hemmt das Bakterienwachstum.
Es wird vermutet, dass nicht alle Stämme von S. mutans empfindlich für Xylit sind und sich darum resistente Stämme bei Xylitverwendung bevorzugt vermehren können. Ferner wird jedoch vermutet, dass diese weniger kariogen sind. Der Resistenzeffekt kommt dabei auch nicht so stark zum Tragen wie bei Antibiotika, da Xylit eine weitere Wirkung besitzt, nämlich die Verringerung des Biofilms, der Schleimschicht auf den Zähnen und in der Mundhöhle, die durch Mangel an benötigten Kohlenhydraten und Kaugummibenutzung bewirkt wird. Dadurch weisen selbst Patienten mit hauptsächlich resistenten Stämmen eine verringerte Besiedlung auf.[29]
Prophylaxe der akuten Mittelohrentzündung
In einigen Studien konnte mit der Verabreichung hoher Dosen von Xylit eine vorbeugende Wirkung gegenüber der akuten Mittelohrentzündung Otitis media acuta erzielt werden.[30][31][32] Xylit inhibiert das Wachstum von Pneumokokken und die Bindung von Pneumokokken und Haemophilus influenzae an die Zellen im Nasenrachenraum. Die Xylitdosis lag im Bereich von 10 g/Tag.[33]
Tiermedizinische Bedeutung
Xylit hat bei einigen Tierarten (Hunde, Rinder, Ziegen, Kaninchen) einen stark insulinausschüttenden Effekt, der zu einem lebensbedrohlichen Abfall des Blutzuckerspiegels (Hypoglykämie) führen kann. Bei Hunden wurden zudem schwere Leberschädigungen bis zum Leberversagen und Gerinnungsstörungen beobachtet. Bereits eine Dosis von 0,1 g pro kg Körpermasse wirkt für das Tier toxisch, eine letale Dosis wird ab ca. 3–4 g Xylit pro kg Körpergewicht erreicht. Der Verzehr einer Tüte xylithaltiger Bonbons kann selbst für einen großen Hund tödlich sein, wenn das Tier nicht schnellstmöglich intensivmedizinisch betreut wird.[34][35]
Für Katzen sind Produkte, die Xylit enthalten, grundsätzlich unbedenklich.[36] In einer Studie an Katzen wurde die positive Wirkung von Xylit für deren Mundhygiene nachgewiesen. Wird Katzen mit Xylit angereichertes Wasser gegeben, vermindert dies signifikant Zahnstein und Plaque.[37]
Literatur
- E. M. Söderling: Xylitol, mutans streptococci, and dental plaque. In: Advances in dental research. Band 21, Nummer 1, 2009, S. 74–78, doi:10.1177/0895937409335642. PMID 19717413. (Review).
- C. Hayes: The effect of non-cariogenic sweeteners on the prevention of dental caries: a review of the evidence. In: J Dent Educ. Band 65, 2001, S. 1106–1109. PMID 11699985. jdentaled.org (PDF)
- Kauko K. Mäkinen: Der Einsatz von Xylit in der Kariesprophylaxe. pdv Praxis-Dienste und Verlag, Heidelberg 2003, ISBN 3-935802-09-9. xylismile.de (PDF)
- Wolfgang Strübig: Xylit und Kaugummi – eine ideale kariespräventive Kombination? In: Dentalhygiene Journal. Nr. 4, 2005, S. 33–37.
- Z. Gintner, J. Szöke, A. Patthy, E. Söderling, J. Banoczy: Wirkung von Xylit-Pastillen auf Zahnplaque und Streptococcus mutans. In: Oralprophylaxe & Kinderzahnheilkunde. Band 26, 2004, S. 93–95. zahnheilkunde.de (PDF).
Weblinks
- E 967 (Xylit). zusatzstoffe-online.de
Einzelnachweise
- Eintrag zu E 967: Xylitol in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Birkenzucker – nichts anderes als der Zusatzstoff Xylit. Lebensmittelklarheit.de, 27. Juni 2016, abgerufen am 13. Juli 2016.
- Eintrag zu XYLITOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. März 2020.
- Eintrag zu Xylitol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Juni 2014.
- Datenblatt Xylitol (PDF) bei Fisher Scientific, abgerufen am 13. Februar 2014.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-522.
- Datenblatt Xylitol, 99% bei AlfaAesar, abgerufen am 21. Dezember 2019 (PDF) (JavaScript erforderlich).
- Eintrag zu Xylitol in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 18. August 2021.
- E. Fischer, R. Stahel: Zur Kenntnis der Xylose. In: Berichte der deutschen chemischen Gesellschaft. Band 24, Nummer 1, 1891, S. 528–539; doi:10.1002/cber.189102401100.
- M. G. Bertrand: Recherches zur quelques dérivés du xylose. In: Bull Soc Chim Paris. Band 5, 1891, S. 554–557.
- K. K. Mäkinen: Der Einsatz von Xylit in der Kariesprophylaxe. (Memento vom 19. November 2011 im Internet Archive) (PDF; 1,8 MB). 2003, ISBN 3-935802-09-9, S. 9.
- K. K. Mäkinen: The rocky road of xylitol to its clinical application. In: Journal of Dental Research. Band 79, Nummer 6, Juni 2000, S. 1352–1355, PMID 10890712.
- Angaben aus Karl Herrmann: Inhaltsstoffe von Obst und Gemüse: 50 Tabellen und Übersichten. Ulmer, Stuttgart (Hohenheim) 2001, ISBN 3-8001-3139-0.
- Lebensmittelklarheit: Birkenzucker – nichts anderes als der Zusatzstoff Xylit
- Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Lehrbuch der Lebensmittelchemie. 6., vollständig überarbeitete Auflage. Springer, Berlin 2008, ISBN 978-3-540-73201-3, S. 263.
- Reinhard Matissek: Kohlenhydratreiche Lebensmittel. In: Reinhard Matissek, Werner Baltes (Hrsg.): Lebensmittelchemie. 8. Auflage. Springer, 2016, ISBN 978-3-662-47111-1, S. 502, doi:10.1007/978-3-662-47112-8_17.
- Reinhard Matissek: Kohlenhydrate. In: Reinhard Matissek, Werner Baltes (Hrsg.): Lebensmittelchemie. 8. Auflage. Springer, 2016, ISBN 978-3-662-47111-1, S. 148, doi:10.1007/978-3-662-47112-8_7.
- Metabolic response to lactitol and xylitol in healthy men1 (PDF; 1,07 MB).
- Reinhard Matissek und Peter Kuhnert: Zusatzstoffe. In: Reinhard Matissek, Werner Baltes (Hrsg.): Lebensmittelchemie. 8. Auflage. Springer, 2016, ISBN 978-3-662-47111-1, S. 254, doi:10.1007/978-3-662-47112-8_10.
- A. Scheinin, K. K. Mäkinen: Turku sugar studies. An overview. In: Acta Odontologica Scandinavica. Band 34, Nr. 6, 1976, S. 405–408, doi:10.3109/00016357609004651, PMID 1070906.
- A. Scheinin et al.: Turku sugar studies. V. Final report on the effect of sucrose, fructose and xylitol diets on the caries incidence in man. In: Acta Odontologica Scandinavica. Band 34, Nr. 4, 1976, S. 179–216, doi:10.3109/00016357608997711, PMID 795260.
- A. Scheinin et al.: Turku sugar studies XVIII. Incidence of dental caries in relation to 1-year consumption of xylitol chewing gum. In: Acta Odontologica Scandinavica. Band 33, Nr. 5, 1975, S. 269–278, doi:10.3109/00016357509004632, PMID 1067728.
- Occurrence of dental decay in children after maternal consumption of xylitol chewing gum, a follow-up from 0 to 5 years of age. 13. April 2019 (englisch), PMID 11145360.
- John P. Brown et al.: Visual scoring of non cavitated caries lesions and clinical trial efficiency, testing xylitol in caries-active adults. In: Community Dentistry and Oral Epidemiology. Band 42, Nr. 3, Juni 2014, S. 271–278, doi:10.1111/cdoe.12082, PMID 24205951, PMC 4014519 (freier Volltext).
- Philip Riley et al.: Xylitol-containing products for preventing dental caries in children and adults. In: The Cochrane Database of Systematic Reviews. Nr. 3, 26. März 2015, S. CD010743, doi:10.1002/14651858.CD010743.pub2, PMID 25809586.
- Bernd Kerschner: Xylit gegen Karies: Nutzen größtenteils unklar. In: Medizin transparent. 12. Dezember 2016, abgerufen am 14. März 2021.
- Schützen Kaugummis mit Xylit vor Karies? - Verbraucherzentrale. In: Verbraucherzentrale. 24. April 2017, abgerufen am 14. März 2021.
- Bennett T. Amaechi: Karieskontrolle durch Beeinflussung der Ernährung. In: Hendrik Meyer-Lückel, Sebastian Paris, Kim Ekstrand (Hrsg.): Karies: Wissenschaft und Klinische Praxis. Georg Thieme Verlag, 2012, ISBN 978-3-13-169321-1, S. 183, doi:10.1055/b-0034-45674.
- E. M. Söderling: Xylitol, mutans streptococci, and dental plaque. In: Advances in dental research. Band 21, Nummer 1, 2009, S. 74–78, doi:10.1177/0895937409335642. PMID 19717413.
- J. L. Danhauer, C. E. Johnson u. a.: Xylitol as a prophylaxis for acute otitis media: systematic review. In: International journal of audiology. Band 49, Nummer 10, Oktober 2010, S. 754–761, doi:10.3109/14992027.2010.493897. PMID 20874048. (Review).
- M. Uhari, T. Kontiokari, M. Niemelä: A novel use of xylitol sugar in preventing acute otitis media. In: Pediatrics. Band 102, Nummer 4 Pt 1, Oktober 1998, S. 879–884. PMID 9755259.
- J. L. Danhauer, A. Kelly, C. E. Johnson: Is mother-child transmission a possible vehicle for xylitol prophylaxis in acute otitis media? In: International journal of audiology. Band 50, Nummer 10, Oktober 2011, S. 661–672, doi:10.3109/14992027.2011.590824. PMID 21812632. (Review).
- M. Uhari, T. Tapiainen, T. Kontiokari: Xylitol in preventing acute otitis media. In: Vaccine. Band 19 Suppl 1, Dezember 2000, S. S144–S147. PMID 11163479.
- E. K. Dunayer, S. M. Gwaltney-Brant: Acute hepatic failure and coagulopathy associated with xylitol ingestion in eight dogs. In: Journal of the American Veterinary Medical Association. Band 229, Nummer 7, Oktober 2006, S. 1113–1117, doi:10.2460/javma.229.7.1113. PMID 17014359.
- Xylitol im Hund und Kleintier.
- M. E. Peterson: Xylitol. In: Topics in companion animal medicine. 28(1), 2013, S. 18–20. „Xylitol containing products are safe for cats, and it has been proposed to add it to daily water to prevent feline dental disease […]“
- D. E. Clarke: Drinking Water Additive Decreases Plaque and Calculus. In: J’Vet Dent. 23(2), 2006, S. 79–82.