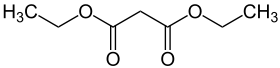
Malonsäurediethylester
Malonsäurediethylester ist eine farblose, angenehm riechende Flüssigkeit, die zu den Estern zählt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Malonsäurediethylester | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H12O4 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit aromatischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 160,17 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,05 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,414 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Malonsäurediethylester kann nicht aus der freien Säure durch Veresterung mit Ethanol gewonnen werden, weil Malonsäure bei erhöhten Temperaturen zu Essigsäure und CO2 zerfällt (Decarboxylierung). Zur Darstellung muss das Natriumsalz der Cyanessigsäure mit Ethanol und konzentrierten Mineralsäuren umgesetzt werden.[5]
Eigenschaften
Physikalische Eigenschaften
Malonsäurediethylester ist eine farblose Flüssigkeit, die bei Normaldruck bei 199 °C siedet.[2] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,90564, B = 2864,822 und C = 13,407 im Temperaturbereich von 313 bis 472 K.[6] Die Mischbarkeit mit Wasser ist begrenzt. Mit steigender Temperatur sinkt die Löslichkeit von Malonsäurediethylester in Wasser bis etwa 50 °C und steigt dann wieder an bzw. steigt die Löslichkeit von Wasser in Malonsäurediethylester.[7]
Löslichkeiten zwischen Malonsäurediethylester und Wasser[7] Temperatur °C 0 9,1 20,0 31,0 39,6 49,9 60,2 70,5 81,0 90,6 Malonsäurediethylester in Wasser in Ma-% 3,09 2,80 2,26 2,10 2,09 2,05 2,12 2,18 2,33 2,47 Wasser in Malonsäurediethylester in Ma-% 1,09 1,28 1,60 1,92 2,16 2,62 2,91 3,63 4,02 4,30
Chemische Eigenschaften
Die Methylenprotonen des Malonsäurediethylester sind leicht acid; daher kann er mit starken Basen wie z. B. Natriumethanolat deprotoniert werden. Diese deprotonierte Form ist ein Carbanion und kann mit Alkylhalogeniden zu alkylsubstituierten Malonsäurediethylestern umgesetzt werden (Malonestersynthese). Andere Reaktionsmöglichkeiten dieses Carbanions:
- Reaktion mit Carbonylderivaten (Aldehyde oder Ketone) führt zu Aldolprodukten
- Reaktion mit Carbonsäurederivaten führt zur Acylierung
Sicherheitstechnische Kenngrößen
Malonsäurediethylester bildet bei erhöhter Temperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 85 °C.[2] Der Explosionsbereich liegt zwischen 0,8 Vol.‑% als unterer Explosionsgrenze (UEG) und 12,8 Vol.‑% als oberer Explosionsgrenze (OEG).[2] Die Zündtemperatur beträgt 435 °C.[2] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
Werden alkylsubstituierte Malonsäurediethylester zu den entsprechenden alkylierten Malonsäuren verseift und anschließend erhitzt, decarboxylieren sie wie die Malonsäure selbst; es entstehen unter Kohlendioxid-Abspaltung substituierte Essigsäurederivate (siehe Malonestersynthese). Alkylsubstituierte Malonsäurediethylester können weiterhin mit Harnstoff zu Barbitursäurederivaten umgesetzt werden. Die Reaktion ist mit der Knoevenagel-Reaktion verwandt.
Einzelnachweise
- Datenblatt Diethylmalonat (PDF-Datei; 73 kB) bei SysKem Chemiehandel GmbH, abgerufen am 23. Januar 2016.
- Eintrag zu Diethylmalonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. November 2017. (JavaScript erforderlich)
- D´Ans-Lax, Taschenbuch für Chemiker und Physiker, Band 2, Dritte Auflage 1964.
- Datenblatt Diethyl malonate bei Sigma-Aldrich, abgerufen am 4. November 2016 (PDF).
- Eintrag zu Malonsäurediethylester. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Januar 2015.
- Stull, D.R.: Vapor Pressure of Pure Substances. Organic and Inorganic Compounds in Ind. Eng. Chem. 39 (1947) 517–540, doi:10.1021/ie50448a022
- R. M. Stephenson: Mutual Solubilities: Water-Ketones, Water-Ethers, and Water-Gasoline-Alcohols in J. Chem. Eng. Data 37 (1992) 80–95, doi:10.1021/je00005a024.
