Basisches Kupfercarbonat
Basisches Kupfercarbonat ist ein Kupfersalz der Kohlensäure. Die reine Kupfer(II)-carbonat-Verbindung (CuCO3) konnte noch nicht dargestellt werden. Alle bisher bekannten Carbonatverbindungen des Kupfer(II) sind basische Verbindungen wie beispielsweise die unter Vorkommen angeführten Kupfer-Mineralien. Metallische Kupferoberflächen werden in der Atmosphäre zuerst zu Kupfer(I)-oxid (Cu2O) oxidiert und dann unter weiterer Oxidation vom CO2 der Luft zu grünem basischen Kupfer(II)-carbonat, der Patina, umgewandelt. Letzteres ist aber selten ein reines basisches Carbonat und enthält häufig weitere Anionen wie Sulfat und/oder Chlorid.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
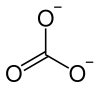 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Basisches Kupfercarbonat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | CuCO3 · Cu(OH)2 | |||||||||||||||
| Kurzbeschreibung |
hellgrüner geruchloser Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 221,20 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
4,0 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt |
200 °C (Zersetzung)[2] | |||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
0,1 mg·m−3[2] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vorkommen
In der Natur vorkommende Mineralien basischer Kupfer(II)-carbonate sind Malachit (CuCO3·Cu(OH)2) und Azurit (auch Kupferlasur genannt) (2 CuCO3·Cu(OH)2).[4]
Gewinnung und Darstellung
Wird im Labor eine Kupfer(II)-salz-Lösung mit Alkalicarbonatlösung vermischt, so bildet sich in Abhängigkeit vom Überschuss an Natriumcarbonat entweder ein blauer oder ein grüner Niederschlag von basischem Kupfer(II)-carbonat. Beide basischen Kupfer(II)-carbonate sind in Wasser unlöslich und werden ausgefällt und können abfiltriert werden.
Bei dem tiefblauen Carbonat handelt es sich um das Pigment 2 CuCO3 · Cu(OH)2, das in der Natur als Azuritmineral vorkommt. Die Herstellung dieses Pigmentes ist im Gmelin beschrieben.[5] Die Gleichung für diese Reaktion lautet:
Unter Lichteinfluss zerfällt das tiefblaue Carbonat langsam zu grünem Malachit (CuCO3 · Cu(OH)2), einem stärker basischen Pigment.
Die Gleichung für die Gesamtreaktion zu Malachit lautet demnach wie folgt:
Eigenschaften
-carbonate_blue.JPG.webp)
Wasserfreies Kupfer(II)-carbonat ist ein geruchloses hellblaues Pulver, das Monohydrat ist dunkelgrün. Es ist in Wasser unlöslich und zersetzt sich ab 140 °C zu Kupfer(II)-oxid und Kohlenstoffdioxid:
Bei der Reaktion mit Säuren entsteht Kohlenstoffdioxid und das Kupfersalz der Säure (hier z. B. Salzsäure):
Verwendung
Kupfer(II)-carbonat wird zur Herstellung vieler Kupferverbindungen, wie Kupfersulfat, CuSO4 und Kupfer(II)-oxid, CuO, verwendet.
Einzelnachweise
- Eintrag zu COPPER CARBONATE HYDROXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 23. Oktober 2021.
- Eintrag zu Kupfer(II)-hydroxidcarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu Copper(II) carbonate--copper(II) hydroxide (1:1) im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 29. Dezember 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 37.–39. Auflage. Walter de Gruyter, Berlin 1956, S. 450.
- Gmelin-Institut für anorganische Chemie und Grenzgebiete in der Max-Planck-Gesellschaft. Gmelins Handbuch der anorganischen Chemie, System Nummer 60: Kupfer, Teil B, Lieferung 2. Weinheim/Bergstraße, 8. Auflage, 1961. S. 652.

