Nichtproteinogene Aminosäuren
Nichtproteinogene Aminosäuren sind Aminosäuren, die nicht in Proteinen während der Translation eingebaut werden.[1] Sie wirken im Aminosäuren-Stoffwechsel und der Proteinbiosynthese daher oftmals als Aminosäureantagonisten.[2] Von den Aminocarbonsäuren sind die Aminoheterooxosäuren zu unterscheiden. Weitere Unterscheidungskriterien sind die Ständigkeit (Isomerie) der Amino- relativ zur Säuregruppe sowie ggf. die Konfiguration dieser funktionellen Gruppen, insbesondere in α-Aminosäuren.
Eigenschaften

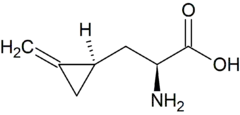
Es sind bisher über 400 nichtproteinogene Aminosäuren bekannt, die in Organismen vorkommen.[3] Diese natürlich gebildeten nichtproteinogenen Aminosäuren erfüllen verschiedene Funktionen. Manche entstehen als posttranslationale Modifikation in Proteinen (z. B. Phosphotyrosin, Hydroxyprolin, Formylmethionin, Cystin, Lanthionin, Djenkolsäure, 2,6-Diaminopimelinsäure). Andere sind Metaboliten im Stoffwechsel (z. B. Ornithin, Citrullin, Argininosuccinat, Sarcosin, Homoserin, Homocystein, L-DOPA, 5-Hydroxytryptophan). Weitere dienen als Hormone (L-Thyroxin) und Neurotransmitter (z. B. GABA, D-Serin) oder auch als Toxine (β-Methylamino-Alanin, Ibotensäure, L-Azetidin-2-carbonsäure).
Über 250 unterschiedliche nichtproteinogene Aminosäuren wurden als Bausteine der Oligopeptide oder kurzen Polypeptide gefunden, die durch nichtribosomale Peptidsynthetasen verschiedener Arten von Archaeen, Bakterien, Pilzen und Nacktkiemern aufgebaut werden.[4]
Künstlich erzeugte Aminosäuren sind z. B. die Inhibitoren Isoserin, 2-Amino-5-phosphonovaleriansäure und der Synthesegrundstoff für β-Lactam-Antibiotika D-Phenylglycin. Im Miller-Urey-Experiment wurden unter anderem die Aminosäuren Norvalin und Norleucin künstlich erzeugt.
Struktur
Im Gegensatz zu den proteinogenen Aminosäuren sind nicht alle nichtproteinogenen Aminosäuren L-α-Aminosäuren, z. B. die Gruppe der D-Aminosäuren oder die nicht-α-Aminosäuren wie β-Alanin, GABA, δ-Aminolävulinsäure oder 4-Aminobenzoesäure. Weitere nichtproteinogene Aminosäuren besitzen ein verändertes Peptid-Rückgrat wie 3-Aminoisobuttersäure oder Dehydroalanin. Es existieren ebenso nichtproteinogene Aminosäuren mit zwei Chiralitätszentren wie z. B. Cystathionin, Lanthionin, Djenkolsäure oder 2,6-Diaminopimelinsäure. Schwefel-enthaltende nichtproteinogene Aminosäuren sind z. B. Homocystein, Ethionin und Felinin. Selen-enthaltende nichtproteinogene Aminosäuren sind Methylselenocystein und Selenomethionin.
| Aminosäure | Funktion | Struktur | Strukturformel |
|---|---|---|---|
| Taurin | 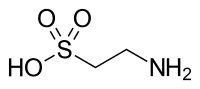 | ||
| L-Thyroxin (T4) | Hormon der Schilddrüse | L-α-Aminosäure | 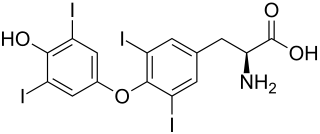 |
| 2,6-Diaminopimelinsäure (DAP) | Bestandteil in bakteriellen Zellwänden | α-Aminosäure mit 2 Stereozentren | 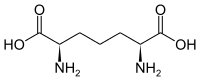 |
| Azetidin-2-carbonsäure | Toxin der Maiglöckchen | L-α-Aminosäure, sekundäres Amin in einem Ring | 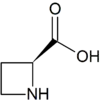 |
| Sarkosin | Stoffwechselzwischenprodukt im Aminosäurestoffwechsel | N-Methyl-α-aminosäure | acetic_acid_200.svg.png.webp) |
| Homoserin | Abbauprodukt von Methionin | L-α-Aminosäure | 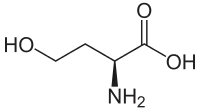 |
| Lanthionin | in Strukturproteinen | α-Aminosäure mit 2 Stereozentren | 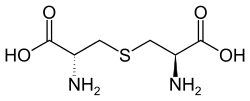 |
| Djenkolsäure | Fraßgift von Archidendron jiringa (Jengkol) einer Hülsenfrucht | α-Aminosäure mit 2 Stereozentren | 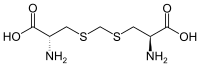 |
| Cystathionin | Intermediat der Biosynthese von Cystein | α-Aminosäure mit 2 Stereozentren | 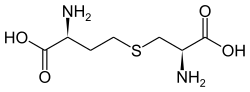 |
| L-Homocystein | Abbauprodukt von Methionin | L-α-Aminosäure |  |
| Ethionin | Methionin-Antagonist | L-α-Aminosäure | 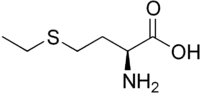 |
| 5-Aminolävulinsäure (5-ALA) | Vorstufe des Häms | δ-Aminosäure | 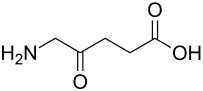 |
| p-Aminobenzoesäure (PABA) | bakterielle Folsäuresynthese | aromatisches Rückgrat |  |
| Dehydroalanin (DHA) | Abbauprodukt von Cystein | Doppelbindung am α-C-Atom | 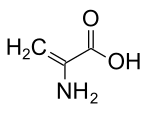 |
| γ-Aminobuttersäure (GABA) | inhibitorischer Neurotransmitter | γ-Aminosäure | 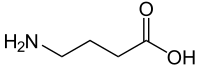 |
| 3-Aminoisobuttersäure | ist in den Fettstoffwechsel involviert | β-Aminosäure |  |
| L-Ornithin | Stoffwechselzwischenprodukt im Harnstoffzyklus | L-α-Aminosäure | 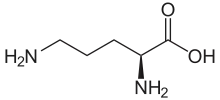 |
| L-Citrullin | Stoffwechselzwischenprodukt im Harnstoffzyklus | L-α-Aminosäure | 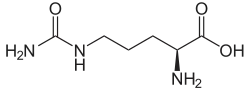 |
| Argininosuccinat | Stoffwechselzwischenprodukt im Harnstoffzyklus | L-α-Aminosäure | 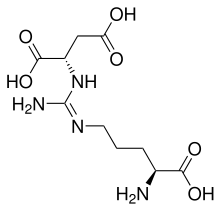 |
| L-3,4-Dihydroxyphenylalanin (L-DOPA) | Stoffwechselzwischenprodukt bei der Synthese von Katecholaminen | L-α-Aminosäure | .svg.png.webp) |
| L-5-Hydroxytryptophan (5-HTP) | Stoffwechselzwischenprodukt bei der Serotoninsynthese | L-α-Aminosäure | .svg.png.webp) |
| β-Alanin | Baustein von Coenzym A | β-Aminosäure | 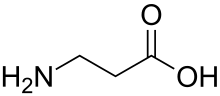 |
| β-N-Methylamino-Alanin | Neurotoxin in Cyanobakterien | L-α-Aminosäure | 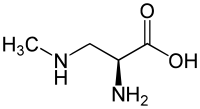 |
| Ibotensäure | Pilzgift | L-α-Aminosäure | -2-amino-2-(3-hydroxyisoxazol-5-yl)acetic_acid_200.svg.png.webp) |
| D-Valin | Bestandteil des Antibiotikums Valinomycin | D-Aminosäure | 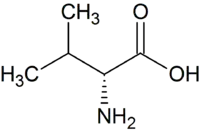 |
| D-Alanin | Bestandteil in bakteriellen Zellwänden | D-Aminosäure | 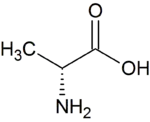 |
| D-Glutaminsäure | Bestandteil in bakteriellen Zellwänden | D-Aminosäure | 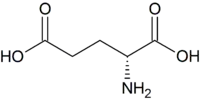 |
| Hypoglycin | Toxin der Akee-Pflanze | L-α-Aminosäure | 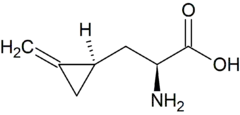 |
| L-4-Hydroxyprolin | Stabilisiert die Struktur des Kollagens | L-α-Aminosäure, sekundäres Amin in einem Ring |  |
| Pipecolinsäure | Abbauprodukt von Lysin | L-α-Aminosäure, sekundäres Amin in einem Ring | -Pipecolinic_Acid_Structural_Formula_V1.svg.png.webp) |
Anwendungen
Nichtproteinogene Aminosäuren können mit nichtribosomalen Peptidsynthetasen,[5] durch Proteinligation,[6] durch eine Peptidsynthese oder durch genetische Reprogrammierung in Proteine eingebaut werden.[7][8] Mit Peptiden, die nichtproteinogene Aminosäuren enthalten, können die Substratspezifitäten von Peptidasen untersucht und Proteaseinhibitoren entwickelt werden.[9] β-Peptide sind aus β-Aminosäuren aufgebaut.
Einzelnachweise
- Jan Koolman, Klaus Heinrich Roehm: Color Atlas of Biochemistry. 3. Ausgabe, Thieme 2012. ISBN 978-3-13-169693-9.
- Gerhard Habermehl, Peter E. Hammann: Naturstoffchemie: Eine Einführung. Springer-Verlag, 2013, ISBN 978-3-662-08929-3 (Google Books).
- Peter Nuhn: Naturstoffchemie, S. Hirzel Wissenschaftliche Verlagsgesellschaft Stuttgart 1990, ISBN 3-7776-0473-9. S. 70.
- siehe Einträge Monomere in der Datenbank NORINE.
- G. H. Hur, C. R. Vickery, M. D. Burkart: Explorations of catalytic domains in non-ribosomal peptide synthetase enzymology. In: Natural product reports. Band 29, Nummer 10, Oktober 2012, S. 1074–1098, doi:10.1039/c2np20025b, PMID 22802156.
- U. Arnold: Incorporation of non-natural modules into proteins: structural features beyond the genetic code. In: Biotechnology letters. Band 31, Nummer 8, August 2009, S. 1129–1139, doi:10.1007/s10529-009-0002-9, PMID 19404746.
- A. Ohta, Y. Yamagishi, H. Suga: Synthesis of biopolymers using genetic code reprogramming. In: Current opinion in chemical biology. Band 12, Nummer 2, April 2008, S. 159–167, doi:10.1016/j.cbpa.2007.12.009, PMID 18249198.
- Y. Lu, S. Freeland: On the evolution of the standard amino-acid alphabet. In: Genome biology. Band 7, Nummer 1, 2006, S. 102, doi:10.1186/gb-2006-7-1-102, PMID 16515719, PMC 1431706 (freier Volltext).
- P. Kasperkiewicz, A. D. Gajda, M. Drąg: Current and prospective applications of non-proteinogenic amino acids in profiling of proteases substrate specificity. In: Biological chemistry. Band 393, Nummer 9, September 2012, S. 843–851, doi:10.1515/hsz-2012-0167, PMID 22944686.