Azetidin-2-carbonsäure
(S)-Azetidin-2-carbonsäure[3] ist eine nicht-kanonische α-Aminosäure aus der Gruppe der Azetidincarbonsäuren, die sich von ihrem Analogon, der proteinogenen Aminosäure L-Prolin [(S)-Prolin] nur durch Ringverkleinerung um eine Methylengruppe unterscheidet. Sie ist ein toxischer Bestandteil des Wurzelstocks einheimischer Maiglöckchen und wirkt hemmend auf das Pflanzenwachstum.[4] Die Azetidin-2-carbonsäure besitzt ein stereogenes Zentrum, ist also chiral. Es gibt zwei Enantiomere: (S)-Azetidin-2-carbonsäure und (R)-Azetidin-2-carbonsäure. Letztere besitzt nur geringe Bedeutung.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
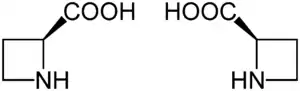 | |||||||||||||||||||
| (S)-Azetidin-2-carbonsäure (links) und (R)-Azetidin-2-carbonsäure (rechts) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Azetidin-2-carbonsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H7NO2 | ||||||||||||||||||
| Kurzbeschreibung |
beigefarbener Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 101,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
5 % in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Natürliches Vorkommen
Neben der Stammsubstanz (S)-Azetidin-2-carbonsäure [Synonym: L-Azetidin-2-carbonsäure] in Maiglöckchen (Convallaria majalis) und in geringen Mengen in Zuckerrüben kommen in der Natur vor allem deren Derivate vor: Mugineinsäure dient als Phytosiderophor und Nicotinamin ist in Soja-Sauce enthalten.
 Maiglöckchen (Convallaria majalis)
Maiglöckchen (Convallaria majalis) Zuckerrübe (Beta vulgaris subsp. vulgaris, Altissima-Gruppe)
Zuckerrübe (Beta vulgaris subsp. vulgaris, Altissima-Gruppe)
Giftwirkung auf Fressfeinde
-Prolin.png.webp)
Falls Fressfeinde (Herbivore) die Maiglöckchen und damit das Gift verzehren, wird (S)-Azetidin-2-carbonsäure anstelle von (S)-Prolin [Synonym: L-Prolin] bei der Proteinbiosynthese des Fressfeindes eingebaut. Infolgedessen ändert sich die Tertiärstruktur neusynthetisierter Proteine, so dass diese in ihrer biologischen Aktivität untauglich oder gar toxisch wirken.
Das Maiglöckchen selbst kann aufgrund einer hochspezifischen Prolyl-tRNA-Synthetase den unkontrollierten Einbau von (S)-Azetidin-2-carbonsäure [Synonym: L-Azetidin-2-carbonsäure] in arteigene Proteine umgehen.[5]
Synthese und Anwendung
Es sind mehrere Synthesen[6][7] für (S)-Azetidin-2-carbonsäure sowie des Racemats[8] in der Literatur beschrieben. Generell können Azetidine durch Reduktion von β-Lactamen gewonnen werden. Derivate der Azetidincarbonsäure werden als Medikamente (ABT-594 als Nichtopioid-Analgetikum), als Pflanzenschutzmittel sowie als Katalysatoren eingesetzt.[4] Die Synthese und Verwendung von (S)-Azetidin-2-carbonsäure-Derivaten als Katalysatoren in der enantioselektiven Boranreduktion prochiraler Ketone ist in der Literatur beschrieben.[9]
Siehe auch
Einzelnachweise
- Datenblatt L-Azetidine-2-carboxylic acid, ≥99% bei Sigma-Aldrich, abgerufen am 25. Dezember 2019 (PDF).
- Datenblatt (S)-(–)-2-Azetidinecarboxylic acid (PDF) bei Fisher Scientific, abgerufen am 13. Februar 2014.
- Francoise Couty und Gwilherm Evano: Azetidine-2-carboxylic acid. From lily of the valley to key pharmaceuticals. A jubilee review, Organic Preparations and Procedures International 38 (2006), S. 427.
- Zin Sig Kim: Asymmetrische Synthese von 1,3-Aminoalkoholen und deren Anwendung zur Synthese von Azetidinen und 1-Azabicyclen (PDF; 1,1 MB), TH Aachen, Dissertation, 2006.
- D. S. Seigler: Plant secondary metabolism. Verlag Springer, 1998, ISBN 0-412-01981-7, S. 222.
- M. Miyoshi, H. Sugano, T. Fujii, T. Ishihara und N. Yoneda: A Novel Synthesis of Optically Active Azetidine-2-carboxylic Acid, in: Chem. Lett., 1973, S. 5–6.
- S. Hanessian, N. Bernstein R. Y. Yang, R. Maguire: Asymmetric synthesis of L-azetidine-2-carboxylic acid and 3-substituted congeners - Conformationally constrained analogs of phenylalanine, naphthylalanine, and leucine, in: Bioorganic and Medicinal Chemistry Letters, 1999, 9, S. 1437–1442; doi:10.1016/S0960-894X(99)00218-8; PMID 10360752.
- Y. Yamada, T. Emori, S. Kinoshit, H. Okada: Synthesis of (±)-Azetidine 2-carboxylic Acid and 2-Pyrrolidinone Derivatives, in: Agricultural and Biological Chemistry, 1973, 37, S. 649–652.
- W. Behnen, C. Dauelsberg, S. Wallbaum, J. Martens: Enantioselective Catalytic Borane Reductions of Achiral Ketones: Synthesis and Application of new Catalysts prepared from (S)-tert-Leucine and (S)-Azetidinecarboxylic Acid, in: Synthetic Communication, 1992, 22, S. 2143–2153; doi:10.1002/chin.199306056.