Norleucin
Norleucin ist eine nicht-proteinogene chirale α-Aminosäure und wurde von Arthur Weil[4] erstmals isoliert.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
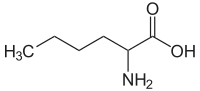 | |||||||||||||||||||
| Strukturformel von Norleucin ohne Spezifizierung der Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Norleucin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H13NO2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Blättchen[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 131,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
301 °C (Zersetzung)[1] | ||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (16 g·l−1 bei 23 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Isomerie
Von Norleucin gibt es zwei Enantiomere: L-Norleucin [Synonym: (S)-Norleucin] und D-Norleucin [Synonym: (R)-Norleucin]. Strukturell leitet sich Norleucin durch Substitution eines α-Wasserstoffatoms durch eine Aminogruppe (–NH2) von der Capronsäure ab. Norleucin gehört zusammen mit seinen Konstitutionsisomeren Leucin, Isoleucin und tert-Leucin zur Stoffgruppe der Leucine.
| Isomere von Norleucin | ||
| Name | L-Norleucin | D-Norleucin |
| Andere Namen | (S)-Norleucin (+)-Norleucin | (R)-Norleucin (−)-Norleucin |
| Strukturformel | 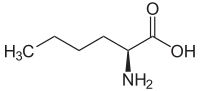 | 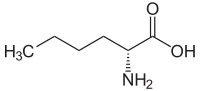 |
| CAS-Nummer | 327-57-1 | 327-56-0 |
| 616-06-8 (Racemat) | ||
| EG-Nummer | 206-321-4 | 206-320-9 |
| 210-462-7 (Racemat) | ||
| ECHA-Infocard | 100.005.748 | 100.005.747 |
| 100.009.512 (Racemat) | ||
| PubChem | 21236 | 456468 |
| 9475 (Racemat) | ||
| DrugBank | - | DB04419 |
| - (Racemat) | ||
| Wikidata | Q415428 | Q27459594 |
| Q27116817 (Racemat) | ||
Darstellung
Das Racemat erhält man durch Umsetzung von 2-Bromhexansäure mit NH3 in wässriger Lösung (50 °C, 30 h).[5]
Verwendung
Norleucin wird zur experimentellen Untersuchung von Proteinstrukturen und -funktionen verwendet. Aminoacyl-tRNA-Synthetasen können getäuscht werden, indem man ihnen anstelle ihrer normalen Substrate bestimmte unbiologische Aminosäuren anbietet. So werden Ethionin und Norleucin in solche Positionen in Proteine eingebaut, die normalerweise Methionin einnehmen würde.[6]
Einzelnachweise
- Eintrag zu Norleucin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- Datenblatt L(+)-Norleucine bei Acros, abgerufen am 30. Juni 2019.
- Datenblatt L-Norleucine bei Sigma-Aldrich, abgerufen am 22. Oktober 2016 (PDF).
- Emil Abderhalden, C. Froehlich, Dionys Fuchs: Spaltung von dl-Aminocapronsäure (= Norleucin) in die optisch-aktiven Komponenten mittels der Formyiverbindung. Polypeptide, an deren Aufbau Aminocapronsäure beteiligt ist. In: Hoppe-Seyler’s Zeitschrift für physiologische Chemie. 86, 1913, S. 454–468, doi:10.1515/bchm2.1913.86.6.454.
- K. Peter C. Vollhardt, Neil E. Schore: Organische Chemie, 4. Auflage, Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31380-8, S. 997.
- Albert L. Lehninger: Biochemie, 2. Auflage, VCH, Weinheim 1983, ISBN 3-527-25688-1, S. 767–768.
