β-Peptide
β-Peptide sind synthetische Peptide, bei denen im Gegensatz zu den biologischen Peptiden die Peptidbindung am β-Kohlenstoffatom liegt. β-Peptide gehören zu den Peptidmimetika.
Eigenschaften
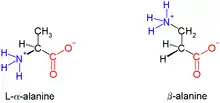
Biologische Peptide sind α-Peptide und Gegensatz zu β-Peptiden am α-C-Atom verknüpft – sie bestehen entsprechend aus α-Aminosäuren. Die quantitativ häufigste, natürlich vorkommende β-Aminosäure ist β-Alanin. Auch andere β-Aminosäuren, beispielsweise β-Lysin oder β-Glutaminsäure sind bekannt und werden durch PLP und SAM-abhängige Aminomutasen über einen Radikalshift durch ein cyclisches Intermediat generiert.[1] Von Glycin kann im Gegensatz zu anderen Aminosäuren keine β-Aminosäure erzeugt werden mangels drittem C-Atom. β-Peptide sind stabiler als α-Peptide gegenüber Proteolyse und werden hinsichtlich medizinischer Verwendung untersucht.[2][3] Streptomyces sp. nutzen β-Lysin in der Synthese verschiedener bioaktiver Komponenten wie Streptothricin und Nourseothricin.[4]
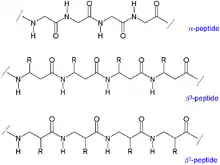
Im Zuge einer Peptidsynthese von β-Peptiden ist die Chiralität des β-C-Atoms für eine biologische Aktivität zu erhalten. Im Gegensatz zum β-C-Atom von Alanin sind viele β-C-Atome anderer Aminosäuren chiral. Die Seitenketten der Aminosäuren können bei β-Peptiden am α- (β3-Peptid) oder am β-C-Atom (β2-Peptid) angebracht sein.[5] Aufgrund der drei Kohlenstoffatome ist eine Wiederholungseinheit des Peptid-Rückgrates bei β-Peptiden um eine C-C-Bindung länger und nimmt veränderte Sekundärstrukturen an, bevorzugt in gauche-Konformation bezüglich der C-C-Bindung. Helikale Strukturen besitzen bei β-Peptiden im Allgemeinen eine stabilere Konformation als bei α-Peptiden.[6] Bisher wurden verschiedene helikale Strukturen von β-Peptiden beschrieben, benannt nach der Anzahl an Atomen in einer durch eine Wasserstoffbrücke geschlossene Ringstruktur in einer Helix: 8-Helix, 10-Helix, 12-Helix, 14-Helix und 10/12-Helix.[7] Ebenso wurden Faltblatt-Strukturen bei β-Peptiden beschrieben.[8][9]
Verschiedene Synthesen wurden beschrieben,[10][11][12] unter anderem basierend auf der Arndt-Eistert-Homologisierung. Als β-Aminosäure wurden β-Alanin, β-Leucin, β-Lysin, β-Arginin, β-Glutaminsäure, β-Glutamin, β-Phenylalanin und β-Tyrosin erzeugt.[13]
Geschichte
β-Peptide wurden erstmals im Jahr 1996 von zwei Arbeitsgruppen beschrieben, um Dieter Seebach sowie um Samuel Gellman.[14][15]
Literatur
- R. P. Cheng, S. H. Gellman, W. F. DeGrado: beta-Peptides: from structure to function. In: Chemical Reviews. Band 101, Nummer 10, Oktober 2001, S. 3219–3232, PMID 11710070.
Einzelnachweise
- Bian Wu, Wiktor Szymański, Matthew M. Heberling, Ben L. Feringa, Dick B. Janssen: Aminomutases: mechanistic diversity, biotechnological applications and future perspectives. In: Trends in Biotechnology. Band 29, Nr. 7, 1. Juli 2011, ISSN 0167-7799, S. 352–362, doi:10.1016/j.tibtech.2011.02.005, PMID 21477876 (cell.com).
- T. Beke, C. Somlai, A. Perczel: Toward a rational design of beta-peptide structures. In: Journal of computational chemistry. Band 27, Nummer 1, Januar 2006, S. 20–38, doi:10.1002/jcc.20299, PMID 16247761.
- E. A. Porter, B. Weisblum, S. H. Gellman: Mimicry of host-defense peptides by unnatural oligomers: antimicrobial beta-peptides. In: Journal of the American Chemical Society. Band 124, Nummer 25, Juni 2002, S. 7324–7330, PMID 12071741.
- Tadhg P. Begley, Hung-wen Liu: Comprehensive Natural Products III : chemistry and biology. 3rd edition Auflage. San Diego, California 2020, ISBN 978-0-08-102691-5.
- Dieter Seebach, Jennifer L. Matthews: β-Peptides: a surprise at every turn. In: Chemical Communications. , S. 2015, doi:10.1039/a704933a.
- K. Gademann, T. Hintermann, J. V. Schreiber: Beta-peptides: twisting and turning. In: Current medicinal chemistry. Band 6, Nummer 10, Oktober 1999, S. 905–925, PMID 10519905.
- Y. D. Wu, W. Han, D. P. Wang, Y. Gao, Y. L. Zhao: Theoretical analysis of secondary structures of beta-peptides. In: Accounts of chemical research. Band 41, Nummer 10, Oktober 2008, S. 1418–1427, doi:10.1021/ar800070b, PMID 18828608.
- W. F. DeGrado, J. P. Schneider, Y. Hamuro: The twists and turns of beta-peptides. In: The journal of peptide research : official journal of the American Peptide Society. Band 54, Nummer 3, September 1999, S. 206–217, PMID 10517158.
- T. A. Martinek, F. Fülöp: Side-chain control of beta-peptide secondary structures. In: European Journal of Biochemistry. Band 270, Nummer 18, September 2003, S. 3657–3666, PMID 12950249.
- B. Basler, O. Schuster, T. Bach: Conformationally constrained beta-amino acid derivatives by intramolecular [2 + 2]-photocycloaddition of a tetronic acid amide and subsequent lactone ring opening. In: The Journal of organic chemistry. Band 70, Nummer 24, November 2005, S. 9798–9808, doi:10.1021/jo0515226, PMID 16292808.
- J. K. Murray, B. Farooqi, J. D. Sadowsky, M. Scalf, W. A. Freund, L. M. Smith, J. Chen, S. H. Gellman: Efficient synthesis of a beta-peptide combinatorial library with microwave irradiation. In: Journal of the American Chemical Society. Band 127, Nummer 38, September 2005, S. 13271–13280, doi:10.1021/ja052733v, PMID 16173757.
- M. J. Koyack, R. P. Cheng: Design and synthesis of beta-peptides with biological activity. In: Methods in molecular biology. Band 340, 2006, S. 95–109, doi:10.1385/1-59745-116-9:95, PMID 16957334.
- Eusebio Juaristi, Vadim A. Soloshonok: Enantioselective Synthesis of β‐Amino Acids. John Wiley & Sons, 2005, ISBN 9780471467380.
- Dieter Seebach, Mark Overhand, Florian N. M. Kühnle, Bruno Martinoni, Lukas Oberer, Ulrich Hommel, Hans Widmer: β-Peptides: Synthesis by Arndt-Eistert homologation with concomitant peptide coupling. Structure determination by NMR and CD spectroscopy and by X-ray crystallography. Helical secondary structure of a β-hexapeptide in solution and its stability towards pe. In: Helvetica Chimica Acta. 79, 1996, S. 913, doi:10.1002/hlca.19960790402.
- Daniel H. Appella, Laurie A. Christianson, Isabella L. Karle, Douglas R. Powell, Samuel H. Gellman: β-Peptide Foldamers: Robust Helix Formation in a New Family of β-Amino Acid Oligomers. In: Journal of the American Chemical Society. 118, 1996, S. 13071, doi:10.1021/ja963290l.