Dehydroalanin
Dehydroalanin (DHA) ist eine Aminosäure mit dem systematischen Namen 2-Aminopropensäure, die nur peptidgebunden in der Natur vorkommt. Sie entsteht aus der proteinogenen Aminosäure Cystein unter Abspaltung von Schwefelwasserstoff (H2S).[2] Freies Dehydroalanin ist als primäres Enamin instabil und lagert sich in sein Tautomer 2-Iminopropansäure um.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
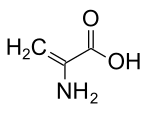 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dehydroalanin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H5NO2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 87,08 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
An die Doppelbindung können sich Ammoniak, Amine und Thiole addieren und die Proteinketten dadurch unter Bildung so genannter "cross links" vernetzen.[2] So kann Dehydroalanin in Proteinen mit der endständigen Aminogruppe von Lysin zu Lysinoalanin (LAL) weiterreagieren. Durch diese Vernetzung wird die Abbaubarkeit des Proteins im menschlichen Körper beeinträchtigt.
In der Lebensmittelqualitätssicherung dient LAL als Erhitzungsindikator insbesondere bei Milch. Ist der Anteil an LAL in der Probe zu hoch, wurde die Milch offenbar bei der thermischen Behandlung (Sterilisation, Pasteurisation etc.) entweder zu hohen Temperaturen ausgesetzt oder zu lange behandelt.[3]
Zwei Enzyme mit dieser Aminosäure sind bekannt: Phenylalanin-Ammoniak-Lyase (Pflanzen und Pilze) und Histidase (Lebewesen).[4] Die Antibiotika Nisin und Subtilin enthalten jeweils zwei Moleküle Dehydroalanin.[2] Ebenfalls findet es sich als Baustein in Microcystinen.
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Eintrag zu 2-Aminoacrylsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. Oktober 2015.
- ish.ch: Vorkommen von Lysinoalanin in Milch und Milchprodukten. In: agrarforschungschweiz.ch. Abgerufen am 10. Oktober 2015.
- PROSITE: Phenylalanine and histidine ammonia-lyases active site (englisch).