Homoserin
Homoserin ist eine nichtproteinogene, polare α-Aminosäure. Sie leitet sich vom Serin durch eine zusätzliche Methylengruppe in der Kohlenstoffkette ab.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
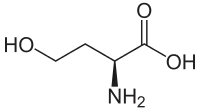 | ||||||||||||||||||||||
| Strukturformel von L-Homoserin | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | L-Homoserin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C4H9NO3 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 119,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Isomerie
Homoserin besitzt ein stereogenes Zentrum und hat damit zwei Enantiomere, L-Homoserin [Synonym: (S)-Homoserin] und ihr Spiegelbild, D-Homoserin [Synonym: (R)-Homoserin]. Das Racemat DL-Homoserin [Synonym: (RS)-Homoserin] besteht zu gleichen Teilen aus L-Homoserin und D-Homoserin. Wenn in der wissenschaftlichen Literatur Homoserin ohne jeden weiteren Zusatz genannt wird, ist fast immer L-Homoserin gemeint.
| Isomere von Homoserin | ||
| Name | L-Homoserin | D-Homoserin |
| Andere Namen | (S)-Homoserin | (R)-Homoserin |
| Strukturformel |  | -Homoserin_Structural_Formula_V.1.svg.png.webp) |
| CAS-Nummer | 672-15-1 | 6027-21-0 |
| 1927-25-9 (unspez.) | ||
| EG-Nummer | 211-590-6 | 611-961-6 |
| 217-661-8 (unspez.) | ||
| ECHA-Infocard | 100.010.538 | 100.111.579 |
| 100.016.057 (unspez.) | ||
| PubChem | 12647 | 2724170 |
| 779 (unspez.) | ||
| DrugBank | DB04193 | − |
| – (unspez.) | ||
| Wikidata | Q418214 | Q27113921 |
| Q27113920 (unspez.) | ||
Biochemie
L-Homoserin ist ein Zwischenprodukt beim biochemischen Abbau von L-Methionin.
L-Homoserin entsteht im Stoffwechsel auch mit L-Cystein aus L-Homocystein unter Thiolübertragung auf L-Serin unter Katalyse der Cystathionin-Synthase (1) und der Cystathionase (2).
Dabei bildet sich Cystathionin als temporäres Zwischenprodukt aus der Kondensation von L-Serin mit L-Homocystein unter Wasserabspaltung am Thiol- bzw. Hydroxy-Ende. Bei anschließender Hydrolyse entstehen durch Aufspaltung (2) wieder L-Cystein und L-Homoserin.
- Ausfall (1) ⇒ Homocysteinurie
- Ausfall (2) ⇒ Cystathionurie
L-Homoserin kann unter dem Einfluss von Homoserin-Desaminase Ammoniak abspalten und wird zum α-Ketobutyrat umgewandelt. Dieses kann zum α-Aminobutyrat transaminiert werden oder unter Gewinnung von NADH/H+ und Decarboxylierung sich mit CoA-SH zum Propionyl-CoA zusammenschließen.
Herstellung
L-Homoserin wird bei der Evonik-Tochtergesellschaft Fermas in Slovenská Ľupča in der Slowakei großtechnisch fermentativ produziert.[3] Die unnatürliche Aminosäure wird somit aus nachwachsenden Rohstoffen hergestellt.
Verwendung
(S)-Homoserin ist ein Edukt für die Herstellung zahlreicher interessanter organisch-chemischer Zwischenprodukte, dazu zählen die folgenden Heterocyclen: (S)-3-Aminopyrrolidin, (S)-3-Aminobutyrolacton, (S)-3-Aminotetrahydrothiophen, (S)-3-Aminotetrahydrofuran und (S)-Azetidincarbonsäure.[3]
Einzelnachweise
- Datenblatt Homoserin (PDF) bei Calbiochem, abgerufen am 8. Dezember 2015.
- Datenblatt L-Homoserin bei AlfaAesar, abgerufen am 28. Juli 2019 (PDF) (JavaScript erforderlich).
- Andreas Karau: Rosige Aussichten mit weißer Biotechnologie, elements 30, 2010, S. 26–30.