p-Aminobenzoesäure
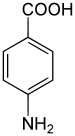
p-Aminobenzoesäure (PABA) ist eine organische Carbonsäure, ein Baustein der Folsäure und wird oftmals den B-Vitaminen zugeordnet, ist jedoch kein Vitamin. (Frühere Trivialnamen waren daher Vitamin B10 und Vitamin R.) Für viele Bakterien ist sie ein wichtiger Wuchsstoff, der zur Herstellung der Folsäure benötigt wird. Dieser Prozess kann durch die ähnlich aufgebauten Sulfonamide gestört werden. Diese als Arzneimittel verwendeten Verbindungen wirken als Antimetabolit, verhindern die Herstellung der Folsäure und schränken dadurch die Vermehrung der Bakterien ein. Außer der p-Aminobenzoesäure (4-Aminobenzoesäure) existieren zwei weitere stellungsisomere Formen, nämlich die Anthranilsäure (2-Aminobenzoesäure) und die 3-Aminobenzoesäure.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | p-Aminobenzoesäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C7H7NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
hellgelber, geruchloser Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
D02BA01 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 137,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,38 g·cm−3 (20 °C)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
2,38[4] | |||||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (6,11 g·l−1 bei 30 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Eigenschaften
p-Aminobenzoesäure bildet farblose Kristalle, die löslich sind in heißem Wasser, Ethanol, Ether, Eisessig. Sie ist leicht oxidierbar, z. B. mit Eisen(III)-Salzen; an der Luft oder unter Lichteinwirkung tritt leicht gelblich-rote Verfärbung ein. Bakterien, Pflanzen und Pilze benötigen p-Aminobenzoesäure als lebenswichtigen Wuchsstoff zur Synthese von Folsäure durch die Dihydropteroat-Synthase. Bäckerhefe enthält ca. 5–10 ppm p-Aminobenzoesäure. Die Biosynthese erfolgt aus Chorisminsäure und Glutamat.
Verwendung
p-Aminobenzoesäure dient als Ausgangsstoff für die Synthese von Azofarbstoffen, Folsäure, Lokalanästhetika sowie als UV-Absorber (UV-B-Filter) in Sonnenschutzmitteln (maximal 5 % erlaubt).[5] Außerdem wird p-Aminobenzoesäure unter der Bezeichnung PABA als Nahrungsergänzungsmittel vertrieben. Deren Salz Kalium-4-Aminobenzoat (auch: Kalium-Paraaminobenzoat, kurz: PotABA) wird in Deutschland zur Behandlung der Erkrankung Induratio penis plastica eingesetzt.
Toxikologie
p-Aminobenzoesäure zeigt geringe akute Toxizität; es wurden keine Hinweise auf Kanzerogenität gefunden. Sensibilisierungsversuche an Meerschweinchen lieferten keine Hinweise auf eine sensibilisierende Wirkung. p-Aminobenzoesäure wird über die Haut kaum resorbiert. Nach oraler Aufnahme treten als Hauptmetaboliten p-Aminohippursäure (PAH) und p-Acetylaminohippursäure (4-Acetamidohippursäure, PAAHA) auf.[6]
Derivate
Weblinks
- deutschlandradio.de: Mahlzeit! Gespräche mit Udo Pollmer – Schönheitsvitamine, 16. November 2002.
- Beilsteins Handbuch der Organischen Chemie: 14, E1
Einzelnachweise
- Eintrag zu PABA in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. März 2020.
- Eintrag zu 4-Aminobenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Eintrag zu Aminobenzoic acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 25. März 2021.
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- Verordnung (EG) Nr. 1223/2009 (PDF)
- Eintrag zu 4-Aminobenzoesäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Februar 2019.
