Farbzentrum
Farbzentren sind Gitterfehler, die sichtbares Licht absorbieren.
Typen
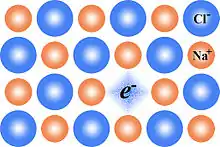
Die einfachsten Farbzentren sind F-Zentren. Sie bestehen aus Leerstellen in Ionenkristallen, an welchen Anionen fehlen. Die Ladung dieser fehlenden Anionen wird ausgeglichen, indem die Leerstelle mit einem oder mehreren Elektronen besetzt ist.
Die Elektronen eines Farbzentrums können elektromagnetische Strahlung im Wellenlängenbereich des sichtbaren Lichts absorbieren, was zu einer Verfärbung des Kristalls führt. Das Absorptionsspektrum eines solchen Kristalls besitzt eine scharfe Linie (F-Bande), deren Position von der Größe und Form der Anionenleerstelle abhängt, die dem Elektron zur Verfügung steht, aber nicht davon, woher das Elektron stammt. Am besten untersucht sind die F-Zentren in Ionenkristallen vom Natriumchlorid-Strukturtyp. Dort hat die F-Bande eine Wellenlänge von 465 nm und der Kristall eine tiefgelbe Farbe.
Es gibt noch weitere Typen von Farbzentren, wie M-, R-, N-Zentren und zugehörige Banden, bei denen mehrere Farbzentren nebeneinander liegen.[1]
Beschreibung
Ein Farbzentrum ähnelt quantenmechanisch dem Teilchen im Kasten, einem der einfachsten Modellsysteme der Quantenmechanik. Einen Beweis, dass die Elektronen wirklich in den Leerstellen eingesperrt sind und nicht mit anderen Farbzentren wechselwirken, liefert das ESR-Spektrum. Jedes ungepaarte Elektron besitzt einen ungepaarten Spin und somit ein paramagnetisches Moment.
Ionische Verbindungen, in denen die Anionen systematisch durch Elektronen ersetzt sind, werden als „Elektrid“ bezeichnet. Hier spricht man nicht mehr von Farbzentren, sondern von solvatisierten Elektronen.
Farbzentren spielten eine bedeutende Rolle bei der Entwicklung der Halbleiterphysik in der Schule von Robert Wichard Pohl in Göttingen in den 1920er Jahren. Normalerweise ist die Bandlücke in Alkalihalogeniden zu hoch, um durch sichtbares Licht überwunden zu werden und die Kristalle daher farblos. Durch Defekte in Form von Farbzentren können sie aber eingefärbt werden (und von dort Elektronen mit Licht in das Leitungsband angeregt werden). Bei Halbleitern mit kleinerer Bandlücke wie Silizium oder Germanium ist die Anregung durch Licht direkt möglich, sie sind infolgedessen undurchsichtig.
Erzeugung
Farbzentren können entstehen, wenn man einen Salzkristall im Dampf des entsprechenden Metalls erhitzt, also z. B. Natriumchlorid im Dampf von Natrium. Dabei werden im Kristall positive Natriumionen durch neutrale Natriumatome ersetzt. Die dabei frei werdenden Elektronen besetzen dann Chlorid-Leerstellen und bilden Farbzentren.
Die Chlorid-Leerstellen müssen nicht schon zu Beginn des Experiments vorhanden sein, sondern können auch erst während des Erhitzens entstehen. Die Leerstellen entstehen dann erst an der Oberfläche und diffundieren langsam ins Innere des Kristalls, was an der Verfärbung gut zu sehen ist.
Eine andere Möglichkeit, Farbzentren zu erzeugen, ist die Bestrahlung mit Röntgenstrahlen. So hat Natriumchlorid nach einem längeren Experiment der Röntgenbeugung eine grün-gelbliche Farbe, wahrscheinlich durch Entladung einiger Chloridionen.
Nutzung
Farbzentrenlaser sind über einen weiten Bereich durchstimmbar.[2]
Siehe auch
Literatur
- Charles Kittel: Einführung in die Festkörperphysik, Oldenbourg, 11. Auflage 1996, ISBN 3-486-23596-6
Einzelnachweise
- zum Beispiel Udo Scherz, Grundlagen der Festkörperphysik, in Rainer Kassing (Hrsg.): Bergmann-Schaefer, Lehrbuch der Experimentalphysik. Festkörper, De Gruyter 2005, S. 104
- http://www.spektrum.de/lexikon/physik/farbzentrenlaser/4779 Lexikon der Physik: Farbzentrenlaser auf spektrum.de