Berylliumfluorid
Beryllium(II)-fluorid ist eine chemische Verbindung aus Beryllium und Fluor mit der Formel BeF2.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
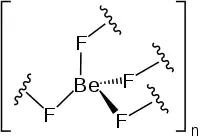 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Berylliumfluorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | BeF2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, glasartige Masse.[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 47,01 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,99 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
aufgehoben, da karzinogen[2] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−1026,8 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Gewonnen werden kann Berylliumfluorid durch Thermolyse von Ammonium-tetrafluoridoberyllat(II) (einer Berylliumkomplexverbindung, die durch Reaktion von Berylliumoxid (BeO) mit Ammoniumfluorid (NH4F) erhalten werden kann)[7][8] bei ~900 °C.
Eigenschaften
Berylliumfluorid hat stark kovalente Bindungsanteile, weshalb es kein Ionengitter ausbildet, sondern im Festkörper eine polymere Struktur besitzt, welche isotyp mit α-Quarz (< 430 °C) bzw. β-Cristobalit (> 516 °C) ist. Hierbei ist jeder Berylliumkern tetraedrisch von vier Fluorkernen umgeben. Dies ist ein Gegensatz zum isoelektronischen Kohlenstoffdioxid (CO2), steht jedoch im Einklang mit dem ebenfalls isoelektronischen Siliciumdioxid (SiO2). In der polymeren Struktur verbrückt jeder Fluorkern zwei Berylliumkerne. Hierbei wird auch Schrägbeziehung des Berylliums zum Aluminium deutlich, das ähnliches Verhalten zeigt.
Gasförmiges Berylliumfluorid liegt als lineares Monomer vor. Es bildet eine schwache π-Bindung vom Fluor zum Beryllium aus, um dessen Elektronenmangel zu kompensieren. Der Be-F-Abstand beträgt 143 pm.[9]
Bei Berylliumfluorid handelt es sich wie bei allen Beryllium(II)-halogeniden um eine Lewis-Säure, sodass es mit Fluoriden Fluoroberyllate wie BeF42− bilden kann.
Hydrolyse
Im Gegensatz zu den anderen Berylliumhalogeniden, die in Wasser direkt in hydratisierte Berylliumionen und die entsprechenden Anionen dissoziieren, liegt der Hydrolyse von Berylliumfluorid ein komplexer Ablauf von Reaktionen zugrunde, beginnend mit einer Addukt-Bildung, gefolgt von einer Autoionisation.
Die wässrige Lösung reagiert wegen der Deprotonierung des Aquakomplexes letztlich sauer:
Verwendung
Berylliumfluorid dient als Ausgangsstoff zur Herstellung von reinem Beryllium, das durch Reduktion von Berylliumfluorid mit Magnesium bei 1300 °C erhalten werden kann.[10]
Außerdem wird es zur Herstellung von Gläsern und in der Reaktortechnik verwendet.[11]
Sicherheitshinweise
Berylliumfluorid ist wie alle Berylliumverbindungen hochgiftig und wird als krebserregend eingestuft[2].
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 242.
- Eintrag zu Berylliumfluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- National Institute of Environmental Health Sciences, 13th Report on Carcinogens (RoC): Beryllium and Beryllium Compounds (Memento des Originals vom 29. November 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., abgerufen am 18. November 2014.
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Berylliumverbindungen, ausgenommen Beryllium-Tonerdesilikate, und ausgenommen die namentlich in diesem Anhang bezeichneten im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 9. Januar 2017. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Datenblatt Beryllium fluoride bei AlfaAesar, abgerufen am 5. Mai 2016 (PDF) (JavaScript erforderlich).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-6.
- Berylliumfluorid bei Webelements.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry. 2. Auflage. vol. 1, Academic Press 1963, S. 231–232.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1108–1109.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1216.
- Eintrag zu Beryllium-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.


