Nitrobenzoesäuren
Die Nitrobenzoesäuren bilden in der Chemie eine Stoffgruppe, die sich sowohl von der Benzoesäure als auch vom Nitrobenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Carboxy- (–COOH) und Nitrogruppe (–NO2) als Substituenten. Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere mit der Summenformel C7H5NO4. Die 4-Nitrobenzoesäure findet vor allem Verwendung in der Analyse organischer Substanzen.
| Nitrobenzoesäuren | ||||||
| Name | 2-Nitrobenzoesäure | 3-Nitrobenzoesäure | 4-Nitrobenzoesäure | |||
| Andere Namen | o-Nitrobenzoesäure | m-Nitrobenzoesäure | p-Nitrobenzoesäure | |||
| Strukturformel | 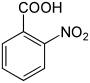 |
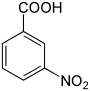 |
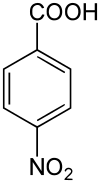 | |||
| CAS-Nummer | 552-16-9 | 121-92-6 | 62-23-7 | |||
| PubChem | 11087 | 8497 | 6108 | |||
| Summenformel | C7H5NO4 | |||||
| Molare Masse | 167,12 g·mol−1 | |||||
| Aggregatzustand | fest | |||||
| Kurzbeschreibung | weißes Pulver[1] | gelbliches kristallines Pulver[2] | hellgrünes kristallines Pulver[3] | |||
| Schmelzpunkt | 146–148 °C[1] | 139–142 °C[2] | 239–242 °C[3] | |||
| Siedepunkt | Zers.[1] | Zers.[2] | Zers.[3] | |||
| pKs-Wert | 2,22[4] | 3,44[4] | 3,42[5] | |||
| Löslichkeit in Wasser |
7,8 g/l (25 °C)[1] | 3 g/l (25 °C)[2] | 0,42 g/l (20 °C)[3] | |||
| GHS- Kennzeichnung |
|
|
| |||
| H- und P-Sätze | 315‐319‐335 | 302‐315‐319‐335‐412 | 302‐319 | |||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||
| 261‐305+351+338 | 262‐273‐305+351+338 | 301+330+331 264‐280‐337+313 | ||||
Darstellung
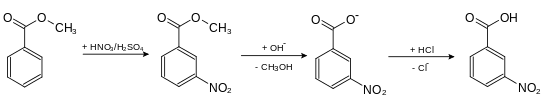
3-Nitrobenzoesäure erhält man aus Benzoesäuremethylester durch Umsetzung mit rauchender Salpetersäure in Gegenwart von konzentrierter Schwefelsäure.[6] Nach der Nitrierung wird der entstandene 3-Nitrobenzoesäuremethylester zur Säure verseift.[7]
Wird jedoch die Benzoesäure direkt nitriert, so entsteht zumeist 3,5-Dinitrobenzoesäure.
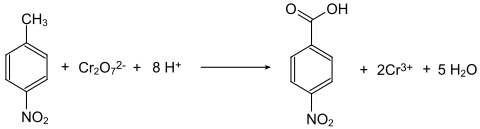
Generell sind die Nitrobenzoesäuren aus den Nitrotoluolen durch Oxidation der Methylgruppe zugänglich. So wird 4-Nitrotoluol mit Natriumdichromat in Gegenwart von konzentrierter Schwefelsäure zur 4-Nitrobenzoesäure oxidiert.[8]
Eigenschaften
Die Nitrobenzoesäuren sind farblose bis gelbliche kristalline Feststoffe. Die Schmelzpunkte unterscheiden sich deutlich. Die 4-Nitrobenzoesäure, die die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt. Die Nitrobenzoesäuren weisen aufgrund des −M-Effekts der Nitrogruppe eine höhere Acidität im Vergleich zur Benzoesäure auf. Die pKs-Werte sind daher entsprechend niedriger (Benzoesäure: 4,20[4]).
Verwendung
Analytik
Die 4-Nitrobenzoesäure findet vor allem Verwendung in der Analyse organischer Substanzen durch Derivatisierung. Flüssige Substanzen oder solche mit niedrigem Schmelzpunkt werden dazu in leicht kristallisierende Derivate umgewandelt: Alkohole können beispielsweise durch die Messung der Schmelzpunkte ihrer Ester der 4-Nitrobenzoesäure oder der 3,5-Dinitrobenzoesäure identifiziert werden. Hierzu wird die zu analysierende Substanz mit 4-Nitrobenzoesäure in Gegenwart geringer Mengen Schwefelsäure umgesetzt.
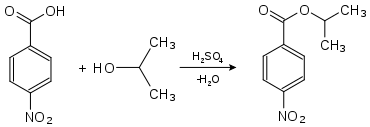 Nachweis von Isopropanol als Derivat der 4-Nitrobenzoesäure:
Nachweis von Isopropanol als Derivat der 4-Nitrobenzoesäure:
4-Nitrobenzoesäure-2-propylester (Smp.: 100,5 °C[4]).
Die Schmelzpunkte dieser Derivate sind in der Regel scharf. Diese Umsetzung ist auch für zahlreiche Amine geeignet.
Die Derivate der 3,5-Dinitrobenzoesäure besitzen in der Regel höhere Schmelzpunkte als die der 4-Nitrobenzoesäure.[4] Sie werden dann bevorzugt gewählt, wenn der Schmelzpunkt mit der 4-Nitrobenzoesäure zu niedrig ist und keine genaue Bestimmung mehr möglich wird.
Ist die fragliche Substanz empfindlicher, so erfolgt stattdessen die direkte Umsetzung mit dem entsprechenden Säurechlorid, dem 4-Nitrobenzoylchlorid. Auf diese Weise sind z. B. auch Derivate der Aminosäuren zugänglich.
Synthese
3-Aminobenzoesäure kann durch die Reduktion von 3-Nitrobenzoesäure erhalten werden. Als Reduktionsmittel eignen sich beispielsweise elementares Zink in Salzsäure[9] oder Hydrazin.[10]
Einzelnachweise
- Eintrag zu 2-Nitrobenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. März 2017. (JavaScript erforderlich)
- Eintrag zu 3-Nitrobenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. März 2017. (JavaScript erforderlich)
- Eintrag zu 4-Nitrobenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. März 2017. (JavaScript erforderlich)
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- Beyer/Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 511.
- Oliver Kamm, J. B. Segur: Methyl m-nitrobenzoate In: Organic Syntheses. 3, 1923, S. 71, doi:10.15227/orgsyn.003.0071; Coll. Vol. 1, 1941, S. 372 (PDF).
- Oliver Kamm, J. B. Segur: m-Nitrobenzoic acid In: Organic Syntheses. 3, 1923, S. 73, doi:10.15227/orgsyn.003.0073; Coll. Vol. 1, 1941, S. 391 (PDF).
- O. Kamm, A. O. Matthews: p-Nitrobenzoic acid In: Organic Syntheses. 2, 1922, S. 53, doi:10.15227/orgsyn.002.0053; Coll. Vol. 1, 1941, S. 392 (PDF).
- J. Wilbrand, F. K. Beilstein: Ueber eine neue Reihe isomerer Verbindungen der Benzoëgruppe. – Nitrodracylsäure und deren Derivate, in: J. Liebigs Ann. Chem., 1863, 128, S. 257–273 (doi:10.1002/jlac.18631280302).
- T. Curtius: Die Einwirkung von Hydrazinhydrat auf Nitroverbindungen. I. Abhandlung, in: J. Prakt. Chem., 1907, 76, S. 233–237 (doi:10.1002/prac.19070760116).