Nukleophile aromatische Substitution
Als nukleophile aromatische Substitution bezeichnet man in der Organischen Chemie eine Reihe verschiedener nukleophiler Substitutionsreaktionen am Aromaten. Dieser Substitutionstypus gehört formal zu den Substitutionen am ungesättigten Kohlenstoff-Atom. In Anlehnung an die Abkürzungsschreibweise der nukleophilen Substitution wird dieser Mechanismus auch als SNAr (aromatisch) bezeichnet. Die nukleophile Substitution allgemein wird in einem eigenen Artikel genauer behandelt.
Allgemeines
Nukleophile Reagenzien (also Reagenzien die selbst eine negative Ladung oder ein freies Elektronenpaar haben) suchen Stellen in Molekülen mit einem Elektronendefizit (= Stellen mit positiven Ladungen/Partialladungen oder Elektronenlücken). „Normale“ Aromaten mit ihren sechs π-Elektronen sind gegenüber diesen naturgemäß wenig reaktionsfreudig. Daher gibt es je nach Mechanismus verschiedene Voraussetzungen für den Ablauf einer nukleophilen Substitution.
Mechanismen
Eine SN2-artige Reaktion wie bei der aliphatischen nukleophilen Substitution ist am Aromaten nicht möglich, da die Konfiguration eines Substituenten am Aromaten nicht invertierbar ist. Der Angriff müsste aus dem Inneren des Benzolrings stattfinden und würde ihn auf unmögliche Art und Weise verdrehen.

Eine SN1-artige Reaktion ist ebenfalls nicht möglich, da die in diesem Fall entstehenden Arylkationen, insbesondere das Phenylkation, auf Grund der im sp2-Orbital lokalisierten positiven Ladung (Elektronenlücke) nicht stabil sind. Die Ladung kann wegen ihrer Lokalisation nicht durch Mesomerie stabilisiert werden.
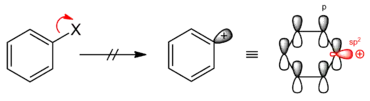
Eine Ausnahme bilden die Aryldiazoniumsalze, wobei die N2-Freisetzung als energetischer Ausgleich dient. Die Freisetzung und das Entweichen des Stickstoffs bilden die Triebkraft dieser Reaktion.
Die nukleophile aromatische Substitution kann daher nicht über einen einstufigen Mechanismus erfolgen. Allgemein gibt es vier verschiedene Substitutionsmechanismen:
- Additions-Eliminierungs-Mechanismus (SNAr)
- Eliminierungs-Additions-Mechanismus (Arinmechanismus)
- Substitution an Aryldiazoniumionen
- über Arylkationen (SN1), siehe Phenolverkochung, Schiemann-Reaktion
- Radikal- oder Elektronentransferprozesse, z. B. die Sandmeyer-Reaktion
- Radikalisch-nukleophile aromatische Substitution
- beginnend mit einer Reduktion (SRN1)
- beginnend mit einer Oxidation (SON2)
Additions-Eliminierungs-Mechanismus
Während bei der elektrophilen aromatischen Substitution meist ein Wasserstoff (siehe aber auch ipso-Substitution) gegen ein Elektrophil ausgetauscht wird, ist die Substitution von diesem bei einer nukleophilen aromatischen Substitution nicht möglich. Der Wasserstoff müsste in Form der äußerst schlechten Abgangsgruppe Hydrid (= H−) den Molekülverband verlassen.
Voraussetzungen für die nukleophile aromatische Substitution sind deshalb
- die Elektronendichte im Aromat muss durch (−I/−M)-Substituenten herabgesetzt sein.
- der Aromat muss eine gute Abgangsgruppe haben, die substituiert wird.

Die angreifende nukleophile Gruppe greift das substituierte Kohlenstoff-Atom an. Die nukleofuge Abgangsgruppe tritt unter Mitnahme der ehemaligen Bindungselektronen aus dem Molekülverband aus. Intermediär bildet sich eine Zwischenstufe, bei der eine zusätzliche negative Ladung im Aromat auftritt. Diese negative Ladung ist über den gesamten Ring und über den (−M)-Substituenten delokalisiert.
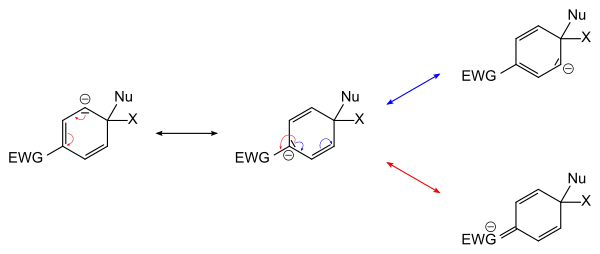
Der (−)-M-Substituent ermöglicht also erst den Angriff des Nukleophils und stabilisiert darüber hinaus die Zwischenstufe.
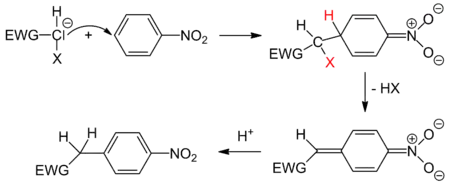
Vicarious SNAr
Die stellvertretende SNAr oder Vicarious SNAr stellt einen Spezialfall des Additions-Eliminierungs-Mechanismus dar. Dabei wird das Nukleofug im Nukleophil direkt mitgebracht. Dadurch kann indirekt auch ein Wasserstoffatom am Aromaten substituiert werden.
Übergangszustand oder Zwischenstufe?
Die Reaktion von 2-Ethoxy-1,3,5-trinitrobenzol (Pikrinsäureethylester) mit Natriummethanolat liefert ein von Jakob Meisenheimer erstmals isoliertes Salz. Die isolierbaren Salze der Zwischenstufen bei nukleophilen aromatischen Substitution sind bekannt als Meisenheimer-Komplexe.
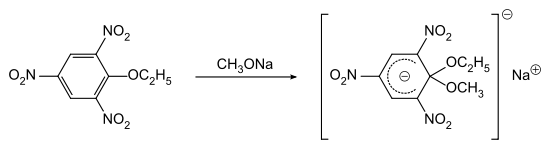
Sie gelten als Beweis, dass nukleophile aromatische Substitutionen in einem Zweistufenmechanismus ablaufen (Additions-Eliminierungsmechanismus).
Für elektrophile aromatische Substitutionen fand George Willard Wheland entsprechende, nach ihm benannte Wheland-Intermediate oder auch Wheland-Komplexe.
Bekannte Anwendungen
Sangers Reagenz, als Hilfsmittel zur Sequenz-Analyse bei Peptiden; siehe Sangers Methode zur Bestimmung der Aminosäuresequenz
Literatur
- Peter Sykes: Wie funktionieren organische Reaktionen?, 2. Auflage, Wiley-VCH 2001, ISBN 3-527-30305-7
- Peter Sykes: Reaktionsmechanismen der Organischen Chemie, 7. Auflage, Verlag Chemie 1979, ISBN 3-527-21047-4
- Autorenkollektiv: Organikum, 22. Auflage, Wiley-VCH, 2004, S. 393–399, ISBN 978-3-527-31148-4