Western Blot
Western Blot (Westernblot) bezeichnet die Übertragung (engl. Blotting) von Proteinen auf eine Trägermembran, die anschließend über immunologische[1] Reaktionen nachgewiesen werden können. Die Übertragung kann auf unterschiedliche Weise durchgeführt werden: mittels Diffusion, Kapillarwirkung oder Elektrophorese. Anwendung findet der Western Blot in der biochemischen und medizinischen Forschung sowie in der Diagnostik, wodurch er zu den meistverwendeten proteinanalytischen Methoden gezählt wird.[2] Der Western Blot gehört zur Gruppe der Immunblots.
Geschichte
Die Western Blot-Methode wurde ursprünglich 1979 im Labor von Robert Nowinski im Fred Hutchinson Cancer Research Center in Seattle von W. Neal Burnette[3] und unabhängig im Labor von George R. Stark an der Universität Stanford entwickelt.[4] Im selben Jahr konnten Harry Towbin und Mitarbeiter das Verfahren wie im einfacheren Southern Blot auf Nitrocellulose umstellen,[5] was auch heutzutage die einfachere und präferierte Methode ist.
Die Bezeichnung des Blot-Verfahrens („Western Blot“) stammt vom englischen blot für Klecks oder Fleck und von engl. blotting paper für Löschpapier, bei dem auch ein identischer Abdruck des Originals entsteht. Diese wurde erstmals 1981 von Neal Burnette[6] als eine Allusion an Northern Blot und Southern Blot eingeführt (die Veröffentlichung erschien mit zwei Jahren Verspätung, da die Zeitschrift sie ursprünglich abgelehnt hatte).[7] Edwin Southern gilt als der Erfinder der Blotting-Technik. Im Jahr 1975 entwickelte er eine Methode für die Auftrennung von DNA-Fragmenten und nachfolgende Hybridisierung, die er als Southern Blot bezeichnete. Die entsprechende Auftrennung von RNA-Fragmenten wurde in Anlehnung an seinen Namen als Northern Blot bezeichnet. Daher nannte man das Proteinblotting mit SDS Western Blot. Zur Untersuchung von Protein-Protein-Interaktionen wurde der Far-Western-Blot entwickelt. Als Kombination des Western und des Southern Blot wurde zum Nachweis von DNA-Protein-Interaktionen der Southwestern Blot entwickelt, ebenso der Northwestern Blot zum Nachweis von RNA-Protein-Interaktionen.
Einen Eastern Blot per se gibt es nicht. Dennoch wird der Ausdruck „Eastern Blot“ für verschiedene Methoden in Anspruch genommen, z. B. für eine elektrophoretische Auftrennung und einen Transfer der Proteine auf Membranen mit einem kationischen Detergens (z. B. CTAB[8][9] bei der CTAB-PAGE oder 16-BAC[10] bei der BAC-PAGE), bei dem die Proteine in die entgegengesetzte Richtung (zur Kathode) wandern. Der Ausdruck Eastern Blot wurde auch für das Blotten von Lipiden auf Membranen (Far-Eastern-Blot[11]), den Transfer nativer Proteine aus nichtdenaturierenden Gelen oder das Auftropfen (engl. Blotting) von Molekülen verwendet.[12]
Prinzip
Vor dem eigentlichen Western Blot wird ein Proteingemisch mit Hilfe einer Gel-Elektrophoresetechnik in einer Trägermatrix (SDS-PAGE, Nativ-PAGE, isoelektrische Fokussierung, 2D-Gelelektrophorese usw.) entsprechend ihrer Größe, Ladung oder anderer Eigenschaften aufgetrennt. Hierbei werden die zu untersuchenden Proteine zuerst per Gelelektrophorese (in der Regel ein Polyacrylamid-Gel mit optimaler Acrylamid-Konzentration) in Proteinbanden aufgetrennt.
Proteintransfer


Beim Western Blot wird meistens ein senkrecht zum Polyacrylamid-Gel gerichtetes elektrisches Feld angelegt (Elektrotransfer), wodurch die mit SDS-beladenen und negativ geladenen Proteine in Richtung der Anode (Plus-Pol) wandern.[13] Sofern kein Zeitdruck besteht, kann der Transfer alternativ durch Kapillarwirkung in Richtung eines trockenen Stapels eines hydrophilen, adsorbierenden Materials erfolgen (Kapillartransfer)[13] oder per Diffusion.[14]
Beim Transfer wandern die Proteine aus dem Gel auf eine Membran, z. B. Nitrocellulose, Nylon, Glasfaser oder meistens Polyvinylidendifluorid (PVDF). PVDF-Membranen werden zuerst kurz in Methanol eingelegt, damit die Hydrophobie der Membran gemindert wird und der Transferpuffer in Kontakt mit der PVDF-Membran kommen kann. Bei Nylon oder PVDF bleiben Proteine aufgrund hydrophober und polarer Wechselwirkungen an der Membranoberfläche haften, während die Adsorption bei Nitrocellulose oder Glasfasern über ionische und polare Wechselwirkungen erfolgt.
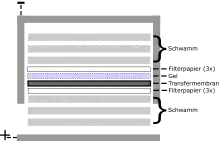
Für einen Elektrotransfer wird die Membran anodenseitig auf das Gel gelegt und beidseitig mit Transferpuffer-benässten Filterpapieren belegt und zwischen die beiden Elektroden gelegt. Für den Elektrotransfer werden drei unterschiedliche Systeme verwendet: das Tank-Blot-System, das Semi-Dry-Blot-System und das Dry-Blot-System, die sich in Aufbau und eingesetzten Puffermengen und -systemen unterscheiden. Beim Elektrotransfer wird meistens ein elektrischer Strom von 2,5 mA/cm² der Blotmembran verwendet, d. h. bei einer Blotmembran von 10 cm × 10 cm Größe werden im Elektrophorese-Netzteil 250 mA eingestellt.
Beim Kapillartransfer wird dagegen das Gel auf ein Transferpuffer-benässtes Filterpapier gelegt, auf das wiederum die Membran und zuletzt ein trockener Filterpapierstapel gelegt wird.
Beim Transfer bleibt das Muster der elektrophoretischen Auftrennung erhalten. Die Proteine sind nun aber für weitere Methoden zugänglich (z. B. Bindung eines Immunkonjugats). Nach diesem Vorgang kann das an den Proteinen angelagerte SDS ausgewaschen werden. Daher können die Proteine renaturieren und teilweise ihre Sekundär- und Tertiärstruktur wieder einnehmen, aufgrund der räumlichen Trennung der verschiedenen Untereinheiten eines Proteins kann die Quartärstruktur so jedoch nicht wiederhergestellt werden. Zur Bestimmung der Anzahl und Größe der Untereinheiten eines Proteins kann jedoch vor der SDS-PAGE eine kovalente Vernetzung der Untereinheiten durchgeführt werden, die ein Aufkochen in Probenpuffer für die SDS-PAGE übersteht und nach einer Immunfärbung den Aufbau eines Proteinkomplexes aufzeigen kann.
Proteindetektion

Die temporäre Anfärbung aller Proteine auf der Blotmembran erlaubt eine Überprüfung des Proteintransfers und eine Abschätzung der Proteinmengen (Ladekontrolle) in den verschiedenen Spuren des Gels vor einer Immundetektion. Ursprünglich wurden zu diesem Zweck einzelne Haushaltsproteine wie zum Beispiel Tubuline oder Aktine sichtbar gemacht, jedoch weist die Anfärbung aller Proteine Vorteile auf[15]. Die Gesamtheit der membrangebundenen Proteine kann über bestimmte Farbstoffe sichtbar gemacht werden. Beispiele sind Ponceau S,[16] kolloidales Gold, Amidoschwarz[17] oder Tusche. Andere Farbstoffe sind in der Lage, posttranslationale Modifikationen wie z. B. phosphorylierte Proteine zu markieren. Die bei der SDS-PAGE häufig verwendeten Färbungen wie die Coomassie-Färbung oder die Silberfärbung erlauben nur eine geringe Renaturierung der Proteine während der Entfärbung vor einer Immundetektion und entfärben zudem unvollständig.[18] Fluoreszente Färbungen besitzen in zweidimensionalen Anwendungen einen größeren linearen dynamischen Bereich und erlauben eine genauere Mengenbestimmung, wie z. B. die Gesamtproteinfärbungen mit Trichloroethanol[19][20] oder Epicocconon.[21] Je nach Versuchsaufbau können auch mit anderen Methoden selektiv einzelne Proteine sichtbar gemacht werden, z. B. radioaktiv markierte Antikörper oder andere Proteine, die durch den Einbau von Isotopen bei der Proteinsynthese oder durch nachträgliche Phosphorylierung radioaktiv markiert werden, bei Enzymen durch Umsetzen eines entsprechenden Substrats.
Wurde zusätzlich zu den zu untersuchenden Proteinen ein ungefärbter Größenmarker (synonym: Komigrationsstandard) verwendet, sollte zuerst eine reversible Färbung aller Proteine auf der Membran mit z. B. Ponceau S erfolgen. Die anschließend sichtbaren Markerbanden können mit mechanischem Druck auf die Membran erhalten werden und so auch noch nach der Farbreaktion zur Proteinidentifizierung herangezogen werden. Bei vorgefärbten Größenmarkern entfällt die reversible Proteinfärbung.
Blockierung
Nach dem Proteintransfer werden die verbliebenen freien Stellen für eine Proteinbindung auf der Membran mit einem für die Antikörper nicht erkennbaren Protein oder chemischen Polymer blockiert. Dadurch können anschließend keine weiteren, unerwünschten Proteine an der Membran haften und in der Antikörperfärbung unerwünschte Färbungen erzeugen. Dafür eignen sich Lösungen von entfettetem Milchpulver, Rinderserumalbumin (BSA, bovine serum albumin), Gelatine und andere Proteine oder auch Lösungen von Polyvinylpyrrolidon mit einem milden Detergens (wie z. B. Tween 20 oder Nonidet P40).[22][23]
Immundetektion einzelner Proteine
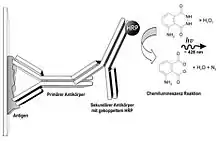

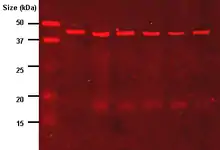
Die Proteinbanden einzelner Proteine werden meistens auf der Membran mit Hilfe spezifischer Antikörper identifiziert, die an einzelne Epitope im gesuchten Protein binden. Durch Einlegen der proteinbeladenen Blotmembran in verdünnte Lösungen von spezifischen Antikörpern (monoklonal) oder von Mischungen von spezifischen Antikörpern (polyklonal) binden die Antikörper an der passenden Proteinbande auf der Membran. Dieser direkt ans Protein bindende Antikörper wird als Primärantikörper bezeichnet. Unspezifisch gebundene Antikörper werden aufgrund von Waschschritten mit Puffern (meistens dreimal für je 10 Minuten mit TBS-T-Puffer), die Detergentien enthalten, wieder entfernt. Dabei macht man sich die Affinität der Bindung zwischen Antigen und Antikörper zunutze: Ein antigenspezifischer Primärantikörper bindet nur an „sein“ Epitop auf dem räumlich von den anderen Proteinen getrennten Antigen mit einer charakteristischen Molmasse. Weil die Renaturierung oftmals nicht vollständig ist, können bei der Verwendung monoklonaler Antikörper, die ein diskontinuierliches Epitop (synonym: Konformationsepitop) am Protein erkennen, Probleme auftreten. Mit Antikörpern, die ein kontinuierliches Epitop (synonym: Sequenzepitop) erkennen können, ist eine Renaturierung nicht erforderlich.
Die Detektion erfolgt meistens mit einem Immunkonjugat, bestehend aus einem signalbildenden Molekül, gekoppelt an einen weiteren Antikörper (Sekundärantikörper). An die Fc-Region des primären Antikörpers bindet ein sekundärer Antikörper als Antikörperkonjugat (Immunkonjugat) mit einem Reporterenzym, über das nach weiteren Waschschritten (meistens dreimal für je 10 Minuten mit TBS-T-Puffer) die Detektion erfolgt. Die Verwendung eines Sekundärantikörper-Konjugats anstelle eines Primärantikörper-Konjugats erlaubt dessen modulare Verwendung bei verschiedenen Primärantikörpern mit einhergehender Kostenersparnis, da die Kopplung jedes einzelnen Primärantikörpers mit einem Reporterenzym entfällt. Weiterhin kommt es durch den Sekundärantikörper zur Signalverstärkung, da der polyklonale, gegen mehrere Epitope auf dem Fc-Fragment einer Spezies gerichtete Sekundärantikörper an mehrere Stellen im Fc-Bereich aller Primärantikörper einer Art binden kann und dort viele Reporterenzyme gruppiert. Reporterenzym-Antikörperkonjugate (-Immunkonjugate) sind im Handel erhältlich. Bei Enzym-gekoppelten Immunkonjugaten wird durch das Enzym eine Farb- oder Chemolumineszenzreaktion (ECL) katalysiert, z. B. mit einem HRP-gekoppelten Sekundärantikörper. HRP katalysiert die Umsetzung von Luminol oder anderen Dioxetanen in seine oxidierte Form, dessen Lumineszenz detektiert werden kann. Die Lumineszenzreaktion erfolgt z. B. in einer Lösung von 100 mM TRIS/HCl pH 6,8; 0,2 mM p-Cumarsäure (in Dimethylsulfoxid gelöst); 1,2 mM Luminol (Natriumsalz, in Dimethylsulfoxid gelöst) und 0,01 % (V/V) Wasserstoffperoxid.
Je nach Fragestellung kann beim Immunblot – wie unten beschrieben – das Antigen oder – wie z. B. beim HIV-Test – auch der Primärantikörper das Suchobjekt sein. Auch Antikörper sind Proteine, und daher kann man ihre antigenen Eigenschaften neben dem Western Blot auch z. B. im Immunblot, ELISPOT und ELISA sichtbar machen.
Immunblot vs. (EL)ISA
Beides sind Methoden, die zum Nachweis von Antigenen (Proteinen) mit Hilfe markierter Antikörper dienen: Beide sind damit ISAs (Immunosorbent Assay), Methoden aus dem Bereich der Proteomik.
Der Immunblot erweitert den ELISA gewissermaßen um die Dimension der elektrophoretischen Auftrennung auf Kosten einer selektiven Anreicherung der Antigene durch Coating-Antikörper. Diese fehlende Anreicherung kann durch eine zusätzliche Proteinreinigung oder eine Immunpräzipitation erreicht werden. Durch die Gelelektrophorese und die Fixierung auf einem Festmedium (der Blotmembran) stehen den Antikörpern an verschiedenen, definierten Orten unterschiedliche Antigene getrennt zur „Auswahl“: Ein einziger Immunblot kann z. B. ein Serum mittels einer Vielzahl aufgeblotteter Antigene auf ebendiese Vielzahl an zugehörigen Antikörpern überprüfen, jedoch werden aufgrund der Denaturierung während der Probenvorbereitung zur SDS-PAGE fast ausschließlich kontinuierliche Epitope (synonym Sequenzepitope) nachgewiesen. Durch die räumliche Auftrennung können ebenso mehrere Bestandteile, gegen die ein Serum Antikörper enthält, parallel und selektiv nachgewiesen werden. Dieser Effekt kann durch Seren von Immunisierten oder Rekonvaleszenten (polyklonal) oder auch durch Mischungen von monoklonalen Antikörpern erreicht werden.
Anwendungen
Der Western Blot gehört zu den am weitesten verbreiteten proteinanalytischen Methoden. Schätzungsweise verwenden mindestens 8–9 % der derzeit in diesem Feld veröffentlichen Arbeiten Western Blots.[2] Im Bereich der Proteinbiochemie dient der Western Blot zum qualitativen Nachweis von einzelnen Proteinen und Protein-Veränderungen wie eine posttranslationale Modifikation. Es kann auch eine semiquantitative Analyse durchgeführt werden (Probe A enthält mehr Protein X als Probe B), und mit dem Auftrag einer Verdünnungsreihe einer bekannten Proteinkonzentration kann die Abschätzung der Menge eines einzelnen Proteins auf dem Blot etwas genauer verglichen werden. Bei einer Klonierung eines Vektors zur Herstellung von rekombinanten Proteinen wird der Western Blot nach einer Transfektion von eukaryotischen Zellen und ungefähr zweitägiger Zellkultur oder nach einer Transformation von Bakterien und etwa eintägiger Kultur zur Überprüfung der Proteinbiosynthese des jeweiligen Proteins verwendet.
Im Bereich der Medizin dient das Western Blotting dem Nachweis diagnostisch relevanter Proteine, so zum Beispiel von Antikörpern im Blutserum, welche für das Vorliegen bestimmter Infektionskrankheiten typisch sein können, z. B. beim HIV-Test. Außerdem hilft diese Methode in der Forschung bei der Suche nach krankheitsrelevanten Proteinen wie z. B. dem BSE-Erreger PrPSc oder das HIV. Auch verschiedene Proteine wie die ERK, die gehäuft in Tumoren vorkommen, können über Western Blot quantifiziert und entartete Zellen hierdurch erkannt werden. Auch kann z. B. bestimmt werden, inwiefern sich bestimmte Medikamente regulativ auf die vermehrte Expression solcher Proteine in der Zelle auswirken und somit eine Wirksamkeit gegen das weitere Wachstum der Tumorzellen haben.
Literatur
- Friedrich Lottspeich, Haralabos Zorbas (Hrsg.): Bioanalytik. Spektrum Akademischer Verlag, Heidelberg u. a. 1998, ISBN 3-8274-0041-4.
- Hubert Rehm, Thomas Letzel: Der Experimentator: Proteinbiochemie / Proteomics. 6. Auflage, Spektrum Akademischer Verlag, Heidelberg 2010, ISBN 978-3-8274-2312-2.
Weblinks
- Western Blot: Hintergrundinformationen (Memento vom 6. Dezember 2011 im Internet Archive)
- Erstellen der eigenen Chemolumineszenzlösung (Luminol) für Western Blots (in Laborjournal vom 10. Juni 2005)
Einzelnachweise
- A. M. Gressner, O. A. Gressner: Western blot. In: Lexikon der Medizinischen Laboratoriumsdiagnostik. Springer Berlin Heidelberg, Berlin, Heidelberg 2019, ISBN 978-3-662-48985-7, S. 2505–2506, doi:10.1007/978-3-662-48986-4_3674 (springer.com [abgerufen am 29. Juni 2021]).
- CP. Moritz: 40 years Western blotting: A scientific birthday toast. In: Journal of Proteomics. 10. Februar 2020. doi:10.1016/j.jprot.2019.103575. PMID 31706026.
- Rajendrani Mukhopadhyay: W. Neal Burnette: the man behind the Western Blot, ASBMB Today 2012.
- Jaime Renart, Jakob Reiser, George E. Stark: Transfer of proteins from gels to diazobenzyloxymethyl-paper and detection with antisera: a method for studying antibody specificity and antigen structure. In: Proceedings of the National Academy of Sciences. Bd. 76, Nr. 7, 1979, S. 3116–3120, PMID 91164, PMC 383774 (freier Volltext).
- Harry Towbin, Theophil Staehelin, Julian Gordon: Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. In: Proceedings of the National Academy of Sciences. Bd. 76, Nr. 9, 1979, S. 4350–4354, PMID 388439, PMC 411572 (freier Volltext).
- W. Neal Burnette: „Western blotting“: electrophoretic transfer of proteins from sodium dodecyl sulfate-polyacrylamide gels to unmodified nitrocellulose and radiographic detection with antibody and radioiodinated protein A. In: Analytical Biochemistry. Bd. 112, Nr. 2, 1981, S. 195–203, PMID 6266278, doi:10.1016/0003-2697(81)90281-5.
- Citation's Classic: W. Neal Burnette (PDF; 234 kB)
- Engelbert Buxbaum: Cationic electrophoresis and electrotransfer of membrane glycoproteins. In: Analytical Biochemistry. Bd. 314, Nr. 1, 2003, S. 70–76, PMID 12633604, doi:10.1016/S0003-2697(02)00639-5.
- Dianne T. Akin, Raymond Shapira, Joseph M. Kinkade Jr.: The determination of molecular weights of biologically active proteins by cetyltrimethylammonium bromide-polyacrylamide gel electrophoresis. In: Analytical Biochemistry. Bd. 145, Nr. 1, 1985, S. 170–176, PMID 4003759, doi:10.1016/0003-2697(85)90343-4.
- Joachim Hartinger, Katinka Stenius, Dagmar Högemann, Reinhard Jahn: 16-BAC/SDS-PAGE: a two-dimensional gel electrophoresis system suitable for the separation of integral membrane Proteins. In: Analytical Biochemistry. Bd. 240, Nr. 1, 1996, S. 126–133, PMID 8811889, doi:10.1006/abio.1996.0339.
- Dai Ishikawa, Takao Taki: Micro-scale Analysis of Lipids by Far-eastern Blot (TLC Blot). In: Journal of Japan Oil Chemists' Society. 47, 1998, S. 963, doi:10.5650/jos1996.47.963.
- Hiroyuki Tanaka, Noriko Fukuda, Yukihiro Shoyama: Eastern blotting and immunoaffinity concentration using monoclonal antibody for ginseng saponins in the field of traditional chinese medicines. In: Journal of Agricultural and Food Chemistry. Bd. 55, Nr. 10, S. 3783–3787, PMID 17455950, doi:10.1021/jf063457m.
- A. Goldman, J. A. Ursitti, J. Mozdzanowski, D. W. Speicher: Electroblotting from Polyacrylamide Gels. In: Current protocols in protein science / editorial board, John E. Coligan.. [et al.]. Band 82, 2015, S. 10.7.1–10.7.16, doi:10.1002/0471140864.ps1007s82, PMID 26521711.
- B. T. Kurien, R. H. Scofield: Multiple Immunoblots by Passive Diffusion of Proteins from a Single SDS-PAGE Gel. In: Methods in molecular biology (Clifton, N.J.). Band 1312, 2015, S. 77–86, doi:10.1007/978-1-4939-2694-7_11, PMID 26043992.
- CP. Moritz: Tubulin or not tubulin: Heading toward total protein staining as loading control in western blots. In: Proteomics. 20. September 2017. doi:10.1002/pmic.201600189. PMID 28941183.
- Isabel Romero-Calvo, Borja Ocon, Patricia Martinez-Moya, Maria D. Suarez et al.: Reversible Ponceau staining as a loading control alternative to actin in Western blots. In: Analytical Biochemistry. Bd. 401, 2010, S. 318–320, PMID 20206115.
- Fabrizio Gentile, Ernesto Bali, Giuseppe Pignalosa: Sensitivity and applications of the nondenaturing staining of proteins on polyvinylidene difluoride membranes with Amido black 10B in water followed by destaining in water. In: Analytical Biochemistry. Bd. 245, 1997, S. 260–262, PMID 9056225
- Charlotte Welinder, Lars Ekblad: Coomassie staining as loading control in Western blot analysis. In: Journal of Proteome Research Bd. 10, 2011, S. 1416–1419, PMID 21186791.
- Carol L. Ladner,Jing Yang, Raymond J. Turner, Robert A. Edwards: Visible fluorescent detection of proteins in polyacrylamide gels without staining. In: Analytical Biochemistry Bd. 326, 2004, S. 13–20, PMID 14769330.
- Jennifer E. Gilda, Aldrin V. Gomes: Stain-Free total protein staining is a superior loading control to β-actin for Western blots. In: Analytical Biochemistry Bd. 440, 2013, S. 186–188, PMID 23747530.
- Christian P. Moritz, Sabrina X. Marz, Ralph Reiss, Thomas Schulenborg, Eckhard Friauf: Epicocconone staining: a powerful loading control for Western blots. In: Proteomics PMID 24339236.
- John W. Haycock: Polyvinylpyrrolidone as a blocking agent in immunochemical studies. In: Analytical Biochemistry. Bd. 208, Nr. 2, 1993, S. 397–399, PMID 8095775, doi:10.1006/abio.1993.1068.
- Klaus Klarskov, Stephen Naylor: India ink staining after sodium dodecyl sulfate polyacrylamide gel electrophoresis and in conjunction with Western blots for peptide mapping by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry. In: Rapid Communications in Mass Spectrometry. Bd. 16, Nr. 1, 2002, ISSN 0951-4198, S. 35–42, PMID 11754245, doi:10.1002/rcm.522.