Immunmarkierung
Die Immunmarkierung (auch Immun- oder Antikörperfärbung genannt) ist eine biochemische Methode zum Nachweis eines Moleküls durch Bindung eines Immunkonjugates.
Eigenschaften
Die Immunmarkierung ist eine Methode zur Molekülmarkierung und verwendet dabei mit einem Nachweissystem markierte Antikörper oder -Fragmente. Eine Immunmarkierung verwendet für den Nachweis Biotin, Radioisotope, Reporterenzyme, Oligonukleotide oder Fluorophore als Signalmolekül (Reporter), das zum Nachweis dient. Der Nachweis beruht auf der Affinität von Antikörpern zu einer bestimmten Gewebeeigenschaft (Epitop) als Antigen-Antikörper-Reaktion. Im Idealfall kommt es zu einer spezifischen und starken Bindung zwischen Antikörper und Epitop. Der Antikörper ist mit einem Detektionssystem gekoppelt, das sein Vorhandensein im Präparat sichtbar macht. Mittels verschiedener Detektionssysteme können schon geringe Mengen an Epitop verstärkt dargestellt werden. Das Ziel ist es, ein Signal am Ort des Epitops (und nur dort) in ausreichender Stärke zu erkennen.
Der Antikörper, der gegen das zu findende Epitop gerichtet ist, wird als Primärantikörper bezeichnet. Der Antikörper sollte sich durch hohe Spezifität und Affinität auszeichnen und keine Kreuzreaktionen mit ähnlichen Epitopen zeigen. In einem Mehrschrittverfahren werden die einzelnen Komponenten des Detektionssystems dem Präparat zugeführt. Deshalb ist die Immunhistochemie (IHC) relativ langwierig und fehleranfällig. Das Ergebnis ist auch beeinflussbar durch Fixierungsart, Fixierungsdauer, Einbettungsmethoden, Vorbehandlungsmethoden (Antigen-Retrieval) der Präparate etc. Eine Standardisierung der Testdurchführung sollte daher angestrebt werden. Die Antigen-Antikörper-Reaktion ist abhängig von Temperatur, Konzentration, Inkubationszeit, Agitation und dem optimalen Reaktionsmilieu (pH-Wert, Salzkonzentrationen). Als Puffer für die Bindung von Antikörpern oder Immunkonjugaten wird meistens TBS-T-Puffer verwendet.
Um diese Variablen möglichst konstant zu halten und das große Probenvolumen im Labor bearbeiten zu können, wurden IHC-Automaten unterschiedlicher Bauart eingeführt. Die Beurteilung der Immunhistochemie erfolgt immer im morphologischen Kontext. Hinderlich können sich dabei unspezifische Reaktionen und allgemeine Hintergrundfärbungen (endogene Peroxidase, endogenes Biotin) erweisen. Ist nur ein schwaches Signal nachweisbar, lässt es sich durch verschiedene Methoden (z. B. TSA) verstärken (Signal-Amplifikation).
Direkte Methode

Das zu untersuchende Antigen (=Protein) wird unter definierten Bedingungen mit einem spezifischen Antikörper zusammengebracht, der direkt mit einem Enzym oder Fluorophor wie Fluorescein, Rhodamin oder Texas Red gekoppelt (konjugiert) ist. Der Antikörper (und somit das Enzym) bindet an das Antigen, nicht gebundener Antikörper wird abgespült. Dem Enzym wird in einem weiteren Schritt ein Substrat angeboten, das unter Bildung eines Farbstoffs mit dem Enzym reagiert. Dieser Farbstoff bildet sich dort, wo die immunchemische Reaktion stattgefunden hat und ist sichtbar. Einfach ausgedrückt: Antigen + Antikörper mit Enzym + Substrat/Chromogen → Farbe
Bei fluorochrom-markierten Antikörpern erfolgt die Detektion direkt im Fluoreszenzmikroskop. Die direkte Immunfluoreszenz (DIF) eignet sich auch gut zu Mehrfachdarstellungen unterschiedlicher Antigene in einem Präparat, hierbei werden Antikörper unterschiedlicher Spezifität mit Fluorochromen unterschiedlicher Emissionswellenlängen konjugiert. Die DIF stellt die älteste immunhistochemische Technik dar und wurde das erste Mal in den 50er Jahren angewandt.
Indirekte Methode
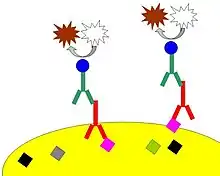
Bei dieser auch als indirekte Immunfluoreszenz (IIF) bezeichneten Methode wird im ersten Schritt ein spezifischer Antikörper (Primärantikörper) auf das zu untersuchende Gewebe/Zellen aufgebracht. In einem zweiten Schritt wird ein Antikörper aufgetragen, der sich gegen den ersten Antikörper richtet. Es ist der sog. Sekundärantikörper, der hier mit einem Enzym gekoppelt ist und die Farbentstehung mit einer Enzym-Substrat-Reaktion auslöst. Wieder entsteht ein sichtbarer Farbstoff.
Einfach: Antigen + Primärantikörper + Sekundärantikörper mit Enzym + Substrat/Chromogen → Farbe
Die indirekte Methode gibt es als Zwei-Schritt-Methode und als Drei-Schritt-Methode. Bei der Drei-Schritt-Methode wird ein weiterer, mit einem Enzym gekoppelter, Antikörper (=Tertiärantikörper) zugegeben. Dieser bindet an den Sekundärantikörper. Dieser Schritt dient der Signalverstärkung und ist sinnvoll, wenn eine geringe Menge an Epitop dargestellt werden soll.
Die indirekte Technik wird auch zum Nachweis von bereits gebundenen endogenen Antikörpern, beispielsweise Autoantikörpern wie Anti-Neutrophile cytoplasmatische Antikörper (ANCA) angewendet; bzw. enthält das zu untersuchende Patienten-Serum diese Autoantikörper und wird auf Testgewebe aufgetragen. Bei einem positiven Resultat findet der Sekundärantikörper (hier typischerweise mit einem Fluorochrom gekoppelt) seinen Bindungspartner.
PAP- und APAAP-Methode
Diese Methoden haben ihren Namen vom Peroxidase-Anti-Peroxidase (Peroxidase-Anti-Peroxidase-Methode) oder Alkalische-Phosphatase-Anti-Alkalische-Phosphatase-Komplex, der hier nach dem Sekundär-AK aufgetragen wird. Der Komplex besteht aus drei Molekülen Enzym und zwei Antikörpern (aus derselben Spezies wie Primär-AK), die gegen das Enzym gerichtet sind. Der Sekundär-AK fungiert als Brücke zwischen Primär-AK und PAP-Komplex. Diese Methode zeigte erhöhte Sensitivität und geringere Hintergrundanfärbung als die Vorgänger-Methoden und wurde als „Kit“ zur routinemäßigen Verwendung in den 80er Jahren in den Labors eingeführt.
Labelled (Strept-)Avidin-Biotin-Methode (LSAB)
Heutzutage ist diese Färbemethode die am meisten eingesetzte. Das Prinzip basiert auf der hohen Affinität von Streptavidin (Streptomyces avidinii) und Avidin (Hühnereiweiß) für Biotin. Streptavidin und Avidin besitzen jeweils vier Bindungsstellen für Biotin.
Die Reihenfolge der Reagenzien: Unkonjugierter Primärantikörper + biotinmarkierter (=biotinylierter) Sekundärantikörper + Avidin-Biotin-Enzymkonjugat + Substrat/Chromogen → Farbe.
Polymer-Methoden
Hier wird der Primär AK (direkte M.) bzw. der Sekundär AK (indirekte M.) mit einem oder mehreren Polymer-Molekülen (Dextran oder Polypeptid) bestückt. Diese Polymere sind markiert mit möglichst viel Enzym, das wiederum Substrat- und Chromogenumsetzung bewirkt. Somit erreicht man eine verstärkte Anfärbung am Ort des Antigens. Der Vorteil liegt darin, kein Biotin verwenden zu müssen, das als "endogenes Biotin" Hintergrundfärbung verursachen könnte. Die Methode ist meist sensitiver und schneller als LSAB. Der Nachteil liegt in der Molekülgröße, die ins Gewebe gebracht werden muss und zu sterischen Behinderungen am Bindungsort führen kann.
Doppelimmunmarkierung
Eine Doppelimmunmarkierung oder Doppelimmunfärbung bezeichnet die Sichtbarmachung zweier Epitope auf einer Untersuchungsprobe durch Verwendung zweier Antikörper oder Immunkonjugate. Als Immunkonjugate werden meistens Reporterenzyme, radioaktive Isotope (kurzlebige α- oder β-Strahler), Kolloide von Edelmetallen oder Fluorophore direkt über heterobifunktionelle Vernetzer an die Antikörper gekoppelt.[1]
Die Probe kann z. B. ein Western Blot, Zellen für eine Durchflusszytometrie, ein transmissionselektronenmikroskopisches Präparat oder ein immunhistochemisch oder durch Immunfluoreszenz gefärbter Dünnschnitt sein. Die Doppelmarkierung wird auch im Zuge einer virologischen Diagnostik eingesetzt.
Direkte Färbung
Zur Doppelimmunfärbung wird zuerst die Probe mit den beiden, gegen zwei verschiedene Epitope gerichteten Antikörpern inkubiert. Werden die Antikörper gegen diese Epitope mit jeweils einem Reporterenzym gekoppelt, spricht man von einer direkten Markierung. Bei einer indirekten Markierung werden die gegen die gesuchten Epitope gerichteten Antikörper als Primärantikörper bezeichnet, da anschließend Immunkonjugate verwendet werden.
Indirekte Färbung
Bei einer indirekten Markierung über Primärantikörper und Immunkonjugat sind je ein zusätzlicher Waschschritt und eine Immunkonjugat-Inkubation notwendig. Dafür erfolgt eine Signalverstärkung durch die Verwendung eines Immunkonjugats, das gegen mehrere Epitope auf dem F(c)-Fragment des Antikörpers gerichtet ist, wodurch viele Reportermoleküle am Primärantikörper gruppiert werden. Zudem können die Immunkonjugate modular gegen alle Primärantikörper einer Art verwendet werden, was eine Kopplung jedes Primärantikörpers mit einem Reportermolekül vermeidet und damit Kosten reduziert. Werden zwei verschiedene indirekte Färbungen (mit getrenntem Primärantikörper und Immunkonjugaten mit Reporterenzymen) gleichzeitig verwendet, werden zur Unterscheidung der beiden Signale zwei Primärantikörper aus zwei verschiedenen Arten verwendet, bei denen die Immunkonjugate nicht kreuzreagieren. Dabei werden meistens unterschiedliche Reporterenzyme verwendet. Ebenso kann eine serielle Doppelimmunfärbung jedoch auch ausschließlich mit Peroxidase-Konjugaten erfolgen, in dem nach einer ersten Färbung die Peroxidase mit verdünnten Natriumazidlösungen inaktiviert wird und anschließend das ungebundene Natriumazid herausgewaschen und erneut mit einem Peroxidase-Konjugat gefärbt wird.
Reporterenzyme
Als Reporterenzyme werden z. B. die Meerrettichperoxidase (mit TMB, DAB, ABTS, AEC oder – in Form einer Chemolumineszenz – mit Luminol) und die Alkalische Phosphatase (mit BCIP und NBT oder mit Naphtol-AS-MX-Phosphat und Fast Red TR) eingesetzt. Die unterschiedlichen präzipitierenden Farbreaktionen werden seriell durchgeführt.
Fluorophore
Bei fluoreszenten Mehrfachmarkierungen werden die Fluorophore so ausgewählt, dass die Bereiche der Anregungs- und Abstrahlungswellenlängen möglichst weit auseinanderliegen. Dadurch wird ein übermäßiges Überstrahlen der Fluoreszenz in andere Farbkanäle des Fluoreszenzdetektors und die damit notwendige Fluoreszenzkompensation gemindert, welche zu Verlusten der Signalstärke führt und so die Nachweisgrenze anhebt.
Reportersysteme
Die verschiedenen Farbstoffe unterscheiden sich unter anderem in ihrer Farbe und Löslichkeit. Lösliche Farbstoffe werden bevorzugt bei einem ELISA eingesetzt, während bei der Immunhistochemie und dem Western Blot meist präzipitierende Farbstoffe verwendet werden.
Peroxidase (POD, Horseradish peroxidase HRP)
Der Peroxidase (meist der Meerrettichperoxidase) wird Wasserstoffperoxid als Substrat angeboten. Die freiwerdenden Protonen oxidieren das vorher fast farblose Chromogen zu seinem farbigen Endprodukt unter Bildung von Wasser.
- ABTS
- AEC (3-Amino-9-ethylcarbazol) bildet ein rosenrotes Endprodukt
- CN (4-Chlor-1-naphthol) reagiert unter Bildung eines blauen Farbstoffs
- DAB (3,3′-Diaminobenzidin) bildet ein braunes Endprodukt
- Luminol und andere Dioxetane reagieren unter Bildung von Chemolumineszenz mit folgender Autoradiographie
- TMB (Tetramethylbenzidin) bildet ein blaues Endprodukt, welches beim Abstoppen der Reaktion mit Schwefelsäure einen stabilen gelben Farbkomplex bildet
Alkalische Phosphatase (AP)
Der alkalischen Phosphatase werden organische Phosphatverbindungen als Substrat angeboten. Die AP spaltet Phosphat ab und die freigesetzte Verbindung reagiert zu einem farbigen Endprodukt.
- 5-Brom-4-chlor-3-indoxylphosphat (BCIP) wird in Verbindung mit Nitroblau-Tetrazoliumchlorid (NBT) zu einem violetten bis blauen Farbstoff umgesetzt: Das Tetrazolium-Salz oxidiert Indoxyl zum blauen Indigo-Farbstoff. Dabei wird das Tetrazoliumsalz reduziert zum blauen Formazan-Farbstoff.
- Naphthol-AS-MX-Phosphat bildet einen roten Farbstoff: Naphthol AS reagiert mit Fast Red TR zu einem unlöslichen Azofarbstoff.
- Neufuchsin liefert ein rosa rotes Reaktionsprodukt
Radioisotope
Radioisotope werden im Zuge einer Molekülmarkierung an Antikörper gekoppelt und nach einer Proteinreinigung per Autoradiographie oder per Szintillationszähler registriert.
Siehe auch
Literatur
- Friedrich Lottspeich, Haralabos Zorbas: Bioanalytik. Spektrum Akademischer Verlag, Heidelberg 1998, ISBN 3-8274-0041-4.
- Hubert Rehm, Thomas Letzel: Der Experimentator: Proteinbiochemie / Proteomics. 6. Auflage. Spektrum Akademischer Verlag, Heidelberg 2009, ISBN 978-3-8274-2312-2.
Einzelnachweise
- R. Lequin: Enzyme immunoassay (EIA)/enzyme-linked immunosorbent assay (ELISA). In: Clin. Chem. Band 51, Nr. 12, 2005, S. 2415–2418, doi:10.1373/clinchem.2005.051532, PMID 16179424.