Aktin
Aktin (englisch actin; von altgriechisch ἀκτίς aktis ‚Strahl‘[3]) ist ein Strukturprotein, das in allen eukaryotischen Zellen vorkommt. Es ist Bestandteil des Zytoskeletts und eines der fünf häufigsten Proteine in Eukaryoten; in Muskelzellen ist jedes zehnte Proteinmolekül ein Aktinmolekül, in anderen Zellen beträgt der Anteil 1–5 %.
| Übergeordnet |
| Mikrofilamente |
| Gene Ontology |
|---|
| QuickGO |
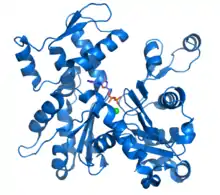

Aktin kommt in zwei Zuständen vor: als globuläres Einzelmolekül oder G-Aktin und aneinandergereiht als Filament oder F-Aktin. Charakteristisch für Aktinfilamente ist ihre dynamische Verlängerung und Verkürzung. Man zählt Aktinfilamente zu den Mikrofilamenten der Zelle. Sie dienen der Stabilisierung der äußeren Zellform sowie der Ausbildung von Zellfortsätzen, intrazellulären Verlagerungen und gerichteten zellulären Bewegungen. In mehrzelligen Organismen werden sie zu zentralen Komponenten für die Muskelkontraktion. Veränderungen in den für Aktine codierenden Genen können zu Muskel- und anderen Erkrankungen führen.
Geschichte
Aktin wurde erstmals 1887 von William Dobinson Halliburton experimentell aufgezeigt.[4] Er untersuchte in Analogie zur Gerinnung des Blutplasmas die Bedingungen, unter denen Proteine in Zellflüssigkeiten der Muskulatur ihre Zustandsform verändern („koagulieren“), und stellte den Einfluss eines Extraktes heraus, das er als „Myosin-Ferment“ bezeichnete.[5] Halliburton konnte seine Forschungen nicht weiter vertiefen, sodass die eigentliche Entdeckung des Aktins heute Brunó Ferenc Straub zugeschrieben wird, der als Forschungsassistent im Labor Albert Szent-Györgyis am Institut für medizinische Chemie der Universität von Szeged in Ungarn über Proteine in Muskelzellen arbeitete.
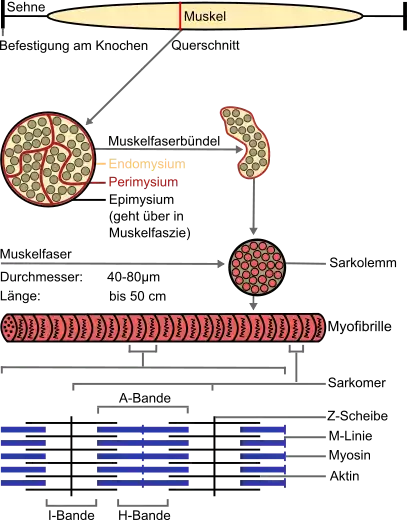
Straub entwickelte 1942 eine Technik zur Extraktion von Muskelproteinen, die es ihm erlaubte erhebliche Mengen an relativ reinem Aktin zu gewinnen, und die im Wesentlichen unverändert heute noch angewendet wird. Szent-Györgyi hatte zuvor die zähflüssigere Form eines Myosins langsamer Muskelzellen als die „aktivierte“ Form beschrieben, und da Straubs Protein bei Myosinlösungen den gleichen Effekt zeigte, wurde es als „Aktin“ bezeichnet. Gibt man dem Gemisch bzw. dieser Zusammensetzung der beiden Proteine, „Aktomyosin“ genannt, dann ATP zu, so nimmt seine Zähflüssigkeit wieder ab.
Während des Zweiten Weltkrieges waren Szent-Györgyi und Straub nicht in der Lage, in westlichen Wissenschaftsjournalen zu publizieren. Erst 1945 konnten sie ihre Thesen in den Acta Physiologica Scandinavica veröffentlichen,[6] womit der Begriff des Aktins auch im Westen bekannt wurde. Straub setzte seine Arbeit mit Aktin fort und berichtete 1950, dass Aktin gebundenes ATP enthält, welches während der Polymerisation der Mikrofilamente hydrolysiert wird zu ADP und anorganischem Phosphat, wobei das entstehende ADP zunächst gebunden bleibt.[7] Straub vermutete, dass die Umwandlung von gebundenem ATP zu gebundenem ADP bei der Muskelkontraktion eine erhebliche Rolle spielen würde. Tatsächlich trifft dies nur für glatte Muskulatur zu, wie jedoch erst 2001 experimentell nachgewiesen werden konnte.[7][8]
Die Abfolge der Aminosäuren in der Polypeptid-Kette eines Aktins wurde 1973 von M. Elzinga und Mitarbeitern vollständig angegeben.[9] Die Kristallstruktur des G-Aktins konnte 1990 von Kabsch und Kollegen dargestellt werden.[10] Im gleichen Jahr schlugen Holmes und Kollegen, nachdem sie (Ko-)Kristallisationsversuche mit unterschiedlichen Proteinen durchgeführt hatten, ein Modell für F-Aktin vor. Das Verfahren der Ko-Kristallisation wurde in den Folgejahren wiederholt eingesetzt, bis 2001 das isolierte Protein zusammen mit ADP kristallin dargestellt werden konnte. Allerdings gibt es bislang für das Aktin noch keine Röntgenstrukturanalyse mit hoher Auflösung. Möglich geworden war die Kristallisation des G-Aktin durch die Verwendung von Rhodamin-Aktin (G-Aktin welches chemisch mit dem Fluoreszenzfarbstoff Rhodamin verbunden ist), welches die Polymerisation durch Blockierung der Aminosäure Cystein-374 verhindert.[11] Christine Oriol-Audit gelang es bereits 1977, Aktin in Abwesenheit von Aktin-bindenden Proteinen (ABP) zu kristallisieren. Doch waren die resultierenden Kristalle für die damalige Technik zu klein, um sie weiter analysieren zu können.[12]
Zwar liegt derzeit für das filamentöse Aktin (F-Aktin), noch kein hochauflösendes Modell vor, doch konnten Sawaya und sein Team 2008 zu einem genaueren Bild der Struktur beitragen, das sich auf die Analyse verschiedener Kristalle von Aktin-Dimeren stützt, bei denen zwei G-Aktine über unterschiedliche Bindungsstellen verbunden sind.[13] Das hierauf beruhende Modell wurde von Sawaya und Lorenz weiter verfeinert. Mit Methoden der Kryo-Elektronenmikroskopie[14] und der Nutzung von Synchrotron-Strahlung konnte jüngst eine höhere Auflösung erreicht werden mit der Möglichkeit, die Interaktionen und Konformationsänderungen von G-Aktin während des Übergangs zu F-Aktin bei der Bildung von Aktin-Filamenten besser zu verstehen.[15][16]
Aufbau
Aktin wird von einer Genfamilie kodiert. Der Mensch hat sechs paraloge Varianten, die sich nur in wenigen Aminosäuren unterscheiden und in verschiedenen Gewebetypen exprimiert werden; funktionell sind diese Isoformen als alpha-, beta- oder gamma-Aktine differenzierbar.
| Gen | Protein | Genlocus | Länge (AA) | OMIM | Lokalisierung | Pathologie |
|---|---|---|---|---|---|---|
| ACTA1 | alpha-1 | 1q42.13 | 375 | 102610 | Skelettmuskulatur | Nemalin-Myopathie Typ 3 (NM3); Kongenitale Myopathien (CM/CFTD) |
| ACTA2 | alpha-2 | 10q22-24 | 375 | 102620 | Glatte Muskulatur; Aorta | Familiäres thorakales Aortenaneurysma Typ 6 (AAT6) |
| ACTB | zytoplasmisch-1; beta | 7p15-p12 | 374 | 102630 | Zytoplasma; Zytoskelett | juvenile-onset dystonia; Diffuses großzelliges B-Zell Lymphom |
| ACTC1 | kardial-alpha | 15q11-14 | 375 | 102540 | Herzmuskel | Dilatative Kardiomyopathie Typ 1R (DCM1R); Hypertrophe Kardiomyopathie Typ 11 (HCM11) |
| ACTG1 | zytoplasmisch-2; gamma-1 | 17q25 | 374 | 102560 | Zytoplasma; Zytoskelett | non-syndromic sensorineural deafness autosomal dominant Typ 20 (DFNA20) |
| ACTG2 | gamma-2 | 2p13.1 | 374 | 102545 | Glatte Muskulatur; Darm |
Liegt Aktin als einzelnes Molekül (Monomer) vor, wird es als globuläres Aktin oder G-Aktin bezeichnet. Seine zum Protein kugelförmiger Gestalt aufgefaltete Polypeptidkette hat bei einer Länge von 375 Aminosäuren ein Gewicht von ca. 42 kDa. Aktin ist ein evolutionär hoch konserviertes Protein; beispielsweise weichen die Aktine von Algen und die von Menschen nur in einem Siebtel ihrer Aminosäuren voneinander ab, beziehungsweise stimmen die codierenden Genabschnitte zu über 85 % in ihrer Basensequenz überein. Ein bakterielles Homolog des Aktins ist FtsA.
Aktinfilamente
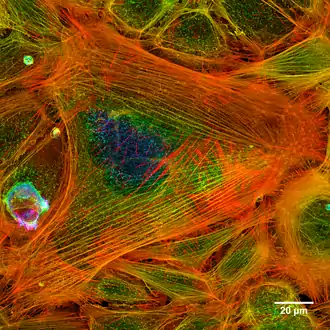
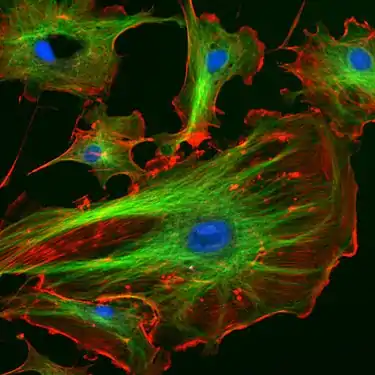
Monomeres globuläres oder G-Aktin kann sich aneinanderlagern zu dimeren, oligomeren und polymeren Gebilden. Polymeres filamentäres oder F-Aktin bildet den Hauptbestandteil von Mikrofilamenten. Bei dem so genannten Polymerisationsvorgang von G-Aktin zu F-Aktin, handelt es sich um eine nicht-kovalente Aneinanderreihung von G-Aktin-Einheiten zu einem doppelkettigen, helikalen Aktinfilament. Dieser Prozess verläuft dynamisch – ebenso der umgekehrte Vorgang, der Abbau des Filaments zu G-Aktin. Das Aktin-Netzwerk einer Zelle passt sich den aktuellen Erfordernissen rasch an und trägt so zur Zellbewegung bei.[17][18] Der Auf- und Abbau von Aktin-Filamenten kann durch Zytoskelett-Inhibitoren gehemmt werden.
Funktion
Stabilität
Aktin bildet als Bestandteil des Zytoskeletts ein dichtes, steifes, dreidimensionales kortikales Netz unterhalb der Plasmamembran, das durch die oben genannten Verbindungsproteine vernetzt ist. An bestimmten, spezifischen Punkten der Zelle tritt dieses Netzwerk verstärkt auf, z. B. in Membranausbuchtungen (Mikrovilli, Pseudopodien, Synapsen) sowie bei bestimmten Zellkontakten (Adherens Junctions, Tight Junctions) und tragen so zur Form und Stabilität von Zellen und Geweben bei.
Verankerung und Transportstrecke
Viele Transmembranproteine (Kanäle, Pumpen, Rezeptoren, Zelladhäsionsproteine) werden direkt oder indirekt an diesem kortikalen Aktinnetzwerk „gefesselt“ an ihrem Platz gehalten. Funktionell zusammengehörende Proteine werden dadurch auch in räumlicher Nähe gehalten. Entlang des Aktinnetzes erfolgt auch der Kurzstreckentransport von Vesikeln zur Membran durch Myosine, eine Klasse von Motorproteinen (während der Langstreckentransport von Mikrotubuli mit deren Motorproteinen Dynein und Kinesin übernommen wird). Dabei übernehmen die Myosine zum Teil die von Dynein/Kinesin herangebrachten Ladungen.
Zellmotilität
Viele eukaryotische Zellen besitzen ein hohes Maß an Bewegungsfähigkeit, Zellmotilität genannt. Sie erlaubt den Zellen gerichtete Formveränderungen bis hin zu Wanderbewegungen, der Zellmigration; so etwa in der Entwicklung von Nervenzellen oder bei einzelligen Organismen wie Amöben. Zellen des Immunsystems nutzen ihre Motilität, um als fremd erkannte Zellen im Körper unschädlich zu machen, Hautzellen brauchen sie beispielsweise, damit Wunden verheilen können. Diese Beweglichkeit wird durch verschiedene Prozesse möglich.
Um die Zellumgebung zu "erfühlen" und eine neue Bewegungsrichtung einzuleiten, spielt die Ausbildung von Zellauswüchsen wie Filopodien und Lamellipodien eine bedeutende Rolle. Diese werden durch Aktinfilamente gebildet und stabilisiert. Mit der gerichteten Aktinpolymerisierung in die Bewegungsrichtung kann eine Zelle auf Signale der Zellperipherie reagieren und Zellfortsätze ausbilden. Durch Aktin-Myosin-Interaktion in Fibrillenbündeln (stress fibers) werden diese zu kontraktilen Zugseilen, die durch die Zelle verlaufen und sie formgebend mit Elementen der Unterlage oder Matrix verspannen.

Kontraktile Strukturen
Der Kontraktionsapparat aller Arten von Muskulatur, also alle makroskopische Bewegung des Körpers und seiner inneren Organe (z. B. Darmperistaltik), basiert auf der Aktin-Myosin-Wechselwirkung. Dabei sind zahlreiche Aktinfilamente, Myosin II und andere Proteine in großer Zahl in hochgeordneter Weise angeordnet. Für Details sei auf die Artikel zu Muskelgewebe verwiesen.
Einzelnachweise
- Uncomplexed Actin, Protein Data Bank
- K. C. Holmes, D. Popp, W. Gebhard, W. Kabsch: Atomic model of the actin filament. In: Nature. 347, 1990, S. 21–22. PMID 2395461.
- Renate Wahrig-Burfeind (Hrsg.): Wahrig. Illustriertes Wörterbuch der deutschen Sprache. ADAC-Verlag, München 2004, ISBN 3-577-10051-6, S. 39.
- Dariusz Grzanka, Maciej Gagat, Magdalena Izdebska: Actin is required for cellular death. In: Acta histochemica, 2013.
- W. D. Halliburton: On Muscle-Plasma. In: J. Physiol. (London). Band 8, Nr. 3–4, August 1887, S. 133–202, PMID 16991477, PMC 1485127 (freier Volltext). Siehe insbesondere S. 147.
- A. Szent-Gyorgyi: Studies on muscle. In: Acta Physiol Scand. Band 9, Suppl, 1945, S. 25.
- F. B. Straub, G. Feuer: Adenosinetriphosphate. The functional group of actin. 1950. In: Biochim. Biophys. Acta. Band 1000, 1989, S. 180–195, doi:10.1016/0006-3002(50)90052-7, PMID 2673365.
- M. Bárány, J. T. Barron, L. Gu, K. Bárány: Exchange of the actin-bound nucleotide in intact arterial smooth muscle. In: J. Biol. Chem. Band 276, Nr. 51, Dezember 2001, S. 48398–48403, PMID 11602582. doi:10.1074/jbc.M106227200 (zurzeit nicht erreichbar)
- M. Elzinga, J. H. Collins, W. M. Kuehl, R. S. Adelstein: Complete amino-acid sequence of actin of rabbit skeletal muscle. In: Proc. Natl. Acad. Sci. U.S.A. Band 70, Nr. 9, September 1973, S. 2687–2691, doi:10.1073/pnas.70.9.2687, PMID 4517681, PMC 427084 (freier Volltext).
- W. Kabsch, H. G. Mannherz, D. Suck, E. F. Pai, K. C. Holmes: Atomic structure of the actin:DNase I complex. In: Nature. Band 347, Nr. 6288, September 1990, S. 37–44, doi:10.1038/347037a0, PMID 2395459.
- PDB 1J6Z; L. R. Otterbein, P. Graceffa, R. Dominguez: The crystal structure of uncomplexed actin in the ADP state. In: Science. Band 293, Nr. 5530, Juli 2001, S. 708–711, doi:10.1126/science.1059700, PMID 11474115.
- C. Oriol, C. Dubord, F. Landon: Crystallization of native striated-muscle actin. In: FEBS Lett. Band 73, Nr. 1, Januar 1977, S. 89–91, doi:10.1016/0014-5793(77)80022-7, PMID 320040.
- M. R. Sawaya, D. S. Kudryashov, I. Pashkov, H. Adisetiyo, E. Reisler, T. O. Yeates: Multiple crystal structures of actin dimers and their implications for interactions in the actin filament. In: Acta Crystallogr. D Biol. Crystallogr. Band 64, Pt 4, April 2008, S. 454–465, doi:10.1107/S0907444908003351, PMID 18391412, PMC 2631129 (freier Volltext).
- A. Narita, S. Takeda, A. Yamashita, Y. Maéda: Structural basis of actin filament capping at the barbed-end: a cryo-electron microscopy study. In: EMBO J. Band 25, Nr. 23, November 2006, S. 5626–5633, doi:10.1038/sj.emboj.7601395, PMID 17110933, PMC 1679762 (freier Volltext).
- T. Oda, M. Iwasa, T. Aihara, Y. Maéda, A. Narita: The nature of the globular- to fibrous-actin transition. In: Nature. Band 457, Nr. 7228, Januar 2009, S. 441–445, doi:10.1038/nature07685, PMID 19158791.
- J. von der Ecken, M. Müller, W. Lehman, D. J. Manstein, P. A. Penczek, S. Raunser: Structure of the F-actin-tropomyosin complex. In: Nature. Band 519, Nr. 7541, Mai 2015, S. 114–117, doi:10.1038/nature14033, PMID 25470062.
- P. W. Gunning, U. Ghoshdastider, S. Whitaker, D. Popp, R. C. Robinson: The evolution of compositionally and functionally distinct actin filaments. In: Journal of Cell Science. Band 128, Nr. 11, 2015, S. 2009–2019, doi:10.1242/jcs.165563, PMID 25788699.
- U. Ghoshdastider, S. Jiang, D. Popp, R. C. Robinson: In search of the primordial actin filament. In: Proc Natl Acad Sci U S A. Band 112, Nr. 30, 2015, S. 9150–9151, doi:10.1073/pnas.1511568112, PMID 26178194.