HIV-Test
Ein HIV-Test ist ein Verfahren, mit dem festgestellt werden kann, ob eine Person oder eine Blutspende mit dem Humanen Immundefizienzvirus (HIV) infiziert ist. Mit Hilfe von HIV-Tests kann die Infektion in Serum, Plasma, Speichel oder Urin festgestellt werden. Sie detektieren Antigene oder RNA von HIV oder vom Körper gebildete Antikörper gegen HIV.
Bei HIV-Tests werden Suchtests und Bestätigungstests unterschieden.[1] Ziel eines Suchtests (z. B. ELISA-Suchtest) ist es, möglichst alle infizierten Personen zu erkennen. Dabei wird in Kauf genommen, dass auch einige nichtinfizierte Personen fälschlicherweise positiv (Anti-HIV reaktiv) getestet werden. Dementsprechend brauchen Suchtests eine hohe Sensitivität, haben aber eine relativ niedrige Spezifität.
Wird eine Person im Suchtest positiv getestet, so ist in vielen Ländern ein Bestätigungstest (in Deutschland und den USA: Western-Blot-Bestätigungstest) vorgeschrieben, um eine falsch-positive Diagnose auszuschließen. Ein Bestätigungstest braucht daher eine höhere Spezifität als ein Suchtest.
HIV-Tests werden meist in einem Labor durchgeführt. Seit einigen Jahren existieren auch Point-of-Care-Tests („Schnelltests“), die nach Hinzugabe von Blut bereits nach einer halben Stunde ein Ergebnis anzeigen. Schnelltests werden in Entwicklungsländern eingesetzt, denen es an gut ausgestatteten Laboren fehlt, und in Situationen, bei denen es auf ein schnelles Ergebnis ankommt, z. B. für die Entscheidung einer Postexpositionsprophylaxe nach Nadelstichverletzungen.
Schnelltests mit Beratung und Ergebnis nach 30 Minuten bieten die Aidshilfen und Gesundheitsämter in vielen deutschen Großstädten an.[2] Selbsttests auf HIV dürfen in Deutschland seit Oktober 2018 frei verkauft werden, etwa in Apotheken, Drogerien und über das Internet.[3] In Österreich sind solche Selbstests seit Juli 2018 in Apotheken erhältlich.[4]
Häufigkeit
Jedem wird empfohlen, jährlich einen HIV-Test machen zu lassen. Bei mehr als 10 verschiedenen Sexualpartnern in zwölf Monaten wird empfohlen, alle 2 bis 3 Monate einen Test machen zu lassen.[5][6] Tests auf andere sexuell übertragbare Krankheiten sollten entsprechend dem eigenen Risiko ebenfalls regelmäßig gemacht werden.[7]
40% der 16–65 Jahre alten Bevölkerung in Deutschland gibt an, jemals einen HIV-Test gemacht zu haben, 11 % in den letzten 12 Monaten.[5] Ab 1999 lag der Anteil derer, die jemals einen Test gemacht hatten, bei über 20 %, seit 2002 bei/über 30 %. Der Anteil der in den letzten 12 Monaten getesteten wird seit 1994 erhoben und liegt jedes Jahr zwischen 8 und 11 Prozent.[8]
Etwa 2 Millionen Blut- und Blutplasmaspender werden bei jeder Spende routinemäßig einem HIV-Test unterzogen.[5]
Etwa 90 % aller Schwangeren in Deutschland werden auf HIV untersucht, was etwa 550.000 HIV-Tests pro Jahr ausmacht (Stand 2009, Rate und Anzahl seit 2001 kontinuierlich steigend).[5]
In einer 2010 in Deutschland durchgeführten Studie unter 50.000 Männern, die Sex mit Männern haben, (MSM) gaben 70 % an, jemals einen HIV-Test gemacht zu haben, davon hatte die Hälfte einen in den letzten 12 Monaten gemacht. Unter den unter 25 Jahre alten MSM gaben 47 % an, jemals einen Test gemacht zu haben, davon 67 % innerhalb der letzten 12 Monate.[5]
Etwa der Hälfte derer, bei denen HIV festgestellt wird, hätte besser geholfen werden können, wenn die Infektion eher erkannt worden wäre.[5]
In Deutschland werden jährlich etwa 2 Millionen HIV-Tests vorgenommen, meist in Verbindung mit dem Spenden von Blut oder Blutplasma. 130.000 Tests/Jahr finden bei Gesundheitsämtern oder Aidshilfen statt.[9] 1988 sollen es drei Millionen Tests gewesen sein.[10]
Suchtest mittels Immunassay
Funktionsweise des Immunassays
Automatisierte Immunassays (z. B. CMIA, ECLIA, FPIA) oder vereinzelt noch der klassische Enzyme Linked Immuno Sorbent Assay (ELISA) sind die gängigsten Screeningverfahren, um HIV im menschlichen Körper nachweisen zu können. Patienten, die in Deutschland um Abklärung bezüglich einer HIV-Infektion bitten, werden – sofern sie nicht auf einer anderen Untersuchungsmethode bestehen – mittels Immunassay untersucht. Überwiegend werden HIV-Tests in Routinelaboratorien am Tag des Eintreffens der Probe fertiggestellt. Vom Zeitpunkt der Blutabnahme bis zum Vorliegen eines negativen Ergebnisses beim Hausarzt vergehen durch die inzwischen verbreitete Automatisierung nur 1 bis 2 Arbeitstage. Geht der Patient direkt zu einem medizinischen Labor, kann das Ergebnis oft noch am gleichen Tag abgeholt werden. Lediglich bei auffälligen Ergebnissen im Screeningtest verlängert sich die Bearbeitung, da dann Bestätigungstests erforderlich sind.
Die Immunassays bis einschließlich der 3. Generation können nur Antikörper gegen HIV-1 und HIV-2 nachweisen, nicht jedoch das Virus selbst. Da der Körper für die Produktion dieser Antikörper im Rahmen einer Immunantwort jedoch mehrere Wochen braucht, kann man erst zwölf Wochen nach einer möglichen Infektion mit HIV davon ausgehen, dass der Test bei fast allen Infizierten positiv ausfällt. Diesen Zeitraum zwischen möglicher Ansteckung und sicherem Nachweis der Antikörper nennt man „diagnostische Lücke“. Diese Testgeneration ist daher kaum noch im Routineeinsatz.
Immunassays der 4. Generation (seit 1999) können auch das sogenannte p24-Antigen im Blut nachweisen, ein Protein, das sich in der Umhüllung (Kapsid) von HIV-1 befindet.[1] Dieses findet sich schon vor Bildung der HIV-Antikörper im Blut, wodurch sich die diagnostische Lücke in Hinsicht auf HIV-1 verkürzt.
Immunassays besitzen eine eingeschränkte Spezifität, das heißt, dass bei einigen Probanden falsch-positive Ergebnisse ermittelt werden. Deswegen wird bei einem positiven Ergebnis im Immunassay anschließend ein Bestätigungstest mittels der aufwendigeren Western-Blot-Methode (genauer gesagt Immunoblot) durchgeführt. Nur wenn auch dieser positiv ist, wird dem Patienten das Ergebnis „HIV-positiv“ mitgeteilt.[1]
Technische Durchführung eines Immunassays (im Labor)
Für häufig angeforderte Tests, wie auf HIV oder Hepatitis, werden inzwischen überwiegend Laborvollautomaten eingesetzt (sog. Random access analyzer), um über den gesamten Tag hinweg Einzelproben messen zu können. Der klassische ELISA unter Verwendung von Mikrotiterplatten, der auf die Durchführung von Mess-Serien ausgelegt ist, wird in der HIV-Diagnostik wegen der Dringlichkeit für den Patienten nur noch vereinzelt eingesetzt.
Von der zu testenden Blutprobe werden die Blutzellen mittels Zentrifugation abgetrennt und die verbleibende gelblich-klare Flüssigkeit, das so genannte Blutserum, barcodiert in den Laborautomaten gestellt, welcher die Untersuchung vollautomatisiert durchführt und das Ergebnis an die Labor-EDV überträgt. Der reine Messvorgang liegt im Bereich von Minuten (Laborautomat) bis Stunden (ELISA).
Wenn Antikörper im Serum vorliegen, die vom Immunsystem eines HIV-Infizierten gebildet wurden, heften diese sich an die im Testkit enthaltenen, inaktivierten HIV-Proteine. Je nach Detektionsprinzip des verwendeten Immunassays erfolgt die anschließende Auswertung des Messsignals, z. B. durch Fluoreszenz, Chemolumineszenz oder enzymatisch. Der Test wird immer im Vergleich zu HIV-positiven und HIV-negativen Kontrollproben ausgewertet.
Vorteile des Immunassays
Immunassays sind eine relativ kostengünstige, einfache und vor allem schnelle Möglichkeit, das HI-Virus nachzuweisen. Der Test kostet beim Hausarzt als Selbstzahlerleistung ca. 20–25 Euro (Gebührenordnung für Ärzte 2010), wobei viele Gesundheitsämter solche Tests auch kostengünstiger oder kostenlos anbieten (dies meist aber erst 12 Wochen nach Risikokontakt). Wird der Immunassay mit ausreichendem zeitlichem Abstand nach dem letzten Risikokontakt durchgeführt, sind die Ergebnisse äußerst genau.
Nachteile des Immunassays
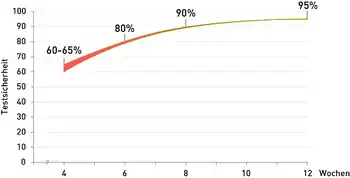
Der größte Nachteil des Immunassays liegt darin, dass eine nahezu hundertprozentige Ausschlusswahrscheinlichkeit einer HIV-Infektion im Regelfall erst nach zwölf Wochen gegeben ist. Dies bedeutet, dass Immunassays, die vor Ablauf der Zwölf-Wochen-Frist durchgeführt werden, eine ggf. vorhandene HIV-Infektion nicht erkennen, da noch nicht genügend HIV-Antikörper im menschlichen Organismus produziert worden sind. Beim Immunassay ist die „diagnostische Lücke“ (Zeitraum vom Infektionszeitpunkt bis zum sicheren Nachweis der Infektion) also relativ groß. Dies gilt insbesondere bei HIV-2, da bei dieser Spezies statt des p24-Antigens (welches mit Immunassays der 4. Generation nachgewiesen werden könnte) das p26-Antigen auftritt (welches mit Immunassays der 4. Generation nicht nachgewiesen werden kann). Allerdings ist HIV-2 überwiegend auf Westafrika beschränkt und kommt in Deutschland nur extrem selten vor (durchschnittlich 1–2 Fälle pro Jahr).[11]
Es gelten bei Nutzung von Immunassays (bei Infizierten) folgende Nachweiswahrscheinlichkeiten:[12]
- Nach 4 Wochen liefert der Test in 60 bis 65 % der Fälle ein korrektes Ergebnis,
- nach 6 Wochen in 80 %,
- nach 8 Wochen in 90 %,
- nach 12 Wochen in 95 % (andere Quellen sprechen von 99 %).
Laut Robert Koch-Institut kann mit einem negativen Antikörpertest nach drei Monaten eine Infektion mit großer Sicherheit ausgeschlossen werden.[13]
Zweite diagnostische Lücke bei Immunassays der 4. Generation möglich
Um die diagnostische Lücke zwischen einem Risikokontakt und dem Nachweis der Infektion zu verkürzen, wurden die Immunassays dergestalt weiterentwickelt, dass bei Tests der 4. Generation neben dem reinen Antikörpernachweis nun auch noch ein HIV-1-p24-Antigen-Nachweis enthalten ist. Da das HIV-1-p24-Antigen bereits zu einem Zeitpunkt nachweisbar ist, zu welchem ein reiner Antikörpertest noch nicht anschlagen würde, kann somit im Regelfall eine HIV-1-Infektion früher ermittelt werden. Beachtet werden muss jedoch, dass das HIV-1-p24-Antigen nur für ca. vier Wochen im Körper nachweisbar ist. Dies ist im Normalfall nicht weiter nachteilig, da sich die Nachweisbarkeit des HIV-1-p24-Antigen und die Nachweisbarkeit von HIV-Antikörpern zeitlich überschneiden, so dass die Kombinationstests (Immunassay der 4. Generation) entweder auf den einen oder auf den anderen oder aber auf beide Bestandteile ansprechen. In Einzelfällen ist es jedoch vorgekommen, dass das p24-Antigen bereits wieder unter die Nachweisgrenze von HIV-Tests der 4. Generation zurückgegangen war, während die HIV-Antikörper die Nachweisgrenze noch nicht überstiegen hatten. Es hatte sich somit eine zweite diagnostische Lücke aufgetan, also ein Zeitraum, zu welchem das HIV-1-p24-Antigen nicht mehr, die HIV-Antikörper jedoch noch nicht nachweisbar waren[14]. Wurde nun in dieser Zeit eine Blutprobe entnommen und mittels Immunassay (4. Generation) getestet, so wurde bei diesen Patienten ein falsch-negatives Ergebnis ermittelt. Von Seiten der Testhersteller wurden bereits Anstrengungen unternommen, die „zweite diagnostische Lücke“ zu schließen.
Genauigkeit des Immunassays
Die Sensitivität und Spezifität des Immunassays variieren je nach verwendetem Testkit. Sensitivitäten von 99,9 % werden teilweise angegeben[15]. Dies würde bedeuten, dass von 1000 HIV-positiven Patienten 999 als solche erkannt werden und einer ein falsch-negatives Ergebnis erhält. Die Spezifität beträgt teilweise bis zu 99,9 %.[15] (Gedankenmodell zur Verdeutlichung: Würde jeder der 80 Mio. Einwohner Deutschlands sich testen lassen, bekämen bei alleiniger Anwendung des ELISA-Tests 80.000 Menschen ein falsch-positives Ergebnis; zum Vergleich sind etwa 78.000 tatsächlich mit HIV infiziert). Der positive prädiktive Wert, also die Wahrscheinlichkeit, dass eine Person mit positivem Test wirklich infiziert ist, hängt von der Prävalenz in der getesteten Gruppe ab und kann somit nicht allgemein angegeben werden. Bei niedriger Prävalenz, wie z. B. bei Personen ohne Risikofaktoren, liegt er mit unter 50 % deutlich unter der Spezifität. Liegen hingegen Risikofaktoren vor, steigt der Wert schnell an und erreicht Werte nahe der Spezifität (zur Bewertung eines Testergebnisses siehe auch: Beurteilung eines Klassifikators). Falsch-positive Mitteilungen an Patienten werden durch den nachfolgend beschriebenen Western-Blot-Bestätigungstest jedoch nahezu vollständig vermieden.
Sonstiges zum Immunassay
Es existieren Immunassays zum Nachweis einzelner HIV-Antigene, z. B. p24-Antigen. Diese spielen nur bei speziellen Fragestellungen eine Rolle.
Western-Blot-Bestätigungstest
Sofern der Immunassay positiv oder grenzwertig ausgefallen ist und somit ein erstes Indiz auf eine vorhandene HIV-Infektion vorliegt, wird seitens des Labors routinemäßig ein serologischer Bestätigungstest durchgeführt. Dieser Bestätigungstest erfolgt mittels der aufwendigeren Western-Blot-Methode (genauer gesagt Immunoblot), die ebenfalls HIV-spezifische Antikörper nachweist. Hierzu werden vom Hersteller des Tests eine Reihe unterschiedlicher HIV-Proteine nebeneinander auf eine Trägermembran aufgebracht. Der Streifen wird in eine verdünnte Serumprobe des Patienten eingelegt. Wenn Antikörper gegen HIV beim Patienten vorhanden sind, heften sich diese an die Virusproteine auf dem Streifen. Nach weiteren Arbeitsschritten werden dunkle Striche auf dem Teststreifen sichtbar. Sie zeigen an, gegen welche Virusproteine der Mensch Antikörper gebildet hat. Immunoblots, bei denen Virusproteine von HIV-1 und HIV-2 repräsentiert sind, können außerdem eine Unterscheidung zwischen den beiden Virustypen ermöglichen. Nach WHO-Empfehlung wird die Diagnose „HIV-positiv“ auf der Grundlage des Nachweises von Antikörpern gegen mindestens zwei verschiedene Virusproteine gestellt. Auf diese Weise wird der zuvor positive oder grenzwertige Suchtest widerlegt oder bestätigt und eine noch größere Spezifität (ca. 99,9996 %) erreicht[16].
Kann ein positives Ergebnis im Immunassay mittels Western Blot (der nur Antikörper nachweisen kann) nicht bestätigt werden, muss eine HIV-PCR zum direkten Erregernachweis durchgeführt werden, weil es sein kann, dass der Immunassay nur auf das p24-Antigen des Virus reagiert, während noch keine Antikörper vorhanden sind. Ist der Immunassay weder durch Blot noch durch eine HIV-PCR zu bestätigen, kann angenommen werden, dass der Immunassay „unspezifisch“ reagiert hat, d. h. durch eine andere Ursache als eine HIV-Infektion positiv wurde. Antikörpertests können nach kurz zurückliegenden akuten Erkrankungen, Grippeimpfungen und Allergien falsch positive Befunde liefern.[17] In solchen Fällen kann es vorkommen, dass die Person Monate nach einem positiven Immunassay wieder einen negativen Befund erhält.
Ein positives Ergebnis wird dem Patienten nur mitgeteilt, wenn sowohl der Suchtest als auch der Western Blot positiv sind, d. h. sicher Antikörper nachweisbar sind, oder wenn das Virus mittels PCR direkt beim Patienten nachgewiesen werden kann.
RT-PCR-Test
Funktionsweise des PCR-Tests
Das RT-PCR-Verfahren ist eine der genauesten Untersuchungsmethoden auf HIV-Infektionen, zugleich aber auch eine der teuersten. Genau wie beim Immunassay der 4. Generation, wo die Viren direkt anhand des p24-Antigens nachgewiesen werden können, erfolgt beim PCR-Test der direkte Nachweis durch Prüfung auf spezifisch virale Nukleinsäuresequenzen. Dabei wird im ersten Schritt durch reverse Transkriptase (RT) virale RNA in cDNA umgewandelt. Im Rahmen der Polymerase-Kettenreaktion (PCR) wird diese cDNA anschließend vervielfältigt. Da die Vervielfältigung exponentiell verläuft, lassen sich bei quantitativen PCR-Tests auch Aussagen über die ursprüngliche Viruskonzentration (Viruslast) der Probe treffen, wobei der durch die kommerziellen Labortests abgedeckte Messbereich von 20 bzw. 40 Kopien/ml (z. B. Roche Diagnostics COBAS TaqMan bzw. Abbott RealTime) bis 10.000.000 Kopien/ml Blut reicht. Fällt ein solcher Test negativ aus, so liegt entweder keine HIV-Infektion vor oder aber die Viruslast befindet sich unterhalb der Nachweisgrenze. Da gerade in der Anfangsphase einer HIV-Infektion aufgrund der noch fehlenden körpereigenen Antikörper eine außerordentlich hohe Viruslast vorliegt, ist ein negativ verlaufender PCR-Test, der mindestens 15 Tage nach dem Risikokontakt durchgeführt wurde, in der Regel als eindeutiges Zeichen für das Nichtvorhandensein einer HIV-Infektion zu werten.
Der PCR-Test dauert mehrere Stunden. Vom Zeitpunkt der Blutentnahme bis zur Ergebnisübermittlung vergehen daher im Regelfall ein bis zwei bzw. drei bis vier Werktage, je nachdem, ob die Blutentnahme direkt im Labor oder beim behandelnden Arzt stattgefunden hat. Das PCR-Verfahren wird bei Infizierten standardmäßig zur Überwachung der antiretroviralen Therapie eingesetzt und findet ferner auch im Blutspendewesen Anwendung. Außerdem wird der PCR-Test bei Verdacht auf eine akute HIV-Infektion bei der Aufnahme in der Rettungsstelle standardmäßig durchgeführt.
PCR-Tests begleitend zur antiretroviralen Therapie
Um den Verlauf und den Erfolg der antiretroviralen Therapie beobachten zu können, wird ein quantitatives PCR-Verfahren verwendet, welches die Anzahl der viralen RNA-Kopien im Blut bestimmt. Diese Bluttests werden in der Regel alle drei Monate durchgeführt, wodurch sich die Entwicklung der Viruslast im Blut des Infizierten nachverfolgen lässt. Dies ist unter anderem notwendig, um den Erfolg der antiretroviralen Therapie zu verfolgen, deren Ziel es ist, die Viruslast so weit zu verringern, bis sie dauerhaft unterhalb der Nachweisgrenze liegt.
PCR-Tests im Blutspendewesen
Bei Blut- und Plasmaspenden werden obligatorisch PCR-Tests durchgeführt, um positive Spenden auszusondern. Dazu werden in der Regel Blutspendeproben von Dutzenden von Menschen gemischt (engl. Fachbegriff pooling) und dann gemeinsam nach HIV-Erbgut untersucht. Ist das Resultat positiv, werden dann die Blutproben von kleineren und noch kleineren Untergruppen untersucht, um so die Herkunft des gefundenen Viren-Erbgutes auf den einzelnen Spender zurückzuführen.
PCR-Test zur Diagnose
Zur Primärdiagnose einer HIV-Infektion sollten keine quantitativen, sondern qualitative PCR-Tests verwendet werden, da diese methodisch einfacher sind und daher auch bei HIV-Subtypen und -Stämmen ansprechen können, bei denen ein quantitativer PCR-Test eventuell negativ ausfällt. Die Kosten von ca. 100–150 Euro müssen dafür oft selbst getragen werden. Aufgrund der sehr geringen HIV-2-Verbreitung in Mitteleuropa (siehe Abschnitt „Nachteile“) ist ein HIV-1-PCR-Test in aller Regel ausreichend – es sei denn, der Spender hatte eine bekannte HIV-2-Infektion oder der Risikokontakt fand in Westafrika statt. Der qualitative PCR-Test kann im Gegensatz zum Antikörpertest schon 15 Tage nach dem Risikokontakt durchgeführt werden, weil er durch den direkten Nachweis der viralen RNA bereits zu diesem Zeitpunkt eine zuverlässige Erkennungswahrscheinlichkeit gewährleistet. Zum Ausschluss einer HIV-Infektion wird der PCR-Test jedoch von den Herstellern ausdrücklich nicht empfohlen[18][19], auch das Robert Koch-Institut lehnt einen Einsatz der PCR zu Diagnostik-Zwecken ab.[12]
Vorteile des PCR/RT-PCR-Verfahrens
Das PCR/RT-PCR-Verfahren weist im Gegensatz zum ELISA-Verfahren eine kleinere diagnostische Lücke auf, da bereits 15 Tage nach einem Risikokontakt eine Aussage über eine mögliche HIV-Infektion gemacht werden kann.[20] Das PCR-Verfahren weist eine sehr hohe Spezifität von 100 % und die beste Sensitivität aller HIV-Tests mit einer unteren Nachweisgrenze von 40 Kopien/ml (95 % Sensitivität) auf, die ab 75 Kopien/ml eine annähernd 100%ige Detektion erlaubt.[21] Der Vorteil einer frühzeitigen Erkennung einer HIV-Infektion liegt in der vermuteten positiven Wirkung, die einem Behandlungsbeginn noch im Verlauf der akuten HIV-Infektionsphase zugeschrieben wird.
Nachteile des PCR/RT-PCR-Verfahrens
Ein freiwilliger HIV-Test per PCR/RT-PCR-Verfahren muss vom Patienten selbst bezahlt werden. Die Kosten betragen etwa 100 bis 150 Euro je HIV-Typ (Stand 2008). Neben dem in Deutschland weit verbreiteten HIV-1 mit ca. 99,7 % aller hiesigen HIV-Infektionen kann ergänzend auch auf das deutlich seltenere HIV-2 getestet werden (nur 100 bestätigte Fälle in Deutschland, Stand Oktober 2007).[22]
HIV-Tests bei Neugeborenen
Bei Neugeborenen hat ein Antikörper-Test keine Aussagekraft, da die IgG-Antikörper der Mutter durch die Plazenta in das Blut des Kindes gehen und daher ein falsch positives Testergebnis entsteht. Kommerziell erhältliche Tests zum Nachweis von IgM- oder IgA-Antikörpern, welche vom Kind gebildet werden, sind noch nicht vorhanden. Daher ist die gängige Untersuchungsmethode bei Neugeborenen und Säuglingen die RT-PCR.
Point-of-Care-Tests
In bestimmten Situationen kann eine schnelle Abklärung einer bestehenden HIV-Infektion sinnvoll sein. Ein Beispiel hierfür ist ungewollter Blutkontakt während eines chirurgischen Eingriffs, etwa wenn der operierende Arzt sich an einer Nadel sticht und der HIV-Status des Patienten unbekannt ist. Bei Feststellung einer HIV-Infektion des Patienten, kann eine HIV-Postexpositionsprophylaxe des Arztes eingeleitet werden, deren Erfolg maßgeblich davon abhängt, wie klein der Zeitraum zwischen Exposition und Beginn der Prophylaxe ist. Der Schnelltest liefert bereits nach 15–30 Minuten ein Ergebnis, wobei das Risiko für ein falsch-positives Ergebnis höher ist als bei anderen Testmethoden. Fällt das Ergebnis grenzwertig oder positiv aus, muss zur Bestätigung stets ein weiterer Test (in der Regel Western Blot) durchgeführt werden, bevor die Diagnose „HIV-positiv“ gestellt werden kann.
Solche Testverfahren werden „Point-of-care“-Tests, Heimtests, Schnelltests oder „bedside“-Tests genannt. Sie basieren auf einem der vier immundiagnostischen Prinzipien Partikel-Agglutination, Immunodot (Dipstick), Immunofiltration oder Immunchromatografie.
Hintergrund der Entwicklung von Point-of-Care-Tests war die Notwendigkeit, auch in Ländern mit schlechter medizinischer Infrastruktur, wie beispielsweise in weiten Teilen Afrikas, eine Möglichkeit zu schaffen, HIV-Infektionen rasch nachzuweisen. Als größter Auftraggeber von Point-of-Care-Tests gilt die UNO, die diese millionenfach in afrikanischen Ländern verteilt.
Technische Durchführung eines Point-of-Care-Tests
Der Patient sticht sich – mittels eines im Test-Set enthaltenen mechanischen Fingerstechers oder einer Lanzette – in eine Fingerkuppe oder ein Ohrläppchen. Nun kann der Patient einen Bluttropfen in die Probenvertiefung des Testplättchens fallen lassen und gibt einen Tropfen Pufferlösung hinzu. Nach der vorgegebenen Zeit wird die Anzeige des Testplättchens überprüft. Erscheint lediglich ein Ausschlag im Kontroll-Bereich, so wurde der Test ordnungsgemäß durchgeführt und (noch) keine HIV-Infektion nachgewiesen. Erscheint sowohl ein Ausschlag im Kontroll-Bereich als auch im Test-Bereich, so wurde der Test ordnungsgemäß durchgeführt und der Test ist positiv.
Vorteile von Point-of-Care-Tests
Point-of-Care-Tests sind in vielen Ländern der Dritten Welt die einzige Möglichkeit, für große Teile der Bevölkerung überhaupt eine Nachweismöglichkeit bereitzustellen. Ferner entfällt aufgrund der schnellen Reaktionszeit (15 Min.), im Gegensatz zum klassischen Test im Labor, ein Warten auf die Laborergebnisse. Seit 2010 sind auch Point-of-Care-Tests analog zum ELISA-Test Generation 4 erhältlich. Hierbei wird zusätzlich zur Suche nach Antikörpern auch nach dem HIV-1-p24-Antigen gesucht, welches bereits 15 Tage bis spätestens 45 Tage nach einer Infektion durch den Test entdeckt werden kann.
Nachteile von Point-of-Care-Tests
Point-of-Care-Tests werden oft in Eigenleistung des möglicherweise Infizierten ohne Anwesenheit einer laborqualifizierten Person durchgeführt. Neben möglichen Fehlern bei der Durchführung des Tests steht der Patient dem, möglicherweise positiven, Testergebnis alleine gegenüber. In einer solchen Situation besteht die Gefahr, dass ein positiv Getesteter eine Kurzschluss-Handlung (z. B. Selbsttötung) begeht, da niemand da ist, der ihn fachkundig berät. Da oft kein Bestätigungstest durchgeführt wird, bestehen weitere Gefahren. So kann ein falsch negatives Ergebnis zu unvorsichtigem Verhalten und damit zur Ansteckung weiterer Personen beitragen.
Da die meisten Point-of-Care-Tests lediglich auf Antikörpernachweis abzielen, benötigt man – analog zu einem ELISA-Test der 3. Generation – einen zeitlichen Abstand von mindestens drei Monaten, um eine nahezu hundertprozentige Aussage bezüglich des Ausschlusses einer HIV-Infektion treffen zu können. Aktuelle Point-of-Care-Tests weisen auch Antikörper gegen HIV-2 nach. Lediglich einer der Point-of-Care-Tests sucht auch nach dem HIV-p24 Antigen (siehe ELISA-Test Generation 4).
In Deutschland lehnten früher medizinische Fachkreise den freien Verkauf von HIV-Heimtests grundsätzlich ab, da solche Tests die weltweit anerkannten „VCT-Standards“ (Voluntary Counselling and Testing) nicht erfüllen, nach denen HIV-Tests nur freiwillig und im Kontext einer Beratungssituation durchgeführt werden sollen. Und schließlich ist im Gegensatz zur qualitätsgesicherten Anwendung der Schnelltests im Gesundheitswesen bei Heimtests keine entsprechende Qualitätskontrolle möglich.[23]
Rechtslage in Deutschland
Seit 29. September 2018 sind in Deutschland HIV-Heimtests frei verkäuflich.
Die Deutsche Aidshilfe informierte im September 2019, dass etwa 30.000 Tests im ersten Jahr gemacht wurden.[24]
Meldepflicht
In Deutschland besteht gemäß Infektionsschutzgesetz (§ 7 IfSG) für das diagnostizierende Labor die Pflicht, eine HIV-Infektion anonymisiert dem Robert Koch-Institut in Berlin zu melden. Eine Meldepflicht für das Vollbild AIDS besteht jedoch nicht.
Umgekehrt ist eine HIV-Infektion in Österreich nicht meldepflichtig, eine AIDS-Erkrankung jedoch schon. Diese Meldung erfolgt in anonymisierter Form an die Bezirksverwaltungsbehörde (Gesundheitsamt), welche die Daten an ein elektronisches Register des Ministeriums für Gesundheit, Familie und Jugend weiterleitet.[25]
In der Schweiz sind erfüllte klinische Kriterien zur Erkrankung AIDS und der positive laboranalytische Befund zum HI-Virus meldepflichtig und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 bzw. Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. Vom Arzt, Spital usw. sind (nur) Vornamenscode, Wohnort, Geburtsdatum, Geschlecht, Staatsangehörigkeit und Herkunftsland, vom Labor sind (nur) Vornamenscode, Wohnort, Geburtsdatum und Geschlecht zur Person zu melden.
Literatur
- Lutz Gürtler: Retroviren. In: Birgid Neumeister, Heinrich K. Geiss, Rüdiger W. Braun, Peter Kimmig (Hrsg.): Mikrobiologische Diagnostik. 2. Auflage. Georg Thieme Verlag, Stuttgart / New York 2009, ISBN 978-3-13-743602-7, S. 959–969.
Weblinks
- Der HIV-Test. HIVbuch
Einzelnachweise
- Lutz Gürtler: Retroviren. In: Birgid Neumeister, Heinrich K. Geiss, Rüdiger W. Braun und Peter Kimmig (Hrsg.): Mikrobiologische Diagnostik. 2. Auflage. Georg Thieme Verlag, Stuttgart / New York 2009, ISBN 978-3-13-743602-7, S. 959–969.
- hivandmore.de Bundesweite Übersicht anonymer HIV-Teststellen mit Adressen, Öffnungszeiten und Wartezeit zum Ergebnis
- HIV-Selbsttests, Website des Paul-Ehrlich-Instituts, abgerufen am 25. Novembder 2018.
- Run auf HIV-Selbsttests in Apotheken, DAZ.online, 30. Juli 2018.
- hivandmore
- macht-doch-jeder.de
- Infomappe für die Beratung in Aidshilfen 2016
- BZgA 2007
- Gesundheitsberater Berlin
- Medical Tribune laut Spiegel 17/1988 vom 25. April 1988
- HIV-2 - Im Schatten des großen Bruders. Abgerufen am 23. Mai 2014.
- FAQ des Robert Koch-Instituts. Stand: 26. November 2013. Abgerufen am 7. Juli 2014.
- HIV/AIDS - RKI-Ratgeber für Ärzte. Archiviert vom Original am 11. März 2014. Abgerufen am 10. März 2014.
- T. Meier, E. Knoll, M. Henkes, G. Enders, R. Braun: Evidence for a diagnostic window in fourth generation assays for HIV. In: Journal of clinical virology: the official publication of the Pan American Society for Clinical Virology. Band 23, Nummer 1–2, Dezember 2001, S. 113–116, ISSN 1386-6532. PMID 11595590.
- B. Serhir et al.: Multicenter Evaluation of Three Novel 4th Generation HIV Ag/Ab Combo Assays: Abbott Architect, Roche HIV Combi and Siemens Advia Centaur.. In: Sexually Transmitted Infections. .
- Kleinman et al.: False-Positive HIV-1 Test Results in a Low-Risk Screening Setting of Voluntary Blood Donation. In: JAMA. 280, Nr. 12, 1998, S. 1080–1085. PMID 9757856.
- Simonsen et al.: Multiple false reactions in viral antibody screening assays after influenza vaccination. In: American Journal of Epidemiology. Bd. 141, Nr. 11, S. 1089–1096.
- RealTime PCR: HIV-1 Assay. Abbott Molecular, abgerufen am 7. Juli 2014 (englisch): „This assay is not intended to be used as a donor screening test for HIV-1 or as a diagnostic test to confirm the presence of HIV-1 infection.“
- COBAS® AmpliPrep/COBAS® TaqMan® HIV-1 Test, v2.0 (Product sheet). Abbott Molecular, abgerufen am 7. Juli 2014 (englisch): „The COBAS® AmpliPrep/COBAS® TaqMan® HIV-1 Test, v2.0 is not intended for use as a screening test for the presence of HIV-1 in blood or blood products or as a diagnostic test to confirm the presence of HIV-1 infection.“
- Ruby Phelps et al.: Window-period human immunodeficiency virus transmission to two recipients by an adolescent blood donor. In: Transfusion. Bd. 44, Nr. 6, 2004, S. 929–933, ISSN 0041-1132.
- COBAS AmpliPrep, COBAS TaqMan HIV-1 Test. Die vollautomatisierte Bestimmung der HIV-1 Viruslast. Roche Diagnostics, Mannheim, 2005.
- Epidemiologisches Bulletin. HIV-Infektionen und AIDS-Erkrankungen in Deutschland. Robert Koch-Institut, Berlin 2007.
- Entwurf zur Änderung des deutschen Medizinproduktegesetzes vom 18. Dezember 2008
- 30.000 Tests in einem Jahr, Pharmazeutische Zeitung, 23. September 2019.
- Gesamte Rechtsvorschrift für Epidemiegesetz 1950, Fassung vom 07.07.2014. Bundeskanzleramt, 7. Juli 2014, abgerufen am 7. Juli 2014.