Epicocconon
Epicocconon ist ein Fluoreszenzfarbstoff aus dem Pilz Epicoccum nigrum.[3]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
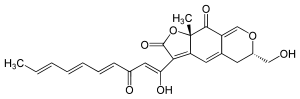 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Epicocconon | ||||||||||||
| Andere Namen | |||||||||||||
| Summenformel | C23H22O7 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 410,42 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Eigenschaften und Verwendung
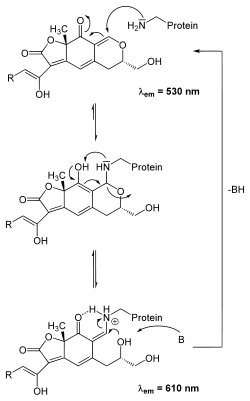
Das wasserlösliche Epicocconon fluoresziert schwach grünlich (λem = 520 nm) in seiner protonierten Form, nach Bindung eines Proteins verschiebt sich die maximale Fluoreszenz zu einer Wellenlänge von 605 nm.[4] Das Absorptionsmaximum liegt bei 395 nm.[5] Bei Zugabe von Base wird ein Proton abgegeben. Das resultierende Anion verliert jedoch die Fähigkeit zu fluoreszieren:

Der Farbstoff kann mit primären Aminen reagieren. Dies wird in der Biochemie im Rahmen einer Proteincharakterisierung genutzt, um Proteine anzufärben, insbesondere bei der Mengenbestimmung in Lösungen,[6] zur Verfolgung einer Proteolyse,[7] bei der SDS-PAGE,[8] bei der 2D-Gelelektrophorese mit In-Gel-Verdau und massenspektrometrischer Analyse,[9][10] sowie als Ladekontrolle bei Western Blots (Nachweisgrenze 1 ng nach 40 Minuten).[11][8] Die Färbung ist reversibel und kompatibel mit einer Immunfärbung oder Massenspektrometrie. Bei der Reaktion bildet sich ein intensives, rot-fluoreszierendes Enamin.[12] Sollten die Proteine aber in einem zu basischem Milieu vorliegen, wird das Enaminprodukt deprotoniert und verliert seine fluoreszenten Eigenschaften.
Synthetische Variante
Neben der natürlichen Variante aus dem Pilz existiert der Farbstoff mittlerweile auch als synthetisches Produkt.[13] Bezüglich der Färbeeigenschaften von Proteinen gibt es keine Unterschiede zwischen der natürlichen und der synthetischen Variante.[11]
Weblinks
- fluorophores.tugraz.at: Epicocconone
Einzelnachweise
- interchim.fr: Produktblatt (PDF; 370 kB), abgerufen am 29. Dezember 2012.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- P. J. Bell, P. Karuso: Epicocconone, a novel fluorescent compound from the fungus epicoccumnigrum. In: Journal of the American Chemical Society. Band 125, Nummer 31, August 2003, S. 9304–9305, doi:10.1021/ja035496+, PMID 12889954.
- J. A. Mackintosh, D. A. Veal, P. Karuso: Fluoroprofile, a fluorescence-based assay for rapid and sensitive quantitation of proteins in solution. In: Proteomics. Band 5, Nummer 18, Dezember 2005, S. 4673–4677, doi:10.1002/pmic.200500095, PMID 16267819.
- J. A. Mackintosh, H. Y. Choi, S. H. Bae, D. A. Veal, P. J. Bell, B. C. Ferrari, D. D. Van Dyk, N. M. Verrills, Y. K. Paik, P. Karuso: A fluorescent natural product for ultra sensitive detection of proteins in one-dimensional and two-dimensional gel electrophoresis. In: Proteomics. Band 3, Nummer 12, Dezember 2003, S. 2273–2288, doi:10.1002/pmic.200300578, PMID 14673778.
- J. A. Mackintosh, D. A. Veal, P. Karuso: Fluoroprofile, a fluorescence-based assay for rapid and sensitive quantitation of proteins in solution. In: Proteomics. Band 5, Nummer 18, Dezember 2005, S. 4673–4677, doi:10.1002/pmic.200500095, PMID 16267819.
- P. Karuso, A. S. Crawford, D. A. Veal, G. B. Scott, H. Y. Choi: Real-time fluorescence monitoring of tryptic digestion in proteomics. In: Journal of proteome research. Band 7, Nummer 1, Januar 2008, S. 361–366, doi:10.1021/pr0704480, PMID 18052032.
- Hubert Rehm, Thomas Letzel: Der Experimentator: Proteinbiochemie / Proteomics. 6. Auflage, Spektrum Akademischer Verlag, Heidelberg 2009. ISBN 978-3-8274-2312-2. S. 18, 28.
- D. R. Coghlan, J. A. Mackintosh, P. Karuso: Mechanism of reversible fluorescent staining of protein with epicocconone. In: Organic letters. Band 7, Nummer 12, Juni 2005, S. 2401–2404, doi:10.1021/ol050665b, PMID 15932208.
- N. S. Tannu, G. Sanchez-Brambila, P. Kirby, T. M. Andacht: Effect of staining reagent on peptide mass fingerprinting from in-gel trypsin digestions: a comparison of SyproRuby and DeepPurple. In: Electrophoresis. Band 27, Nummer 15, August 2006, S. 3136–3143, doi:10.1002/elps.200500740 PMID 16800026.
- C. P. Moritz, S. X. Marz, R. Reiss, T. Schulenborg, E. Friauf: Epicocconone staining: a powerful loading control for Western blots. In: Proteomics, Band 14, Nummer 1–2, Februar 2014, S. 162–168, doi:10.1002/pmic.201300089 PMID 24339236.
- D. R. Coghlan et al. : Mechanism of reversible fluorescent staining of protein with epicocconone. In: Org Lett. 7, Nr. 12, 2005, S. 2401–2404, PMID 15932208.
- A. Boulange, P. A. Peixoto, X. Franck: Diastereoselective IBX oxidative dearomatization of phenols by remote induction: towards the epicocconone core framework. In: Chemistry. Band 17, Nummer 37, September 2011, S. 10241–10245, doi:10.1002/chem.201101681 PMID 21809405.