Tumorkachexie
Tumorkachexie, seltener kanzeröse Kachexie genannt, ist die Bezeichnung für eine als Folge einer Krebserkrankung bei Patienten auftretende Stoffwechselstörung, die zu Auszehrung (Kachexie) und Abmagerung bei den Betroffenen führt. Eine Tumorkachexie ist eine häufige Komplikation bei Krebserkrankungen, insbesondere bei bösartigen Tumoren des Verdauungstraktes, die sich ungünstig auf Krankheitsverlauf, Lebensqualität und Prognose auswirkt und selbst unmittelbar lebensbedrohlich werden kann. Die Tumorkachexie ist ein wesentlicher Faktor für die hohe Sterberate bei Krebserkrankungen.[2][3]
| Klassifikation nach ICD-10 | |
|---|---|
| C80 | Kachexie durch bösartige Neubildung. Anmerkung:[1] |
| ICD-10 online (WHO-Version 2019) | |
Die molekularen und biochemischen Ursachen, die zu einer Tumorkachexie führen, sind hochkomplex und noch nicht vollständig aufgeklärt. Eine wichtige Rolle bei der Ausbildung dieses Syndroms spielen Stoffwechselprodukte des Tumors und Botenstoffe, die – als Folge der Krebserkrankung – vom Körper der Betroffenen gebildet werden. Hinzu kommen noch psychologische Faktoren sowie Nebenwirkungen krebstherapeutischer Maßnahmen, die zu einem Appetitverlust der Patienten führen können. Im Gegensatz zu dem Gewichtsverlust bei einer Unterernährung werden bei der Tumorkachexie nicht nur Fettreserven abgebaut, sondern auch die Skelettmuskulatur.
Eine wirksame kurative Behandlung gibt es derzeit nicht. Alle therapeutischen Ansätze sind bisher palliativ, das heißt lediglich krankheitslindernd.
Einordnung und Definition
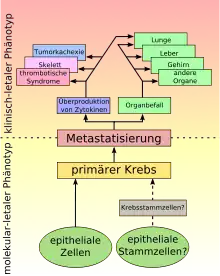
Die meisten Autoren bevorzugen für die Tumorkachexie den Begriff Syndrom. Diese Bezeichnung wird dem komplexen Sachverhalt gerechter als die Einordnung als eigenständige Erkrankung.[5] In der angelsächsischen Fachliteratur wird meist vom cancer cachexia syndrome (CCS) oder auch cancer anorexia-cachexia syndrome (CACS) gesprochen. Kachexie ist ein Kofferwort aus dem griechischen κακὸς = kakos = „schlecht“ und ἕξiς = hexis = „Zustand“.[6][7]
Die Kachexie wird im Allgemeinen als multifaktorielles Syndrom, das jeden Bereich des Körpers erfasst und am einfachsten in seiner fortgeschrittenen Form durch den massiven Verlust von subkutanem Fett und Skelettmuskulatur festgestellt werden kann[8] beschrieben. Es gibt derzeit weder für die Kachexie noch für die Tumorkachexie eine verbindliche oder standardisierte Definition,[9][10] was bei der hohen Prävalenz und Schwere dieses Syndroms wiederholt als unzulänglich angemahnt wurde.[11] Das Gleiche gilt bezüglich einer Klassifikation. Einer der Gründe hierfür ist das Fehlen von zuverlässigen Biomarkern, mit denen die Tumorkachexie diagnostisch mit Messwerten erfasst und klassifiziert werden könnte. Durch die fehlende Klassifikation gibt es derzeit keine dem Grad des Syndroms angepasste Behandlungsschemata.[8]
Für klinische Studien wurden bisher sehr unterschiedliche Definitionen für die Tumorkachexie herangezogen, die sich beispielsweise am prozentualen Verlust an Körpermasse oder dem Unterschreiten eines bestimmten Wertes beim Body-Mass-Index orientierten. Das Fehlen einer verbindlichen Definition erschwert den Vergleich klinischer Studien erheblich.[8]
Je nach gewählter Definition ergeben sich unterschiedliche Prozentsätze an Krebspatienten, die auch an einer Tumorkachexie leiden. Beispielsweise wurde eine Gruppe von 8541 Krebspatienten mit soliden Tumoren nach vier unterschiedlichen Kriterien analysiert. Nach der ICD-9-Diagnose Kachexie als Kriterium hätten 2,4 Prozent dieser Patienten eine Tumorkachexie. Bei einer erweiterten ICD-9-Klassifikation mit Kachexie, Anorexie, abnormalem Gewichtsverlust oder Problemen bei der Ernährung wären es 5,5 Prozent gewesen. Wird die Verschreibung von Arzneimitteln, wie Megestrol, Oxandrolon, Somatotropin oder Dronabinol, die auf eine Medikation einer Tumorkachexie hinweisen, als Kriterium herangezogen, so fielen 6,4 Prozent der Patienten unter dieses Kriterium. Wenn ein Verlust an Körpermasse von über 5 Prozent die Definition für die Tumorkachexie wäre, so hätten 14,7 Prozent dieser Krebspatienten dieses Kriterium erfüllt.[12]
Das Fehlen einer Definition der Kachexie hat negative Auswirkungen auf die Diagnose und Behandlung betroffener Patienten. Ebenso ist die Entwicklung und Zulassung von potenziellen Wirkstoffen dadurch erschwert. Am 13. und 14. Dezember 2006 wurde daher im Rahmen der Cachexia Consensus Conference in Washington, D.C. eine neue Definition der Kachexie vorgeschlagen. Danach ist die Kachexie „ein komplexes Stoffwechsel-Syndrom, das durch eine chronische Erkrankung bedingt ist und durch den Verlust an Muskelmasse, mit oder ohne Verlust an Körperfett, charakterisiert ist. Anorexie (Appetitlosigkeit), Entzündungen, Insulinresistenz und ein erhöhter Abbau von Muskelproteinen sind häufige Begleiterscheinungen einer Kachexie. Von der Kachexie, die mit einer erhöhten Morbidität verbunden ist, sind zu unterscheiden: Unterernährung, altersbedingter Verlust von Muskelmasse, primäre Depressionen, Malassimilation (verminderte Nährstoffausnutzung) und Hyperthyreose (Schilddrüsenüberfunktion)“.[13]
Eine aktuelle Empfehlung definiert eine Kachexie, wenn der
- Verlust an Körpermasse über 5 Prozent innerhalb von zwölf oder weniger Monaten beträgt und wenn
- gleichzeitig mindestens drei der fünf folgenden Kriterien erfüllt sind:
- Abnahme der Muskelkraft
- Fatigue
- Anorexie
- niedriger Fettfreie-Masse-Index (FFMI, fat-free mass index)
- abnormale biochemische Werte:
- erhöhte Markerwerte für Entzündungen
- Anämie (Hb <12 g/dl)
- niedriger Wert an Serumalbumin <3,2 g/dl
Dieser Definitionsvorschlag wurde allerdings bisher weder in epidemiologischen noch in klinischen Studien angewendet.[13]
Epidemiologie und gesundheitspolitische Bedeutung
| Art der Krebserkrankung | Inzidenz von Gewichtsverlust |
| Pankreastumor | 83 % |
| Magenkrebs | 83 % |
| Speiseröhrenkrebs | 79 % |
| Kopf-Hals-Karzinom | 72 % |
| Kolorektales Karzinom | 55 bis 60 % |
| Bronchialkarzinom | 50 bis 66 % |
| Prostatakrebs | 56 % |
| Brustkrebs | 10 bis 35 % |
| Alle Krebserkrankungen zusammen | durchschnittlich 63 % [14] |
Etwa 50 Prozent aller Krebspatienten sind im Laufe ihrer Erkrankung von einer Tumorkachexie betroffen.[15] Die Wahrscheinlichkeit einer Tumorkachexie ist dabei sehr stark von der Art der Krebserkrankung abhängig.[16] Nach der Sepsis (Blutvergiftung) ist die Tumorkachexie die häufigste Todesursache bei Krebserkrankungen. Je nach Autor liegt der Anteil der Tumorkachexie bei den Todesursachen von Krebserkrankungen bei 20 bis 50 Prozent.[2][16][17][18][19][20][21] Die Schwankungsbreite bei den Prävalenzdaten (Krankheitshäufigkeit) ist ursächlich auf die bereits verwiesene fehlende Definition der Tumorkachexie zurückzuführen.
Für die Wahrscheinlichkeit der Ausbildung einer Tumorkachexie spielt die Art der Krebserkrankung eine große Rolle. So versterben beispielsweise etwa 80 Prozent der Patienten mit Pankreastumor und 30 bis 50 Prozent der Patienten mit einer Krebserkrankung im Bereich des Magen-Darm-Traktes an einer Tumorkachexie.[16] Bei bis zu 85 Prozent aller Patienten mit einer gastrointestinalen (Magen/Darm) Krebserkrankung kommt es im Krankheitsverlauf zu einer Tumorkachexie.[22] Bei soliden Tumoren ist die Wahrscheinlichkeit einer Tumorkachexie deutlich höher als bei Krebserkrankungen des blutbildenden Systems (Leukämien, Myelodysplastische Syndrome und andere hämatologische Neoplasien).[23] Eine Ausnahme bei den soliden Tumoren bildet das Mammakarzinom. Hier ist die Wahrscheinlichkeit für eine Tumorkachexie signifikant niedriger.[23][24][25] Die Ausbildung der Tumorkachexie verläuft auch bei der gleichen Tumorart je nach Patient sehr individuell. Die Tumorkachexie kann bei betroffenen Patienten in allen Stadien der Krebserkrankung beobachtet werden, ist aber vor allem im terminalen Stadium der Erkrankung besonders häufig vorzufinden.[2]
Kinder und ältere Menschen sind von einer Tumorkachexie signifikant häufiger betroffen.[23]
Auch absolut gesehen ist die Tumorkachexie eine der häufigsten Todesursachen. In Deutschland sterben grob geschätzt etwa 50.000 Menschen pro Jahr an einer Tumorkachexie.[26] Exakte Daten sind wegen der fehlenden Definition der Tumorkachexie und der üblichen Totenscheinpraxis nicht verfügbar.
Klinisches Bild
Eine Tumorkachexie ist im Wesentlichen durch einen Gewichtsverlust des Patienten, häufig verbunden mit einer Anorexie (Appetitlosigkeit), Entzündungserscheinungen, Insulinresistenz und den Abbau der Skelettmuskulatur gekennzeichnet.[28][29] In vielen Fällen ist die Anorexie ein Symptom der Tumorkachexie, allerdings kann sich eine Tumorkachexie auch ohne Anorexie entwickeln.[12][30][31] Das Auftreten der Anorexie beschleunigt die Progression der Tumorkachexie.[19]
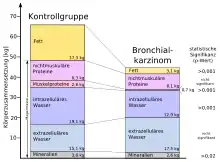
Während bei Gesunden ein Gewichtsverlust durch einen gesteigerten Appetit und damit verbunden durch eine höhere Nahrungsaufnahme kompensiert wird, ist dies bei kachektischen Patienten nicht der Fall.[23][25] Die Tumorkachexie führt bei den betroffenen Patienten zu einer allgemeinen Schwäche, Kraftabnahme und Immobilität sowie zu Müdigkeit, Antriebslosigkeit und Depressionen,[32][33][34] was wiederum zu einer Beeinträchtigung der Lebensqualität führt.[35][36] Die von den Betroffenen selbst eingeschätzte Lebensqualität wird durch eine Tumorkachexie in erheblicher Weise beeinträchtigt.[14][37] Einige Begleiterscheinungen der Tumorkachexie führen zu einem weiteren Voranschreiten dieses Syndroms durch einen selbstverstärkenden Prozess. So ist der Abbau an Muskelproteinen mit einem erhöhten Energieverbrauch verbunden, was wiederum zu einer Progression der Erkrankung führt.[24] Appetitlosigkeit und Übelkeit führen zu einer verminderten Nahrungsaufnahme und verstärken ebenfalls den katabolischen Zustand.[25] Der Proteinabbau ist im Wesentlichen auf die Skelettmuskulatur beschränkt. Die inneren Organe sind dagegen vom Proteinabbau kaum betroffen. Auch hier unterscheidet sich das Bild der Tumorkachexie von dem einer Unterernährung, bei der – nach Aufbrauch der Fettreserven – sowohl skelettale als auch viszerale Proteine abgebaut werden. Die Masse der Leber kann bei kachektischen Patienten durch erhöhte Stoffwechselaktivitäten und die Produktion von Akute-Phase-Proteine sogar deutlich zunehmen.[2][25]
Diagnose
Eine sicher diagnostizierte Krebserkrankung ist die erste Voraussetzung für die Diagnose einer Tumorkachexie.[25] Die Diagnose der Tumorkachexie selbst ist in den meisten Fällen sehr schwierig. Ein Gewichtsverlust bei einem Krebspatienten muss nicht zwangsläufig eine Kachexie sein. Eine Reihe von psychologischen Faktoren spielen dabei ebenso eine Rolle wie beispielsweise Obstruktionen oder Stenosen im Magen-Darm-Trakt, die eine Folge des Tumorwachstums sein können. Entzündungen der Mundschleimhäute (Stomatitis), Mundtrockenheit oder Pilzinfektionen (Mykosen) des Mundraumes (Mundsoor) sind mögliche Begleiterscheinungen einer Krebserkrankung, die die Nahrungsaufnahme negativ beeinflussen. Auch diagnostische und vor allem therapeutische Maßnahmen, insbesondere Chemo- und Strahlentherapie, können durch Appetitabnahme zu Gewichtsverlusten führen. Selbst wenn diese Einflussgrößen ausgeschlossen werden können, ist eine eindeutige Diagnose oft schwierig.[25][34] Die zurzeit wichtigsten Kriterien für die Diagnosestellung sind die Vorgeschichte (Anamnese) und die körperliche Untersuchung des Patienten. Das Körpergewicht vor Beginn der Krebserkrankung dient dabei als Referenz.[23] Auch anthropometrische Untersuchungen können zur Diagnose der Tumorkachexie herangezogen werden. Dies sind – neben der bereits erwähnten elementaren Bestimmung des Körpergewichtes – beispielsweise die Messung des Umfangs am Oberarm oder die Dicke einer Hautfalte.[25] Mit der bioelektrischen Impedanzanalyse (BIA) kann die fettfreie Masse des Patienten bestimmt werden.[23] Diese Methode ist allerdings in vielen Kliniken nicht verfügbar und als diagnostischer Standard der Tumorkachexie noch nicht etabliert.[25]
Einige Laborparameter können unterstützend zur Diagnosestellung herangezogen werden. Die Aussagekraft ist jedoch durch physiologische Veränderungen – bedingt durch die maligne Grunderkrankung und etwaige therapeutische Maßnahmen – oft sehr eingeschränkt. Als die Diagnose stützender Laborparameter kann der Gehalt an Humanalbumin im Serum herangezogen werden, der im Fall einer Tumorkachexie meist erniedrigt ist, aber bei Leber- und Nierenfunktionsstörungen – beispielsweise durch die Krebserkrankung bedingt – verfälscht sein kann.[23] Die Konzentration an C-reaktivem Protein (CRP) im Serum kann als Folge einer bei der Tumorkachexie häufig zu beobachtenden Akute-Phase-Reaktion (APR) erhöht sein.[34] Typische Marker für eine Akute-Phase-Reaktion sind Transferrin, Transthyretin und Caeruloplasmin.[22] Andererseits kann eine Akute-Phase-Reaktion auch ohne Kachexie bei Krebserkrankungen auftreten, so dass diese Marker kein sicheres Maß für die Diagnosestellung „Kachexie“ darstellen.[22][25] Im Blut der Patienten sind häufig erhöhte Werte an Glycerin und Katecholaminen nachweisbar. Der erhöhte Glycerin-Gehalt ist auf den verstärkten Abbau von Körperfetten zurückzuführen.[2] Ein Begleitsymptom der Tumorkachexie ist häufig eine Anämie.[29]
Zum Zeitpunkt der Diagnose der Krebserkrankung ist bei etwa 80 Prozent der Patienten mit Tumoren des oberen Magen-Darm-Traktes und bei 60 Prozent der Patienten mit einem Bronchialkarzinom ein bedeutender Gewichtsverlust (über 10 Prozent in sechs Monaten) festzustellen.[15][19] In vielen Fällen ist der von den Patienten festgestellte Gewichtsverlust das erste Symptom der Krebserkrankung, die dann – im Rahmen der ärztlichen Untersuchung – als Ursache des Gewichtsverlustes diagnostiziert wird.[31][38][39]
Zum Zeitpunkt der Diagnose „Krebs“ beklagen bereits bis zu 50 Prozent der Krebspatienten eine Anorexie, in Form von Appetitverlust und vorzeitigem Sättigungsgefühl.[2][40]
Pathogenese (Entstehungsweise)
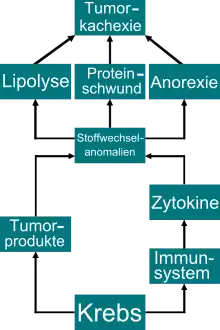
Eine Tumorkachexie entsteht durch ein komplexes, in den Details noch nicht vollständig aufgeklärtes, Wechselspiel von Stoffwechselprodukten des Tumors und Botenstoffen, die als Folge der Krebserkrankung im Körper des Betroffenen gebildet werden. Diese Verbindungen bewirken einen katabolischen Stoffwechsel, eine erhöhte Mobilisierung von Fetten aus dem Fettgewebe, einen verstärkten Abbau und einen reduzierten Aufbau von Proteinen in der Skelettmuskulatur sowie einen erhöhten Energieverbrauch der Körperzellen (Hypermetabolismus).
Bei einer Tumorkachexie liegt ein chronisch entzündlicher Zustand – ähnlich wie bei einer Infektion oder Entzündung oder Gewebeverletzung – vor. Dabei werden verschiedene pro-inflammatorische (entzündungsfördernde) Zytokine, Prostaglandine und vom Tumor selbst produzierte Faktoren überexprimiert. Diese Substanzen greifen unmittelbar in periphere und zentrale Regelkreise der Nahrungsaufnahme und des Stoffwechsels ein und sind darüber hinaus in der Lage, eine Muskelatrophie auszulösen.[41][42] Hinzu kommen weitere Faktoren, wie beispielsweise eine verminderte Nahrungsaufnahme, eine schlechte Verdauung (Maldigestion) beziehungsweise Absorption (Malabsorption), unter anderem als Folge von depressiven Stimmungen des Patienten. Auch Störungen bei der Geschmacksempfindung oder des Hungerzentrums können zur Tumorkachexie beitragen. Wiederkehrende Blutungen, beispielsweise bei ulzerierenden oder polypösen Magen-Darm-Karzinomen, können ebenfalls zu einem erhöhten Verlust an Eiweißen im Körper führen.[43]
Zytokine
Ab einer bestimmten kritischen Größe eines Tumors setzt die Tumornekrose ein. Das heißt, dass im Zentrum des Tumors – infolge einer Unterversorgung mit Blut – Tumorzellen absterben. Bei dem Zerfall dieser Tumorzellen wird unter anderem der Tumornekrosefaktor TNF-α (früher, mit Bezug auf die Kachexie, Kachektin genannt)[44][45] und eine Reihe weiterer Zytokine ausgeschüttet. Diese Substanzen bewirken vor allem in Hepatozyten (Leberzellen) Funktionsstörungen und führen zu einer negativen Stickstoffbilanz. Der Stoffwechsel wird auf Katabolismus umgestellt.[46] Die Zytokine TNF-α, Interleukin-1, Interleukin-6 und Interferon-γ wurden in verschiedenen Experimenten als Mediatoren für den Verlust an Muskelmasse bei einer Tumorkachexie identifiziert. Tatsächlich sind diese Verbindungen prinzipiell in der Lage, eine Kachexie zu bewirken. So lässt sich im Tiermodell experimentell der Zustand einer Kachexie durch die Injektion von TNF-α herstellen. Dabei bewirkt TNF-α sowohl einen Abbau des Körperfetts als auch der Skelettmuskulatur. TNF-α beeinflusst dabei unmittelbar das Ubiquitin-Proteasom-System, den wichtigsten intrazellulären Proteinabbaumechanismus.[47] Die Bildung von reaktiver Sauerstoffspezies (ROS) führt zu einer verstärkten Expression des Transkriptionsfaktors NF-κB. TNF-α senkt die Proteinsynthese durch eine verminderte Phosphorylierung des eukaryotischen Translations-Initiationsfaktors-4E eIF4E, der dadurch verstärkt an EIF4EBP1 (eukaryotischer Translation-Initiation-Faktor-4E-Bindungsprotein-1) binden kann und den aktiven eukaryotischen Initiationsfaktor 4F (eIF4F) reduziert.[48] Lange Zeit nahm man deshalb an, dass die genannten Zytokine – und allen voran TNF-α – die Hauptursache für die Ausbildung einer Tumorkachexie sind.[49][50]
Bei Untersuchungen an Patienten mit fortgeschrittenen Krebserkrankungen und Krebserkrankungen im Endstadium wurde allerdings festgestellt, dass bei den Betroffenen keinerlei Korrelation zwischen der Konzentration dieser Zytokine und dem Gewichtsverlust und einer Anorexie besteht.[51] Auch konnte bei Krebspatienten – im Vergleich zu Gesunden – keine höheren Serumkonzentrationen von TNF-α nachgewiesen werden.[52] Bei Patienten mit einer durch AIDS[53] oder einer durch Septikämie[54] hervorgerufenen Kachexie sind dagegen die Plasmaspiegel dieser Zytokine signifikant erhöht. Für Zytokine als ein Auslöser der Tumorkachexie spricht zwar auch die Tatsache, dass Zytokine das Enzym Lipoproteinlipase inhibieren können. Durch die Inhibierung können die Adipozyten aus den Lipoproteinen im Plasma keine Triglyceride (Fette) aufbauen und folglich nicht speichern. Interessanterweise ist aber die Gesamtaktivität der Lipoproteinlipase und auch die Konzentration der entsprechenden mRNA im adipösen Gewebe bei Krebspatienten im Vergleich zu Gesunden unverändert, während die der hormonsensitiven Lipase (HSL) etwa doppelt so hoch ist.[52] Auch führt die Inhibierung der TNF-α-Produktion – als möglicher Therapieansatz – zu keiner Verbesserung des Gesundheitszustandes.[48] Aufgrund dieser Daten geht man derzeit davon aus, dass die TNF-α, Interleukin-1, Interleukin-6 und Interferon-γ zwar prinzipiell in der Lage sind, eine Kachexie – wie beispielsweise bei AIDS oder einer Sepsis – zu bewirken, aber im Fall der Pathogenese einer Tumorkachexie offensichtlich nicht der Hauptfaktor sind.[55][56]
Stoffwechselprodukte des Tumors
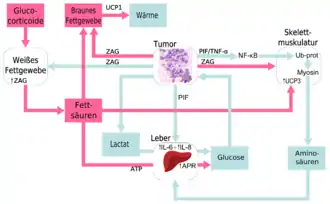
Tumoren produzieren katabolische Botenstoffe. Von den bisher identifizierten Botenstoffen sind der Proteolyse-induzierende Faktor (PIF) und der Lipid-mobilisierende Faktor (LMF) die wichtigsten Faktoren in der Pathogenese der Tumorkachexie.[41][58][59][60] Diese Faktoren bewirken komplexe, noch nicht vollständig aufgeklärte, neurohormonelle und metabolische Veränderungen, die zu einem katabolischen Stoffwechsel und Mangel an Nährstoffen führen können.[61]
Lipid-mobilisierender Faktor
Aus dem Urin von Patienten mit einer Tumorkachexie wurde Mitte der 1990er Jahre erstmals ein Peptid isoliert, das bei Krebspatienten ohne Gewichtsverlust nicht nachweisbar ist und im Tiermodell in der Lage ist, eine Lipolyse hervorzurufen.[59] Das lipid-mobilisierender Faktor genannte Peptid wirkt direkt auf die Adipozyten ein und stimuliert dort die Lipolyse über einen cAMP-abhängigen Prozess, der mechanistisch ähnlich wie bei lipolytischen Hormonen abläuft.[62] LMF ist ein 43 kDa schweres Homolog zum Zink-bindenden Plasmaprotein α-2-Glycoprotein (AZGP1, auch ZAG genannt).[58] Wird LMF Mäusen injiziert, verlieren die so behandelten Tiere Körperfett, ohne dass dadurch die Nahrungsaufnahme der Tiere verändert wird.[63] ZAG wird von den univakuolären Adipozyten des weißen Fettgewebes bei kachektischen Mäusen überexprimiert. Aufgrund der Datenlage geht man derzeit davon aus, dass LMF bei der Tumorkachexie beim Abbau von Körperfett einen wesentlichen Beitrag leistet.[64]
Proteolyse-induzierender Faktor
Mitte der 1990er Jahre wurde bei Mäusen mit einem MAC16-Adenokarzinom ein sulfatiertes Glykoprotein mit 24 kDa molarer Masse isoliert, das zu einer Tumorkachexie führt, indem es einen Katabolismus in der Skelettmuskulatur induziert. Dieses, später Proteolyse-induzierender Faktor (PIF) genannte, Peptid, wurde auch im Urin von Patienten mit einer Tumorkachexie gefunden. Dagegen konnte es nicht bei Krebspatienten ohne Gewichtsverlust oder Patienten mit einem nicht durch Krebs initiierten Gewichtsverlust nachgewiesen werden.[65][66][67] Diese Ergebnisse wurden in einer Reihe weiterer Versuche und Studien bestätigt.[68][69][70] Der Nachweis von PIF ist indikativ für einen Gewichtsverlust bei einer Tumorkachexie. NF-κB mediiert die durch PIF induzierte Proteinsynthese in der Skelettmuskulatur durch eine erhöhte Phosphorylierung von eIF2 an dessen α-Untereinheit.[71] Das Blockieren des PIF-Rezeptors oder der Signalkaskade in der Skelettmuskulatur wird als ein potenzieller Ansatzpunkt für künftige Arzneimittel zur Behandlung der Tumorkachexie gesehen.[48]
Im Tierversuch wurde neben dem Abbau der Skelettmuskulatur[72][73] eine verstärkte Produktion von Prostaglandin E2 nachgewiesen.[74] PIF bindet in vitro mit einer sehr hohen Affinität im nanomolaren Bereich an das Sarkolemm von Skelettmuskelzellen bei Maus, Schwein und Mensch und an murine Myoblasten.[75] PIF ist ein potenzieller Marker für die Diagnose einer Tumorkachexie.[76][77] Die Funktion von PIF bei der Tumorkachexie des Menschen wird nicht von allen Arbeitsgruppen gleich stark eingeschätzt und ist Gegenstand kontroverser Diskussionen. Bei einigen Studien wurden Ergebnisse erhalten, die im Widerspruch zu den bisherigen Daten stehen. Auch konnte keine Korrelation zwischen dem Vorhandensein/Nichtvorhandensein von PIF und der Prognose eines Patienten gefunden werden.[78]
Anorexie
- → siehe auch Hauptartikel Anorexie
Lange Zeit ging man davon aus, dass Unterernährung und Gewichtsverlust bei vielen Krebspatienten die alleinige Folge einer Appetitlosigkeit (Anorexie) sind.[79] Durch den Tumor verursachte Obstruktionen (Einengungen, Verschlüsse) im Magen-Darm-Trakt, Schmerzen, Nebenwirkungen der Krebstherapie, Übelkeit oder Veränderungen in der gustatorischen Wahrnehmung (Geschmackssinn), können die Appetitlosigkeit hervorrufen. Da die Anorexie auch bei Abwesenheit oder Behandlung dieser Symptome bei Krebspatienten auftreten kann, vermutet man, dass durch den Tumor hervorgerufene Veränderungen die Appetitlosigkeit bewirken.[80] Der Body-Mass-Index (BMI) von Krebspatienten korreliert ebenso wie bei gesunden Vergleichspersonen mit der Konzentration von Leptin. Das heißt, dass bei einem großen BMI-Wert im Serum hohe Leptinkonzentrationen gemessen werden. Leptin ist ein wichtiger, von Adipozyten produzierter, Botenstoff, der das Auftreten des Hungergefühls hemmt. Bestimmte Zytokine können die Produktion an Leptin in Adipozyten beeinflussen. Bei Krebspatienten im fortgeschrittenen Stadium ist die Serumkonzentration des Zytokins Interleukin-6 (IL-6) signifikant erhöht, was bei den Betroffenen zu einer Senkung des Leptinspiegels im Blut führt. Die Überlebensrate bei Patienten mit hohen IL-6 Konzentrationen, und daraus folgenden besonders niedrigen Leptin-Werten, ist signifikant verkürzt.[81][82] Neben der veränderten Leptin-Produktion spielt auch die Aktivität des Enzyms Fettsäure-Synthase (FAS)[83] und des Melanozyten-stimulierenden Hormons (MSH)[84] offensichtlich eine wichtige Rolle bei der Anorexie.[80]
Wird die Appetitlosigkeit bei einer Krebserkrankung medikamentös, beispielsweise durch Substanzen, die den Appetit anregen, oder durch künstliche Ernährung (enteral oder parenteral) behandelt, so wird keine Verbesserung des Stoffwechsels hin zum Anabolismus (Aufbau von Körpermasse) und weg vom Katabolismus (Abbau von Körpermasse) erreicht.[80][85][86][87] Messbare Gewichtszunahmen, die durch die Gabe von appetitstimulierenden Substanzen erreicht werden, beschränken sich auf die Zunahme an Fettgewebe und die Einlagerung von Wasser im Interstitium der behandelten kachektischen Patienten. Muskelmasse wird dabei kaum aufgebaut.[88][57]
Im Gegensatz zu einer Anorexie, bei der die fettfreie Körpermasse (Magermasse) weitgehend erhalten bleibt, wird bei der Tumorkachexie auch die Skelettmuskulatur abgebaut. Bis zu 80 Prozent des Fettgewebes und der Skelettmuskulatur können dabei verloren gehen. Beispielsweise resultiert bei Patienten mit Lungenkrebs, die 30 Prozent ihrer ursprünglichen Körpermasse durch die Erkrankung eingebüßt haben, der Gewichtsverlust aus einer Reduzierung des Fettgewebes um 85 und der des skelettalen Muskeleiweißes um 75 Prozent.[27]
Anorexie ist ein zusätzliches – die Tumorkachexie sehr häufig begleitendes – Symptom, das das Ergebnis eines gestörten Appetit-Signalweges ist und für den massiven Verlust an Muskeleiweiß bei einer Krebserkrankung nicht verantwortlich ist.[19][42] Im angelsächsischen Sprachraum hat sich der Begriff Cancer Anorexia-Cachexia Syndrome (CACS) an Stelle des Begriffes Cancer Cachexie etabliert.[89]
Direkte Einflüsse des Tumors
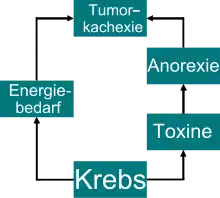
Nach dem veralteten Entstehungsmodell der Tumorkachexie ging man davon aus, dass der erhöhte Energiebedarf des Tumors im Wesentlichen für dieses Syndrom verantwortlich ist. Diese These war bis in die 1980er Jahre hinein allgemein anerkannt[90][91][92] und ist heute noch in der Bevölkerung weit verbreitet – aber in dieser Form nicht mehr haltbar. Größere Tumoren können einen erhöhten Nährstoffbedarf bei den betroffenen Patienten verursachen. Dieser erhöhte Nährstoffbedarf ist aber nicht die Ursache der Tumorkachexie.
Eine Tumorkachexie kann unabhängig von Größe und Ausdehnung des Tumors und unabhängig von einer Metastasierung auftreten.[12] Das Risiko der Ausbildung einer Tumorkachexie ist deutlich stärker von der Art der Krebserkrankung abhängig, als beispielsweise von der Tumorgröße, dem Tumorort und dem Metastasierungsgrad. Kachexie kann bei bestimmten Tumortypen schon bei 5 cm³ Tumorvolumen beobachtet werden, während bei anderen Karzinomen große Tumoren keine Kachexie auslösen. Dies ist ein Hinweis darauf, dass kachektische Tumoren eine veränderte Genexpression aufweisen, die es den Tumorzellen erlaubt, lipolytische (fettabbauende) und proteolytische (eiweißabbauende) Proteine zu produzieren, die die Kachexie ermöglichen.[57]
In einer Reihe von verschiedenen Studien wurde untersucht, ob der Ruheenergieverbrauch (resting energy expenditure, REE) von kachektischen Krebspatienten erhöht ist. Die Daten sind teilweise widersprüchlich beziehungsweise ohne signifikante Ursache-Wirkungs-Beziehung.[93] Teilweise zeigen die Studien einen erhöhten Energiebedarf,[94][95] teilweise das genaue Gegenteil[90] oder einen unveränderten Energiebedarf,[96] so dass derzeit keine gesicherten Erkenntnisse dazu vorhanden sind.[15]
Bei größeren Tumoren kann ein zusätzlicher Energiebedarf von bis zu 300 kcal pro Tag auftreten. Tumoren verbrauchen große Mengen an Glucose, die, bedingt durch die anaeroben Bedingungen im Tumor, zu Lactat abgebaut wird. Das Lactat wird in der Leber im sogenannten Cori-Zyklus wieder in Glucose umgewandelt. Dieser Vorgang ist sehr energieintensiv. Bei Gesunden liegt der Anteil der über den Cori-Zyklus umgesetzten Glucose bei etwa 20 Prozent, bei kachektischen Patienten bei etwa 50 Prozent. Dies entspricht dann einem Anteil von 60 Prozent an der gesamten Lactat-Produktion.[97] Dieser zusätzliche Energiebedarf ist zwar nicht die Ursache der Tumorkachexie, aber ein für die Ernährung des Patienten wichtiger Aspekt.[57]
Therapie und zukünftige Therapieansätze
Derzeit gibt es keinen von der FDA oder der Europäischen Kommission zugelassenen Arzneistoff für die Therapie der Tumorkachexie.[98] Einige Nahrungsergänzungsmittel, sowie Fertigarzneimittel, die für andere Indikationen zugelassen sind (Off-label use), werden teilweise zur Behandlung eingesetzt. Ihr Einsatz ist rein palliativ. Eine unmittelbare kurative Behandlung der Tumorkachexie ist derzeit nicht bekannt. Eine Heilung ist nur möglich, wenn die der Tumorkachexie zugrunde liegende Krebserkrankung beseitigt wird (mittelbare Behandlung). Dies wäre die wirksamste Therapie der Tumorkachexie.[99] Da die Tumorkachexie häufig erst in einem späten Stadium einer Krebserkrankung auftritt, sind die Chancen auf eine Heilung der Krebserkrankung und damit der Tumorkachexie in der Regel sehr gering. In vielen Fällen ist eine Heilung der Grunderkrankung „Krebs“ durch therapeutische Maßnahmen nicht mehr möglich. Die betroffenen Patienten sind therapieresistent – „austherapiert“. Das wesentliche Therapieziel bei der Tumorkachexie ist es, die Lebensqualität der betroffenen Patienten signifikant zu verbessern. Daneben soll die Gesamtüberlebenszeit erhöht und der Körper für tumortherapeutische Maßnahmen (Operation, Chemotherapie, Strahlentherapie) gestärkt werden.
Die derzeit etablierten Maßnahmen zur Behandlung der Tumorkachexie sind in ihrer Wirksamkeit unzureichend, so dass die Behandlungserfolge sehr bescheiden sind. Die Ursachen hierfür liegen zum einen in dem lückenhaften Wissen über die Pathogenese der Tumorkachexie[100] und zum anderen an der Vielzahl von Einflussfaktoren auf die Pathogenese selbst. Bedingt durch den letztgenannten Aspekt wird derzeit davon ausgegangen, dass eine einzelne Therapie alleine – auch zukünftig – nicht der universelle Lösungsansatz sein wird. Vielmehr ergibt sich die Notwendigkeit, mehrere Behandlungsarten miteinander zu kombinieren.[101][102] Einige Onkologen sehen zukünftige Krebstherapien kombiniert mit einer Therapie gegen Anorexie und Tumorkachexie, gleich zu Beginn der Diagnosestellung „Krebs“. Man verspricht sich dadurch synergistische Effekte, die sich zum einen in einer besseren Ansprechrate bei der Tumortherapie und zum anderen in einer deutlich verbesserten Lebensqualität niederschlagen.[2]
Erhöhung der Nahrungsaufnahme und Appetitanreger
Die naheliegendste therapeutische Maßnahme ist die Erhöhung der Nahrungsaufnahme beim Patienten. Auch wenn die Appetitlosigkeit des Patienten überwunden werden kann und der Nährstoffbedarf mehr als nur gedeckt wird – gegebenenfalls durch künstliche Ernährung mit hohem physiologischem Brennwert – so führen diese Maßnahmen alleine nicht zu einer Zunahme der fett- und wasserfreien Körpermasse. Der katabolische Proteinabbau in der Skelettmuskulatur lässt sich dadurch nicht aufhalten oder gar rückgängig machen.[24][25][103][104] Auch die Gabe von lediglich den Appetit anregenden Substanzen kann daher den katabolischen Abbau nicht verhindern.
Ghrelin
- → siehe Hauptartikel Ghrelin
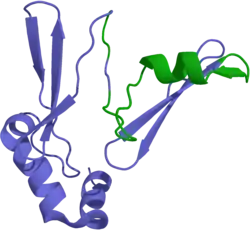
Ghrelin (engl. Growth Hormone Release Inducing) ist ein aus 28 Aminosäuren bestehendes appetitanregendes Peptidhormon. Es wird aus dem Präkursor-Protein Preproghrelin – das aus 117 Aminosäuren besteht – durch posttranslationale Modifikation in der Magenschleimhaut gebildet. Es ist das derzeit einzige identifizierte Hormon, das im menschlichen Körper zirkuliert und den Appetit anregt.[103] Ghrelin stimuliert die Ausschüttung von Neuropeptid Y (NPY), das unter anderem den Hunger und die Motilität des Magen-Darm-Traktes beeinflusst.
In präklinischen Versuchen mit Modellorganismen wurden vielversprechende Ergebnisse bei der Behandlung kachektischer Mäuse mit Ghrelin erhalten. Die Anregung des Appetits und eine erhöhte Nahrungsaufnahme konnten nachgewiesen werden;[105][106] ebenso der Aufbau von Muskelmasse.[107][108] Überraschend waren zudem die positiven Auswirkungen gegen Verdauungsstörungen[109] und Erbrechen[110] bei gleichzeitig durchgeführter Chemotherapie.[111]
Ghrelin kann subkutan oder intravenös verabreicht werden. Es ist im Allgemeinen gut verträglich. Unerwünschte Nebenwirkungen sind weitgehend unbekannt. Das Tumorwachstum wird durch die Einnahme von Ghrelin nicht stimuliert.[111] Im Tiermodell sowie bei ersten Tests am Menschen wurden jedoch nach wiederholter Gabe Ghrelin-Resistenzen festgestellt,[106] die durch höhere Dosen kompensiert werden konnten. Der Mechanismus der Resistenzbildung ist ähnlich dem einer Insulinresistenz.[112] Die Gefahren eines Diabetes mellitus bei der Einnahme von Ghrelin über längere Zeiträume werden ebenfalls diskutiert.[113]
Ghrelin befindet sich noch in der klinischen Erprobung. Der Nachweis der Wirksamkeit beim Menschen mit der Indikation Tumorkachexie (erfolgreiche Phase III) steht noch aus. Erst danach können Arzneimittelzulassung und Markteinführung erfolgen.
Megestrol
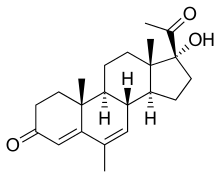
Megestrol ist ein Sexualhormon aus der Gruppe der Progesterone. Die Substanz hat nachweislich eine orexigene (appetitanregende) Wirkung. 1993 wurde Megestrol von der FDA für die Behandlung von Anorexie, Kachexie oder nicht erklärbarem Gewichtsverlust bei AIDS-Patienten zugelassen. Für Krebspatienten mit einer Tumorkachexie liegt keine Zulassung vor. Dieses Arzneimittel ist gut verträglich und weist nur geringe Nebenwirkungen auf. Der Wirkungsmechanismus zur Appetitanregung ist noch unklar. Megestrol erhöht bei Patienten mit Tumorkachexie nachweislich den Appetit. Auch lässt sich eine Gewichtszunahme nachweisen.[114][115] Eine signifikante Steigerung der Lebensqualität konnte bei den bisher durchgeführten Studien allerdings nicht nachgewiesen werden.[36][103] Auch die Überlebenszeit konnte im Vergleich zu Patienten, die ein Placebo erhielten, nicht erhöht werden.[116]
Beim Vorliegen einer Anorexie ohne Kachexie ist Megestrol wirksam. Dagegen ist die Gewichtszunahme bei kachektischen Patienten im Wesentlichen auf die Zunahme von Fettgewebe und die Einlagerung von Wasser im Interstitium zurückzuführen. Der gewünschte Effekt der Zunahme an Skelettmuskelmasse bleibt jedoch aus.[88][103][117]
Cannabinoide
Endocannabinoide haben beim Menschen eine appetitanregende Wirkung. Die gleiche Wirkung ist von pflanzlichen Cannabinoiden, beispielsweise aus Hanf (Cannabis sativa), seit dem Altertum bekannt.[118] Für Δ9-Tetrahydrocannabinol (THC), dem Hauptwirkstoff von Cannabis sativa, und dem teil-synthetisch hergestellten THC Dronabinol ist die appetitanregende Wirkung nachgewiesen.[119][120] Die Substanz ist als Arzneimittel zur Therapie der Anorexie und Kachexie bei AIDS und als Antiemetikum bei Krebserkrankungen in den USA zugelassen.[121]
In einer groß angelegten, multizentrischen randomisierten placebokontrollierten Doppelblind-Phase-III-Studie mit 289 Patienten konnte über einen Zeitraum von sechs Wochen allerdings kein Unterschied zwischen dem THC-Arm und dem Placebo-Arm bezüglich Appetit, Übelkeit, Stimmungslage und Lebensqualität festgestellt werden.[122] Andere vergleichende Studien kommen zu ähnlichen Ergebnissen.[103][123]
Auch andere Appetitanreger oder Serotonin-Antagonisten zeigten in klinischen Studien, dass sie den progressiven Gewichtsverlust bei einer Tumorkachexie nicht aufhalten können.[124]
Inhibierung von Akute-Phase-Proteinen bzw. deren Botenstoffe
Akute-Phase-Proteine (APP) werden bei akuten oder chronischen Entzündungsreaktionen vor allem in der Leber produziert und in die Blutbahn abgegeben. Die Produktion der Akute-Phase-Proteine wird dabei im Wesentlichen durch die Botenstoffe Tumornekrosefaktor-α (TNF-α) und Interleukin-6 (IL-6) angeregt. Als Akute-Phase-Proteine werden unter anderem C-reaktives Protein sowie verschiedene Transport- und Komplementproteine produziert. Die APPs wirken unter anderem auf das Zentralnervensystem und beeinflussen dort den Appetit, die Essgewohnheiten und den Metabolismus. Welches APP wie und wo genau wirkt ist noch nicht vollständig bekannt und Gegenstand aktueller Forschungsarbeiten.[125] Speziell bei Tumoren in den Organen Bauchspeicheldrüse, Lunge, Speiseröhre, Nieren ist die Produktion von APPs signifikant erhöht.[24] Ein therapeutischer Ansatz zur Behandlung der Tumorkachexie besteht in der Inhibierung der Akute-Phase-Proteine beziehungsweise der Botenstoffe, die in der Leber die Produktion der APPs anregen.
Nichtsteroidale Antirheumatika
Verbindungen mit entzündungshemmender Wirkung, wie die nichtsteroidalen Antirheumatika (NSAR) Ibuprofen oder Indometacin, hemmen die Akute-Phase-Proteine unspezifisch. Sowohl im Tiermodell[126] als auch bei Patienten mit einem Pankreastumor oder kolorektalem Karzinom konnte der Proteinmetabolismus positiv beeinflusst werden. Mit Indometacin wurde die Überlebenszeit signifikant erhöht.[24][25] Außer diesen unspezifischen Ansätzen zur Inhibierung von Akute-Phase-Proteinen wird auch an der spezifischen Hemmung einzelner APPs – beziehungsweise von Botenstoffen, die die Produktion der APPs anregen – geforscht. Ein Beispiel hierfür ist die Inhibierung von Interleukin-6.[127] Die bisherigen Versuche waren jedoch erfolglos.[25]
Steroidale Entzündungshemmer
Auch steroidale Entzündungshemmer wie das Glucocorticoid Prednisolon zeigen in klinischen Studien positive Resultate.[128] Glucocorticoide werden oft zur Behandlung einer Tumorkachexie verabreicht. Die sonst meist unerwünschte Nebenwirkung Gewichtszunahme bei Glucocorticoiden ist in diesem Anwendungsfall erwünscht. Prednisolon und Dexamethason erhöhen signifikant den Appetit der Patienten und verbessern so deren Lebensqualität. Außerdem werden über die entzündungshemmende Wirkung Zytokine inhibiert.[129] Die Wirkung der Glucocorticoide ist aber nur von kurzer Dauer und der Zustand der Skelettmuskulatur wird durch die Glucocorticoid-Gabe nicht verbessert. Die Gesamtüberlebenszeit wird in einigen Studien gegenüber der Placebo-Gabe signifikant erhöht.[128] Die unerwünschten Nebenwirkungen der Glucocorticoide, wie beispielsweise Übelkeit, Schmerzen, Wasserretention, Schwäche und Insulinresistenz oder gar Osteoporose und Immunsuppression sind allerdings so erheblich, dass der therapeutische Nutzen sehr fragwürdig ist[24] und kontrovers diskutiert wird. In der Behandlung der Tumorkachexie sind die Glucocorticoide nicht etabliert.[25][129]
TNF-α-Inhibitoren (Thalidomid)
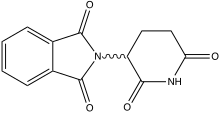
Erfolgversprechender sind die Ansätze zur Inhibierung von TNF-α.[130][131] Thalidomid – wesentlich bekannter unter dem Markennamen Contergan – ist ein selektiver Antagonist von TNF-α[132] und TGF-β.[133] Im Tiermodell[133] als auch bei ersten klinischen Studien wurden positive Ergebnisse erhalten.[134] Beispielsweise führte die Gabe von Thalidomid bei acht von zehn Patienten mit inoperablem Speiseröhrenkrebs zu einer Zunahme der fett- und wasserfreien Körpermasse.[25][104] Auch bei Patienten mit Bauchspeicheldrüsenkrebs konnte der Abbau der Skelettmuskulatur signifikant verzögert werden.[135] Allerdings konnte die Überlebenszeit der mit Thalidomid behandelten Patienten – im Vergleich zur Placebo-Gruppe – nicht erhöht werden, obwohl bei sehr vielen Patienten mit Bauchspeicheldrüsenkrebs die Tumorkachexie die unmittelbare Todesursache ist.[49] Thalidomid und weitere Inhibitoren werden in einer Reihe von kontrollierten klinischen Studien zur Therapie der Tumorkachexie getestet und müssen ihre therapeutische Wirksamkeit noch beweisen.
Inhibierung der Proteasom-Aktivität
Der Abbau der Proteine der Skelettmuskulatur erfolgt – unabhängig vom auslösenden Botenstoff – über das Ubiquitin-Proteasom-System. Ein therapeutischer Ansatzpunkt ist es daher, die Aktivität des Proteasoms zu reduzieren.[136] Mehrere Proteasominhibitoren befinden sich in der klinischen Erprobung. Der erste in den USA und der EU zugelassene Proteasominhibitor, Bortezomib, ist wirksam gegen das Multiple Myelom.
3-Hydroxy-3-methylbuttersäure
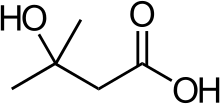
3-Hydroxy-3-methylbuttersäure (HMB), meist als β-Hydroxy-β-methylbuttersäure oder β-Hydroxy-β-methylbutyrat bezeichnet, ist ein Stoffwechselprodukt der essentiellen Aminosäure Leucin. Etwa 5 Prozent des aufgenommenen Leucins wird zu HMB metabolisiert.[137] HMB wird als Nahrungsergänzungsmittel angeboten und zeigt im menschlichen Körper unter anderem anabole,[138] anti-katabole,[139] und lipolytische[140] Effekte. HMB wird daher von vielen Bodybuildern und Kraft- oder Ausdauerathleten eingenommen, um die Muskelmasse beziehungsweise Leistungsfähigkeit legal zu steigern.[137] Bei austrainierten Athleten ist allerdings weder bei der aeroben, als auch bei der anaeroben Leistung, eine Leistungssteigerung durch die Einnahme von HMB messbar.[141][142]
Im Tiermodell kachektischer Mäuse konnte gezeigt werden, dass sowohl der Abbau von Protein reduziert, als auch der Aufbau von Muskelmasse stimuliert wird.[143][144] Wird HMB zusammen mit PIF, das das Ubiquitin-Proteasom-System hochreguliert, den Versuchstieren verabreicht, so kann die Wirkung von PIF durch HMB vollständig kompensiert werden.[145][146] HMB wirkt dabei offenbar regulierend auf die Expression von NF-κB ein, das weniger stark von den Zellen produziert wird.[147] Der Mechanismus zum Aufbau von Proteinmasse erfolgt über den mTOR-Rezeptor, dessen Phosphorylierung offensichtlich durch HMB stimuliert wird.[148]
Eine Reihe von klinischen Studien mit gesunden Probanden, trainiert und untrainiert, wurden mit HMB durchgeführt. Die Ergebnisse sind teilweise widersprüchlich.[149][150] Es gibt aber schlüssige Anhaltspunkte dafür, dass die Gabe von HMB für die Tumorkachexie eine wirksame zukünftige Therapieform sein könnte.[137] In einer Studie mit kachektischen Patienten wurde eine Zunahme der fettfreien Körpermasse durch die Gabe von HMB in Kombination mit den Aminosäuren Arginin und Glutamin nachgewiesen.[151] In einer randomisierten placebokontrollierten Phase-III-Doppelblindstudie mit 472 Patienten nahm die fettfreie Körpermasse der Patienten, die HMB zusammen mit Arginin und Glutamin erhielten, zu. Allerdings beendeten nur 37 Prozent aller Patienten die Studie, wodurch der primäre und sekundäre Endpunkt nicht erreicht werden konnten und auch deshalb kein Nachweis für die Wirksamkeit von HMB zur Behandlung der Tumorkachexie erbracht werden.[152] Weitere, breit angelegte Studien sind notwendig, um den Nachweis der Wirksamkeit zu erbringen.[137]
Bortezomib
- → siehe Hauptartikel Bortezomib
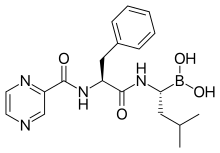
Bortezomib ist ein zur Therapie des Multiplen Myeloms zugelassener Proteasom-Inhibitor. Die Verbindung zeigte in klinischen Studien, die das Ziel hatten den bei der Tumorkachexie stattfindenden proteolytischen Muskelabbau zu verzögern beziehungsweise zu verhindern, keine ausreichende Wirkung.[101][153]
Eicosapentaensäure
- → siehe Hauptartikel Eicosapentaensäure
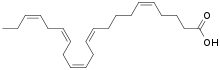
Eicosapentaensäure, meist als EPA (engl. Eicosapentaenoic acid) abgekürzt, ist eine mehrfach ungesättigte Fettsäure aus der Klasse der Omega-3-Fettsäuren. Es ist eines der Hauptbestandteile bestimmter Fischöle, speziell von Fettfischen. EPA hat entzündungshemmende Eigenschaften und ist das einzige Nahrungsergänzungsmittel, das über verschiedene Mechanismen in der Lage ist, Einfluss auf das Proteasom zu nehmen. Die Aktivität des Proteasoms, das im Inneren der Körperzellen Proteine in Fragmente zerlegt, wird durch EPA vermindert. Der Abbau von Muskelproteinen sollte – so das Wirkungsmodell – reduziert werden können.[154] In ersten Studien an Patienten mit Bauchspeicheldrüsenkarzinomen konnte der kachektische Gewichtsverlust reduziert werden.[155] Das EPA wurde dabei von den Patienten ohne signifikante Nebenwirkungen gut toleriert.[156] Dieser Erfolg konnte in drei nachfolgenden, groß angelegten und placebokontrollierten randomisierten Doppelblindstudien nicht wiederholt werden.[103][157][158][159][160] Im Tiermodell „Maus“ konnte kein Einfluss von EPA auf die Proteinsynthese festgestellt werden.[161]
Insulin
- → siehe Hauptartikel Insulin
Das Hormon Insulin ist ein potenter Regulator des Proteinumsatzes im Körper.[162] Durch die Gabe von Insulin lässt sich die Aufnahme von Kohlenhydraten bei kachektischen Patienten stimulieren. In einer klinischen Studie nahmen die Patienten mit unterschiedlichen Tumorerkrankungen an Körpergewicht zu, allerdings im Wesentlichen durch einen erhöhten Anteil an Körperfett. Die fettfreie Körpermasse blieb unverändert. Durch die Insulingabe wurde das Tumorwachstum nicht beeinflusst und die Überlebenszeit im Vergleich zur Kontrollgruppe leicht erhöht.[163]
Hydraziniumsulfat
Hydraziniumsulfat war einer der ersten Wirkstoffe, der gezielt gegen die Tumorkachexie eingesetzt wurde.[164] Die Verbindung ist ein Inhibitor der Gluconeogenese,[165] das heißt der Bildung von Glucose im Körper aus Nicht-Kohlenhydraten. Hydraziniumsulfat deaktiviert dabei das Enzym Phosphoenolpyruvat-Carboxykinase. In ersten klinischen Studien konnte bei der Behandlung von Krebspatienten in einem späten Krankheitsstadium eine verbesserte Glucosetoleranz, ein verminderter Glucoseumsatz, eine erhöhte Aufnahme an Nährstoffen und eine Stabilisierung oder gar Zunahme des Körpergewichtes festgestellt werden. Die unerwünschten Nebenwirkungen waren dabei gering.[166][167] Die damalige Intention der Gabe von Hydraziniumsulfat war, dass man von der Hypothese ausging, dass eine unkontrollierte Glucogenese in engem Zusammenhang zur Tumorkachexie steht.[168]
In späteren Studien wurde festgestellt, dass die Verabreichung von Hydraziniumsulfat zur Therapie der Tumorkachexie wirkungslos ist,[101] wodurch dieser Therapieansatz mittlerweile obsolet ist.
Gentherapie
Follistatin und Myostatin sind zwei körpereigene Proteine, die das Muskelwachstum kontrollieren. Während Follistatin das Muskelwachstum anregt, bewirkt Myostatin das genaue Gegenteil. Beide Verbindungen bilden einen Regelkreis, der das Muskelwachstum bei Säugetieren kontrolliert. Die Gabe oder zelluläre Überexprimierung von Follistatin, beziehungsweise die Inhibierung von Myostatin oder das Abschalten des für Myostatin codierenden Gens, sind potenzielle Therapieansätze der Tumorkachexie. Mit diesen Ansätzen ist es gegebenenfalls möglich, dem Abbau an Muskelmasse durch die Tumorkachexie entgegenzuwirken.[169] Im Tiermodell konnten damit erste Erfolge erzielt werden. Dieser Therapieansatz befindet sich noch in der präklinischen Phase und ist – selbst bei einem Nachweis der Wirksamkeit – noch viele Jahre von einer Zulassung als Arzneimittel entfernt.
Prognose
Der Schweregrad einer Tumorkachexie korreliert umgekehrt proportional mit der mittleren Überlebenszeit eines Krebspatienten. Das heißt, je ausgeprägter die Tumorkachexie ist, umso kürzer ist die Überlebenszeit des Betroffenen. Grundsätzlich ist eine Tumorkachexie mit einer schlechten Prognose für den Patienten verbunden.[170] Ein Gewichtsverlust bei einer Krebserkrankung ist ein eigenständiger Prognosefaktor.[85] Eine Tumorkachexie erhöht die Wahrscheinlichkeit für postoperative Komplikationen[171] und hat auch einen negativen Einfluss auf den Erfolg einer Chemotherapie. Patientinnen mit Brustkrebs ohne Tumorkachexie sprechen durchschnittlich 2,5-mal besser auf die Chemotherapie an als Patientinnen mit Tumorkachexie.[31] Selbst ein relativ geringer Verlust an Körpermasse von beispielsweise unter fünf Prozent kann die Prognose erheblich verschlechtern.[2]
Die Chance auf eine Heilung besteht nur dann, wenn die der Tumorkachexie zugrundeliegende Krebserkrankung geheilt wird.[172]
Literatur
Fachbücher
- Angela P. Löser u. a.: Ambulante Pflege bei Tumorpatienten. Schlütersche Verlag, Hannover 2000, ISBN 3-87706-479-5, S. 195 ff.
- David S. Ettinger (Editor): Supportive Care in Cancer Therapy. Verlag Springer, Luxemburg 2008, ISBN 1-58829-941-4.
- Jeffrey A. Norton u. a.: Surgery: basic science and clinical evidence. Verlag Springer, Luxemburg 2008, ISBN 0-387-30800-8, S. 2123 ff.
- Giovanni Mantovani: Cachexia and wasting: a modern approach. Verlag Springer, Luxemburg 2006, ISBN 88-470-0471-3.
- Karl G. Hofbauer u. a.: Pharmacotherapy of cachexia. Verlag Auerbach, Leipzig 2006, ISBN 0-8493-3379-2.
Review-Artikel
- M. Bossola u. a.: Skeletal muscle in cancer cachexia: the ideal target of drug therapy. In: Curr Cancer Drug Targets, 8, 2008, S. 285–298, PMID 18537552
- A. Jatoi: Weight loss in patients with advanced cancer: effects, causes, and potential management. In: Curr Opin Support Palliat Care, 2, 2008, S. 45–48, PMID 18685394
- S. Al-Majid, H. Waters: The biological mechanisms of cancer-related skeletal muscle wasting: the role of progressive resistance exercise. In: Biol Res Nurs, 10, 2008, S. 7–20, PMID 18705151
- M. L. Hardy: Dietary supplement use in cancer care: help or harm. In: Hematol Oncol Clin North Am, 22, 2008, S. 581–617, PMID 18638690
- B. Seruga u. a.: Cytokines and their relationship to the symptoms and outcome of cancer. In: Nat Rev Cancer, 8, 2008, S. 887–899, PMID 18846100
- N. Bennani-Baiti, M. P. Davis: Cytokines and cancer anorexia cachexia syndrome. In: Am J Hosp Palliat Care, 25, 2008, S. 407–411, PMID 18403577
- K. D. Hall, V. E. Baracos: Computational modeling of cancer cachexia. In: Curr Opin Clin Nutr Metab Care, 11, 2008, S. 214–221, PMID 18403915
- M. Bossola u. a.: Novel treatments for cancer cachexia. In: Expert Opin Investig Drugs, 16, 2007, S. 1241–1253, PMID 17685872
- A. Lelbach u. a.: Current perspectives of catabolic mediators of cancer cachexia. In: Med Sci Monit, 13, 2007, RA168–173, PMID 17767131
- J. L. Ryan u. a.: Mechanisms of cancer-related fatigue. In: Oncologist, 12, 2007, S. 22–34, PMID 17573453
- J. M. Argilés u. a.: Mechanisms to explain wasting of muscle and fat in cancer cachexia. In: Curr Opin Support Palliat Care, 1, 2007, S. 293–298, PMID 18685378
- M. S. Boddaert u. a.: On our way to targeted therapy for cachexia in cancer? In: Curr Opin Oncol, 18, 2006, S. 335–340, PMID 16721127
- J. M. Argilés u. a.: Cytokines as mediators and targets for cancer cachexia. In: Cancer Treat Res, 130, 2006, S. 199–217, PMID 16610709
- J. M. Argilés u. a.: Mediators involved in the cancer anorexia-cachexia syndrome: past, present, and future. In: Nutrition, 21, 2005, S. 977–985, PMID 16043325
- J. M. Argilés u. a.: Cytokines in the pathogenesis of cancer cachexia. In: Curr Opin Clin Nutr Metab Care, 6, 2003, S. 401–406, PMID 12806213
- M. E. Martignoni u. a.: Cancer cachexia. In: Mol Cancer, 2, 2003, S. 26, PMID 14613583
- H. Rubin: Cancer cachexia: its correlations and causes. In: PNAS, 100, 2003, S. 5384–5389, PMID 12702753
- B. Gagnon, E. Bruera: A review of the drug treatment of cachexia associated with cancer. In: Drugs, 55, 1998, S. 675–688, PMID 9585863
Weblinks
- Complications of Cancer and its Treatment: 144. Cancer Anorexia and Cachexia. (englisch)
- Ernährung für Krebspatienten: Was tun bei Gewichtsverlust oder Mangelernährung?, Krebsinformationsdienst des Deutschen Krebsforschungszentrums (DKFZ), Heidelberg. 20. Dezember 2006; abgerufen am 4. September 2014.
- med. Eva M. Kalbheim: Krebs: Starker Gewichtsverlust verhindert Heilung. Deutsche Krebshilfe e. V., Pressemitteilung vom 6. August 2009 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 15. September 2015.
- tumorkachexie.com
- Abbildung eines Kachexie-Patienten
Einzelnachweise
- Die Klassifizierung in C80 ist gültig nach ICD-10 (WHO-Version) von 2006. Davon abweichend wird in der ICD-10-GM-Version von 2009 die Tumorkachexie in R64 (Kachexie) klassifiziert. Gleiches gilt für die Deutschen Kodierrichtlinien von 2005.
- M. J. Tisdale: Cachexia in cancer patients. In: Nat Rev Cancer, 2, 2002, S. 862–871, PMID 12415256.
- J. Inagaki u. a.: Causes of death in cancer patients. In: Cancer, 33, 1974, S. 568–573, PMID 4591273.
- R. D. Lohberg u. a.: The lethal phenotype of cancer: the molecular basis of death due to malignancy. (Memento vom 8. April 2010 im Internet Archive) In: CA Cancer J Clin, 57, 2007, S. 225–241, PMID 17626119 (Review).
- A. M. Lindsey: Cancer cachexia: effects of the disease and its treatment. In: Semin Oncol Nurs, 2, 1986, S. 19–29, PMID 3513270.
- R. Wahrig-Burfeind: WAHRIG Fremdwörterlexikon. Bertelsmann Lexikon Verlag, 2007, ISBN 3-577-09030-8.
- T. Ohnuma: Complications of Cancer and its Treatment. (Memento des Originals vom 31. August 2004 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 486 kB) In: Holland-Frei Cancer Medicine, 6. Edition, D. W. Kufe u. a. (Editoren), Verlag B. C. Decker Inc, Hamilton, Ontario, 2003, ISBN 1-55009-213-8, Sektion 38: Complication of Cancer and its Treatment, Kapitel 144: Cancer Anorexia and Cachexia. S. 2425–2441. (Gesamtwerk).
- K. C. Fearon: Cancer cachexia: developing multimodal therapy for a multidimensional problem. In: Eur J Cancer, 44, 2008, S. 1124–1132, PMID 18375115 (Review).
- J. Springer u. a.: The need for a standardized definition for cachexia in chronic illness. In: Nat Clin Pract Endocrinol Metab, 2, 2006, S. 416–417, PMID 16932326.
- K. C. Fearon u. a.: Definition of cancer cachexia: effect of weight loss, reduced food intake, and systemic inflammation on functional status and prognosis. In: American Journal of Clinical Nutrition, 83, 2006, S. 1345–1350, PMID 16762946 (Review).
- M. Lainscak u. a.: How does cachexia influence survival in cancer, heart failure and other chronic diseases? In: Curr Opin Support Palliat Care, 1, 2007, S. 299–305, PMID 18685379 (Review).
- K. M. Fox u. a.: Estimation of Cachexia among Cancer Patients Based on Four Definitions. In: J Oncol, 2009:693458, PMID 19587829.
- W. J. Evans u. a.: Cachexia: a new definition. In: Clinical Nutrition, 27, 2008, S. 793–799, PMID 18718696.
- A. Laviano u. a.: Therapy Insight: cancer anorexiacachexia syndrome when all you can eat is yourself. In: Nature Clinical Practice Oncology, 2, 2005, S. 158–165, PMID 16264909 (Review).
- D. E. Rivadeneira: Nutritional support of the cancer patient. (Memento vom 7. September 2008 im Internet Archive) In: CA Cancer J Clin, 48, 1998, S. 69–80, PMID 9522822 (Review).
- J. A. Palesty, S. J. Dudrick: What we have learned about cachexia in gastrointestinal cancer. In: Dig Dis, 21, 2003, S. 198–213, PMID 14571093 (Review).
- G. Ollenschläger: Ernährungsprobleme in der Palliativmedizin. In: Lehrbuch der Palliativmedizin E. Aulbert und D. Zech (Hrsg.), Verlag Schattauer, 1997, ISBN 3-7945-2361-X, S. 556–565.
- L. Stepp, T. S. Pakiz: Anorexia and cachexia in advanced cancer. In: Nurs Clin North Am, 36, 2001, S. 735–744, PMID 11726350 (Review).
- E. Bruera: ABC of palliative care: anorexia, cachexia, and nutrition. In: BMJ, 315, 1997, S. 1219–1222, PMID 9393230 (Review).
- S. Warren: The immediate causes of death in cancer. In: American Journal of Medical Science, 184, 1932, S. 610–616.
- N. J. Espat u. a.: Cytokine-mediated alterations in host metabolism prevent nutritional repletion in cachectic cancer patients. In: J Surg Oncol, 58, 1995, S. 77–82, PMID 7844987 (Review).
- C. Deans, S. J. Wigmore: Systemic inflammation, cachexia and prognosis in patients with cancer. In: Curr Opin Clin Nutr Metab Care, 8, 2005, S. 265–269, PMID 15809528.
- A. Inui: Cancer anorexia-cachexia syndrome: current issues in research and management. (Memento vom 1. Juli 2010 im Internet Archive) In: CA Cancer J Clin, 52, 2002, S. 72–91, PMID 11929007 (Review).
- K. C. H. Fearon, A. G. W. Moses: Cancer cachexia. In: Int J of Cardiology, 85, 2002, S. 73–81, PMID 12163211.
- S. Zimmer: Phänotypische Charakterisierung von Gewichtsabnahme und Appetitveränderungen bei Tumorpatienten. (PDF; 466 kB) Dissertation, Philipps-Universität Marburg, 2007.
- S. Blanke: Einfluss einer nutritiven oralen Supportivtherapie auf den Ernährungszustand von Tumorpatienten einer strahlentherapeutischen Abteilung. Dissertation, Medizinische Fakultät der Charité, 2007.
- K. C. H. Fearon: The mechanisms and treatment of weight loss in cancer. In: Proc Nutr Soc, 51, 1992, S. 251–265, PMID 1438334 (Review).
- K. F. Giordano and A. Jatoi: The cancer anorexia/weight loss syndrome: therapeutic challenges. In: Current Oncology Reports, 7, 2005, S. 271–276, PMID 15946586 (Review).
- J. M. Argiles u. a.: Muscle wasting in cancer and ageing: cachexia versus sarcopenia. In: Advances in Gerontology, 18, 2006, S. 39–54, PMID 16676797 (Review).
- P. O’Gorman u. a.: Longitudinal study of weight, appetite, performance status, and inflammation in advanced gastrointestinal cancer. In: Nutr Cancer, 35, 1999, S. 127–129, PMID 10693165.
- W. D. Dewys u. a.: Prognostic effect of weight loss prior to chemotherapy in cancer patients. Eastern Cooperative Oncology Group. In: Am J Med, 69, 1980, S. 491–497, PMID 7424938.
- H. Iwagaki u. a.: Cancer cachexia and depressive states: a neuro-endocrine-immunological disease? In: Acta medica Okayama, 51, 1997, S. 233–236, PMID 9284972.
- D. R. Brown u. a.: Weight loss is not associated with hyperleptinemia in humans with pancreatic cancer. In: J Clin Endocrinol Metab, 86, 2001, S. 162–166, PMID 11231995.
- N. Mac Donald u. a.: Understanding and managing cancer cachexia. In: J Am Coll Surg, 197, 2003, S. 143–161, PMID 12831935.
- D. L. Marks u. a.: Role of Central Melanocortin System in Cachexia. In: Cancer Research, 61, 2001, S. 1432–1438, PMID 11245447.
- E. G. Berenstein, Z. Ortiz: Megestrol acetate for the treatment of anorexia-cachexia syndrome. In: Cochrane Database Syst Rev, 2, 2005, CD004310, PMID 15846706 (Review).
- P. Ravasco u. a: Cancer: disease and nutrition are key determinants of patients’ quality of life. In: Support Care Cancer, 12, 2004, S. 246–252 PMID 14997369.
- K. Fearon u. a.: Pancreatic Cancer as a Model: Inflammatory Mediators, Acute Phase Response and Cancer Cachexia. In: World J Surgery, 23, 1999, S. 584–588, PMID 10227928 (Review).
- M. Tisdale: Biomedicine: Protein Loss in Cancer Cachexia. In: Science, 289, 2000, S. 2293–2295, PMID 11041796.
- G. Zurcher: Anorektisches Syndrom. In: Z Gastroenterology, 40, 2002, S. 71–75, PMID 11930295.
- R. Meier: Pathogenese der Tumorkachexie. (PDF; 110 kB) In: Schweizer Zeitschrift für Ernährungsmedizin, 4, 2007.
- M. J. Tisdale: Mechanisms of cancer cachexia. In: Physiol Rev, 89, 2009, S. 381–410, PMID 19342610 (Review).
- W. Böckler u. a.: Pathologie. Urban & Fischer Verlag, 2008, ISBN 3-437-42382-7, S. 211.
- A. S. Khan, S. Malik: Cachectin/tumor necrosis factor. In: J Pak Med Assoc, 46, 1996, S. 137–140, PMID 8991374 (Review).
- M. D. Barber u. a.: Disordered Metabolic Response with Cancer and its Management. In: World Journal of Surgery, 24, 2000, 24, S. 681–689, PMID 10773120.
- A. Roessner: Allgemeine Pathologie und Grundlagen der speziellen Pathologie. Urban & Fischer Verlag, 2008, ISBN 3-437-41541-7, S. 253.
- H. Dreger: Suppression der Hypertrophie kardialer Myozyten durch Inhibition des Ubiquitin-Proteasom-Systems. Dissertation, Medizinische Fakultät Charité der Humboldt-Universität zu Berlin, 2003.
- M. J. Tisdale: Catabolic mediators of cancer cachexia. In: Curr Opin Support Palliat Care, 2, 2008, S. 256–261, PMID 19069310 (Review).
- M. Stroud: Thalidomide and cancer cachexia: old problem, new hope? In: Gut, 54, 2005, S. 447–448, PMID 15753523 (Review).
- E. J. Ramos u. a.: Cancer anorexia-cachexia syndrome: cytokines and neuropeptides. In: Curr Opin Clin Nutr Metab Care, 7, 2004, S. 427–434, PMID 15192446 (Review).
- M. Maltoni u. a.: Serum levels of tumour necrosis factor alpha and other cytokines do not correlate with weight loss and anorexia in cancer patients. In: Support Care Cancer, 5, 1997, S. 130–135, PMID 9069613.
- M. P. Thompson u. a.: Increased expression of the mRNA for the hormone-sensitive lipase in adipose tissue of cancer patients. In: Biochim Biophys Acta, 1180, 1993, S. 236–242, PMID 8422428.
- C. J. Horvath u. a.: Effect of simian immunodeficiency virus infection on tumour necrosis factor-a production by alveolar macrophages. In: Lab Invest, 65, 1991, S. 280–286, PMID 1890808.
- A. Waage u. a.: Detection of tumour necrosis factor-like cytotoxicity in serum from patients with septicaemia but not from untreated cancer patients. In: Scand J Immunol, 24, 1986, S. 739–743, PMID 3798026.
- M. J. Tisdale: Proteolysis-Inducing Factor in Cancer Cachexia. In: Cachexia and Wasting: A Modern Approach. Verlag Springer, 2006, S. 483–488, doi:10.1007/978-88-470-0552-5.
- M. J. Tisdale: Biology of cachexia. In: J Natl Cancer Inst, 89, 1997, S. 1763–1773, PMID 9392617 (Review).
- M. J. Tisdale: Molecular pathways leading to cancer cachexia. In: Physiology, 20, 2005, S. 340–348, PMID 16174873 (Review).
- P. T. Todorov u. a.: Purification and characterization of a tumor lipid-mobilizing factor. In: Cancer Res, 58, 1998, S. 2353–2358, PMID 9622074.
- T. M. McDevitt u. a.: Purification and characterization of a lipid-mobilizing factor associated with cachexia-inducing tumors in mice and humans. In: Cancer Res, 55, 1995, S. 1458–1463, PMID 7882353.
- B. Fröhlich u. a.: Einfluss von lipid-mobilising factor (LMF) auf die Entwicklung der Tumorkachexie in vivo. In: Z Gastroenterol, 43, 2005, S. 227–228.
- E. Aulbert: Lehrbuch der Palliativmedizin. Verlag Schattauer, 2008, ISBN 3-7945-2361-X, S. 309.
- S. Khan, M. J. Tisdale: Catabolism of adipose tissue by a tumour-produced lipid-mobilising factor. In: Int J Cancer, 80, 1999, S. 444–447, PMID 9935188.
- A. Laviano: Lipid Mobilising Factor in Cancer Cachexi. In: Cachexia and Wasting: A Modern Approach. Verlag Springer, 2006, S. 489–493, doi:10.1007/978-88-470-0552-5.
- C. Bing u. a.: Zinc-alpha2-glycoprotein, a lipid mobilizing factor, is expressed in adipocytes and is up-regulated in mice with cancer cachexia. In: PNAS, 101, 2004, S. 2500–2505, PMID 14983038.
- P. T. Todorov u. a.: Characterization of a cancer cachectic factor. In: Nature, 379, 1996, S. 739–742, PMID 8602222.
- P. T. Todorov u. a.: Structural analysis of a tumor-produced sulfated glycoprotein capable of initiatingm uscle protein degradation. In: J Biol Chem, 272, 1997, S. 12279–12288, PMID 9139670.
- P. T. Todorov u. a.: Induction of muscle protein degradation and weight loss by a tumor product. In: Cancer Res, 56, 1996, S. 1256–1261, PMID 8640810.
- M. L. Williams u. a.: The relationship between a urinary cachectic factor and weight loss in advanced cancer patients. In: Cancer Invest, 22, 2004, S. 866–870, PMID 15641484.
- R. Cabal-Manzano u. a.: Proteolysis-inducing factor is expressed in tumours of patients with gastrointestinal cancers and correlates with weight loss. In: Br J Cancer, 84, 2001, S. 1599–1601, PMID 11401311.
- P. T. Todorov u. a.: Role of a proteolysis-inducing factor (PIF) in cachexia induced by a human melanoma (G361). In: Br J Cancer, 80, 1999, S. 1734–1737, PMID 10468289.
- S. M. Wyke, M. J. Tisdale: NF-kappaB mediates proteolysis inducing factor induced protein degradation and expression of the ubiquitin-proteasome system in skeletalmuscle. In: Br J Cancer, 92, 2005, S. 711–721, PMID 15714207.
- M. J. Lorite u. a.: Mechanism of muscle protein degradation induced by a cancer cachectic factor. In: Br J Cancer, 78, 1998, S. 850–856, PMID 9764574.
- M. J. Lorite u. a.: Induction of muscle protein degradation by a tumour factor. In: Br J Cancer, 76, 1997, S. 1035–1040, PMID 9376263.
- P. Cariuk u. a.: Induction of cachexia in mice by a product isolated from the urine of cachectic cancer patients. In: Br J Cancer, 76, 1997, S. 606–613, PMID 9303359.
- P. T. Todorov u. a.: Identification and characterization of a membrane receptor for proteolysis-inducing factor on skeletal muscle. In: Cancer Res, 67, 2007, S. 11419–11427, PMID 18056470.
- N. Teich u. a.: The presence of the proteolysis-inducing factor in urine does not predict the malignancy of a pancreatic tumour. In: BMC Gastroenterol, 5, 2005, S. 20, PMID 15969757.
- J. Ockenga u. a.: Tumoranorexie – Tumorkachexie in der Gastroenterologie: Standards und Visionen. In: Z Gastroenterol, 40, 2002, S. 929–936, doi:10.1055/s-2002-35411.
- B. M. Wieland: Is there a human homologue to the murine proteolysis-inducing factor? In: Clin Cancer Res, 13, 2007, S. 4984–4992, PMID 17785548.
- M. J. Tisdale: Cancer anorexia and cachexia. In: Nutrition, 17, 2001, S. 438–442, PMID 11377146 (Review).
- S. Priepke: Lebensmittelpräferenzen bei Patienten mit gastrointestinalen Tumoren. Dissertation, Humboldt-Universität zu Berlin, Universitätsklinikum Charité, 2006.
- G. Mantovani u. a.: Serum values of proinflammatory cytokines are inversely correlated with serum leptin levels in patients with advanced stage cancer at different sites. In: J Mol Med, 79, 2001, S. 406–414, PMID 11466563.
- G. Mantovani u. a.: Serum Levels of Leptin and Proinflammatory Cytokines in Patients with advanced-stage Cancer at different Sites. In: J Mol Med, 78, 2000, S. 554–561, PMID 11199328.
- F. Rossi Fanelli, A. Laviano: Cancer anorexia: a model for the understanding and treatment of secondary anorexia. In: International Journal of Cardiology, 85, 2002, S. 67–72, PMID 12163210.
- S. Forbes u. a.: Integrated control of appetite and fat metabolism by the leptin-proopiomelanocortin pathway. In: PNAS, 98, 2001, S. 4233–4237, PMID 11259669.
- D. Heber, N. Tchekmedyian: Pathophysiology of cancer: hormonal and metabolic abnormalities. In: Oncology, 49, 1992, S. 28–31, PMID 1461623 (Review).
- K. Nelson: The Cancer-Anorexia-Cachexia Syndrome. In: Seminars in Oncology, 27, 2000, S. 64–69, PMID 10697022.
- O. Selberg: Ursachen und Charakteristika der Tumorkachexie-Perspektiven einer ernährungsmedizinischen Behandlung. In: Ernährungsumschau, 47, 2000, S. 298–303.
- C. L. Loprinzi u. a.: Body composition changes in patients who gain weight while receiving megestrol acetate. In: J Clin Oncol, 11, 1993, S. 152–154, PMID 8418227.
- R. Patarca-Montero: Handbook of cancer-related fatigue. Haworth Press Inc, 2004, ISBN 0-7890-2168-4, S. 106.
- J. M. Arbeit u. a.: Resting energy expenditure in controls and cancer patients with localized and diffuse disease. In: Ann Surg, 199, 1984, S. 292–298, PMID 6703790.
- A. Theologides: Cancer cachexia. In: Cancer, 43, 1979, S. 2004–2012, PMID 376104 (Review).
- H. Munro: Tumor-host competition for nutrients in the cancer patient. In: J Am Diet Assoc, 71, 1977, S. 380–384, PMID 908798.
- D. T. Dempsey u. a.: Energy expenditure in malnourished gastrointestinal cancer patients. In: Cancer, 53, 1984, S. 1265–1273, PMID 6692317.
- D. M. Russell u. a.: Effects of total parenteral nutrition and chemotherapy on the metabolic derangements in small cell lung cancer. In: Cancer Res, 44, 1984, S. 1706–1711, PMID 6322985.
- I. Warnold u. a.: Energy balance and body composition in cancer patients. In: Cancer Res, 38, 1978, S. 1801–1807, PMID 647689.
- D. T. Hansell u. a.: The relationship between resting energy expenditure and weight loss in benign and malignant disease. In: Ann Surg, 203, 1986, S. 240–245, PMID 3082302.
- C. P. Holroyde u. a.: Altered glucose metabolism in metastatic carcinoma. In: Cancer Res, 35, 1975, S. 3710–3714, PMID 1192429.
- M. Lainscak u. a.: Cachexia: common, deadly, with an urgent need for precise definition and new therapies. In: The American Journal of Cardiology, 101, 2008, S. 8–10, PMID 18514632.
- P. Geels u. a.: Palliative effect of chemotherapy: objective tumor response is associated with symptom improvement in patients with metastatic breast cancer. In: J Clin Oncol, 18, 2000, S. 2395–2405, PMID 10856099.
- M. Muscaritoli: Therapy of muscle wasting in cancer: what is the future? In: Curr Opin Clin Nutr Metab Care, 7, 2004, S. 459–466, PMID 15192450.
- G. Mantovani, C. Madeddu: Cancer cachexia: medical management. In: Support Care Cancer [elektronische Veröffentlichung vor dem Druck], 2009, PMID 19688225.
- G. Mantovani u. a.: Randomized phase III clinical trial of five different arms of treatment for patients with cancer cachexia: interim results. In: Nutrition, 24, 2008, S. 305–313, PMID 18262758.
- M. Bossola u. a.: Novel treatments for cancer cachexia. In: Expert Opin Investig Drugs, 16, 2007, S. 1241–1253. (Review).
- Z. H. Khan u. a.: Oesophageal cancer and cachexia: the effect of short-term-treatment with thalidomide on weight loss and lean body mass. In: Aliment Pharmacol Ther, 17, 2003, S. 677–682, PMID 12641516.
- T. Hanada u. a.: Anti-cachectic effect of ghrelin in nude mice bearing human melanoma cells. In: Biochem Biophys Res Commun, 301, 2003, S. 275–279, PMID 12565855.
- W. Wang u. a.: Effects of ghrelin on anorexia in tumor-bearing mice with eicosanoid-related cachexia. In: Int J Oncol, 28, 2006, S. 1393–1400, PMID 16685441.
- M. D. DeBoer: Emergence of ghrelin as a treatment for cachexia syndromes. In: Nutrition, 24, 2008, S. 806–814, PMID 18725076 (Review).
- M. D. DeBoer u. a.: Ghrelin treatment causes increased food intake and retention of lean body mass in a rat model of cancer cachexia. In: Endocrinology, 148, 2007, S. 3004–3012, PMID 17347304.
- Y. L. Liu u. a.: Ghrelin alleviates cancer chemotherapy-associated dyspepsia in rodents. In: Cancer Chemother Pharmacol, 58, 2006, S. 326–333, PMID 16435157.
- J. A. Rudd u. a.: Anti-emetic activity of ghrelin in ferrets exposed to the cytotoxic anti-cancer agent cisplatin. In: Neurosci Lett, 392, 2006, S. 79–83, PMID 16182445.
- F. Strasser u. a.: Safety, tolerability and pharmacokinetics of intravenous ghrelin for cancer-related anorexia/cachexia: a randomised, placebo-controlled, double-blind, double-crossover study. In: British Journal of Cancer, 98, 2008, S. 300–308, PMID 18182992.
- J. M. Garcia u. a.: Active ghrelin levels and active to total ghrelin ratio in cancer-induced cachexia. (Memento des Originals vom 29. Dezember 2010 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: J Clin Endocrinol Metab, 90, 2005, S. 2920–2926, PMID 15713718.
- W. W. Cheung, R. H. Mak: Ghrelin and its analogues as therapeutic agents for anorexia and cachexia in end-stage renal disease. In: Kidney Int, 76, 2009, S. 135–137, PMID 19564855.
- T. A. Splinter: Cachexia and cancer: a clinician’s view. In: Ann Oncol, 3, 1992, S. 25–27, PMID 1382553.
- A. P. Lopez u. a.: Systematic review of megestrol acetate in the treatment of anorexia-cachexia syndrome. In: J Pain Sympt Manag, 27, 2004, S. 360–369, PMID 15050664 (Review).
- W. Leśniak u. a.: Effects of megestrol acetate in patients with cancer anorexia-cachexia syndrome – a systematic review and meta-analysis. In: Pol Arch Med Wewn, 118, 2008, S. 636–644, PMID 19140567 (Review).
- T. Yavuzsen u. a.: Systematic review of the treatment of cancer-associated anorexia and weight loss. In: J Clin Oncol, 23, 2005, S. 8500–8511, PMID 16293879(Review).
- R. Mechoulam (Editor): Cannabinoids as Therapeutic Agents. CRC Press, 1984. ISBN 0-8493-5772-1.
- E. Fride: Cannabinoids and feeding: the role of the endogenous cannabinoid system as a trigger for newborn suckling. In: J Cannabis Ther, 2, 2002, S. 51–62.
- E. Fride u. a.: Endocannabinoids and food intake: newborn suckling and appetite regulation. In: Adulthood Exp Biol Med, 230, 2005, S. 225–234, PMID 15792943 (Review).
- E. M. Berry, R. Mechoulam: Tetrahydrocannabinol and endocannabinoids in feeding and appetite. In: Pharmacol Ther, 95, 2002, S. 185–190, PMID 12182965 (Review).
- F. Strasser u. a.: Comparison of orally administered cannabis extract and delata-9-tetrahydrocannabinol in treating patients with cancer-related anorexia-cachexia syndrome. A multicenter, Phase III, randomized, double-blind, placebo-controlled clinical trial from the Cannabis-In-Cachexia-Study-Group. In: J Clin Oncol, 24, 2006, S. 3394–3400, PMID 16849753.
- A. Jatoi u. a.: Dronabinol versus combination therapy for cancer-associated anorexia: a North Central Cancer Treatment study. In: J Clin Oncol, 20, 2002, S. 567–573, PMID 11786587.
- M. J. Tisdale: Clinical anticachexia treatments. In: Nutr Clin Pract, 21, 2006, S. 168–174, PMID 16556927 (Review).
- J. R. Nicholson u. a.: Peripheral administration of a melanocortin 4-receptor inverse agonist prevents loss of lean body mass in tumor-bearing mice. In: J Pharmacol Exp Ther, 317, 2006, S. 771–777, PMID 16436498.
- D. O. McCarthy u. a.: Indomethacin and ibuprofen preserve gastrocnemius muscle mass in mice bearing the colon-26 adenocarcinoma. In: Res Nurs Health, 27, 2004, S. 174–184, PMID 15141370.
- M. Trikha u. a.: Targeted anti-interleukin-6 monoclonal antibody therapy for cancer: a review of the rationale and clinical evidence. In: Clin Cancer Res, 9, 2003, S. 4653–4665, PMID 14581334.
- K. Lundholm u. a.: Anti-inflammatory treatment may prolong survival in undernourished patients with metastatic solid tumors. In: Cancer Res54, 1994, S. 5602–5606, PMID 7923204.
- S. von Haehling u. a.: Cachexia: a therapeutic approach beyond cytokine antagonism. In: Int Jour Of Cardiology, 85, 2002, S. 173–183, PMID 12163222 (Review).
- V. Eleutherakis-Papaiakovou u. a.: Thalidomide in cancer medicine. In: Ann Oncol, 15,2004, S. 1151–1160, PMID15277253 (Review).
- E. Bruera u. a.: Thalidomide in patients with cachexia due to terminal cancer: preliminary report. In: Ann Oncol, 10, 1999, S. 857–859, PMID 10470435
- E. Esposito, S. Cuzzocrea: TNF-alpha as a therapeutic target in inflammatory diseases, ischemia-reperfusion injury and trauma. In: Curr Med Chem, 16, 2009, S. 3152–3167, PMID 19689289.
- K. H. Liu u. a.: Thalidomide attenuates tumor growth and preserves fast-twitch skeletal muscle fibers in cholangiocarcinoma rats. In: Surgery, 143, 2008, S. 375–383, PMID 18291259.
- D. Tassinari u. a.: Thalidomide in the treatment of cancer cachexia. In: J Palliat Care, 24, 2008, S. 187–189, PMID 18942570.
- J. N. Gordon u. a.: Thalidomide in the treatment of cancer cachexia: a randomised placebo controlled trial. In: Gut, 54, 2005, S. 540–545, PMID 15753541.
- M. J. Tisdale: The ubiquitin-proteasome pathway as a therapeutic target for muscle wasting. In: J Support Oncol, 3, 2005, S. 209–217, PMID 15915823 (Review).
- G. J. Wilson u. a.: Effects of beta-hydroxy-beta-methylbutyrate (HMB) on exercise performance and body composition across varying levels of age, sex, and training experience: A review. In: Nutr Metab (Lond), 5, 2008, 1, PMID 18173841 (Review).
- E. Jowko u. a.: Creatine and β-hydroxy-β-methylbutyrate (HMB) additively increase lean body mass and muscle strength during a weight-training program. In: Nutr, 17, 2001, S. 558–566, doi:10.1016/S0899-9007(01)00540-8 PMID 11448573.
- A. E. Knitter u. a.: Effects of β-hydroxy-β-methylbutyrate on muscle damage after a prolonged run. In: J Appl Physiol, 89, 2000, S. 1340–1344, PMID 11007567.
- P. M. Gallagher u. a.: β-hydroxy-β-methylbutyrate ingestion, part I: Effects on strength and fat free mass. In: Med Sci Sports Exerc, 32, 2000, S. 2109–2115, doi:10.1097/00005768-200012000-00022 PMID 11128859.
- D. M. O’Connor, M. J. Crowe: Effects of beta-hydroxy-beta-methylbutyrate and creatine monohydrate supplementation on the aerobic and anaerobic capacity of highly trained athletes. In: J Sports Med Phys Fitness, 43, 2003, S. 64–68, PMID 12629464.
- T. Palisin, J. J. Stacy: Beta-hydroxy-beta-Methylbutyrate and its use in athletics. In: Curr Sports Med Rep, 4, 2005, S. 220–223, PMID 16004832 (Review).
- M. J. Tisdale, S. A. Beck: Cancer cachexia. In: Int J Pancreatol, 7, 1990, S. 141–150, PMID 2081920 (Review).
- H. J. Smith u. a.: Attenuation of proteasome-induced proteolysis in skeletal muscle by beta-hydroxy-beta-methylbutyrate in cancerinduced muscle loss. In: Cancer Res, 65, 2005, S. 277–283, PMID 15665304.
- H. J. Smith u. a.: Mechanism of the attenuation of proteolysis-inducing factor stimulated protein degradation in muscle by β-hydroxy-β-methylbutyrate. In: Cancer Res, 64, 2004, S. 8731–8735, PMID 15574784.
- H. L Eley u. a.:Signaling pathways initiated by beta-hydroxy-beta-methylbutyrate to attenuate the depression of protein synthesis in skeletal muscle in response to cachectic stimuli. In: Am J Physiol Endocrinol Metab, 293, 2007, S. E923–31, PMID 17609254.
- E. A. Nunes u. a.: Beta-hydroxy-beta-methylbutyrate supplementation reduces tumor growth and tumor cell proliferation ex vivo and prevents cachexia in Walker 256 tumor-bearing rats by modifying nuclear factor-kappaB expression. In: Nutr Res, 28, 2008, S. 487–493, PMID 19083450.
- H. L. Eley u. a.: Attenuation of depression of muscle protein synthesis induced by lipopolysaccharide, tumor necrosis factor, and angiotensin II by beta-hydroxy-beta-methylbutyrate. In: Am J Physiol Endocrinol Metab, 295, 2008, S. E1409–1416, PMID 18854427.
- Studies Which Support the Efficacy of HMB supplementation in Varying Populations. aus PMID 18173841.
- Studies Which do not Support the Efficacy of HMB Supplementation in Varying Populations. aus PMID 18173841.
- P. E. May u. a.: Reversal of cancer-related wasting using oral supplementation with a combination of beta-hydroxy-beta-methylbutyrate, arginine and glutamine. In: Am J Surg, 181, 2002, S. 471–479, PMID 11975938.
- L. Berk: A randomized, double-blind, placebo-controlled trial of a beta-hydroxyl beta-methyl butyrate, glutamine, and arginine mixture for the treatment of cancer cachexia (RTOG 0122). In: Support Care Cancer, 16, 2008, S. 1179–1188, PMID 18293016.
- C. Madeddu, G. Mantovani: An update on promising agents for the treatment of cancer cachexia. In: Curr Opin Support Palliat Care, 3, 2009, S. 258–262 PMID 19667995 (Review).
- A. S. Whitehouse u. a.: Mechanism of attenuation of skeletal muscle protein catabolism in cancer cachexia by eicosapentaenoic acid. In: Cancer Res, 61, 2001, S. 3604–3609, PMID 11325828.
- M. D. Barber u. a.: The effect of an oral nutritional supplement enriched with fish oil on weight-loss in patients with pancreatic cancer. In: Br J Cancer, 81, 1999, S. 80–86, PMID 10487616.
- S. J. Wigmore u. a.: Effect of oral eicosapentaenoic acid on weight loss in patients with pancreatic cancer. In: Nutr Cancer, 36, 2000, S. 177–184, PMID 10890028.
- A. Jatoi u. a.: An eicosapentaenoic acid supplement versus megestrol acetate versus both in patients with cancer-associated wasting: a North Central Cancer Treatment Group and National Cancer Institute of Canada collaborative efforts. In: J Clin Oncol, 22, 2004, S. 2469–2476, PMID 15197210.
- K. C. Fearon u. a.: Double-blind, placebo controlled, randomised study of eicosapentaenoic acid diester in patients with cancer cachexia. In: J Clin Oncol, 24, 2006, S. 3401–3407, PMID 16849754.
- K. C. Fearon u. a.: Effect of a protein and energy dense N-3 fatty acid enriched oral supplement on loss of weight and lean tissue in cancer cachexia: a randomised double blind trial. In: Gut, 52, 2003, S. 1479–1486, PMID 12970142.
- C. Persson u. a.: Impact of fish oil and melatonin on cachexia in patients with advanced gastrointestinal cancer: a randomized pilot study. In: Nutrition, 21, 2005, S. 170–178, PMID 15723745.
- H. J. Smith: Effect of eicosapentaenoic acid, protein and amino acids on protein synthesis and degradation in skeletal muscle of cachectic mice. In: Br J Cancer, 91, 2004, S. 408–412, PMID 15213711.
- M. J. Heslin u. a.: Effect of systemic hyperinsulinemia in cancer patients. In: Cancer Res, 52, 1992, S. 3845–3850, PMID 1617658.
- K. Lundholm u. a.: Insulin Treatment in Cancer Cachexia: Effects on Survival, Metabolism, and Physical Functioning. In: Clinical Cancer Research, 13, 2007, S. 2699–2706, PMID 17473202.
- J. Gold: Anabolic profiles in late-stage cancer patients responsive to hydrazine sulfate. In: Nutr Cancer, 3, 1981, S. 13–19, PMID 7050921.
- B. Grubbs u. a.: Total parenteral nutrition and inhibition of gluconeogenesis on tumor-host responses. In: Oncology, 36, 1979, S. 216–223, PMID 113715.
- J. Gold: Hydrazine sulfate: a current perspective. In: Nutr Cancer, 9, 1987, S. 59–66, PMID 3104888 (Review).
- R. T. Chlebowski u. a.: Influence of hydrazine sulfate on abnormal carbohydrate metabolism in cancer patients with weight loss. In: Cancer Res, 44, 1984, S. 857–861, PMID 6692384.
- I. L. Cameron: Effect of total parenteral nutrition on tumor-host responses in rats. In: Cancer Treat Rep, 65, 1981, S. 93–99, PMID 6809328.
- S. J. Lee: Quadrupling Muscle Mass in Mice by Targeting TGF-β Signaling Pathways. In: PLoS ONE, 2, 2007, e789, doi:10.1371/journal.pone.0000789, PMID 17726519.
- J. M. Argiles u. a.: Cancer cachexia: the molecular mechanisms. In: Int J Biochem Cell Biol, 35, 2003, S. 405409, PMID 12565701 (Review).
- P. Schlag, C. Decker-Baumann: Strategies and needs for nutritional support in cancer surgery. In: Recent Results Cancer Res, 121, 1991, S. 45–52, PMID 1907017 (Review).
- F. Dombrowski u. a.: Allgemeine Pathologie. Urban & Fischer Verlag, 2004, ISBN 3-437-21290-7, S. 19.