Myostatin
Myostatin ist ein Protein (Eiweiß), das im menschlichen oder tierischen Körper gebildet wird. Es hemmt das Muskelwachstum, sodass die Muskeln nicht unkontrolliert wachsen. Follistatin wirkt hingegen antagonistisch, indem es sich an Myostatin bindet.[2]
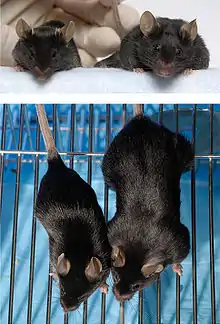
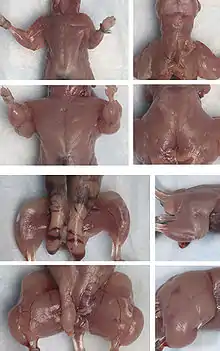 In der 1. und 3. Reihe die Muskelmasse des Wildtyps. Im Vergleich dazu die deutlich erhöhte Muskelmasse der transgenen Maus (2. und 4. Reihe)[2]
In der 1. und 3. Reihe die Muskelmasse des Wildtyps. Im Vergleich dazu die deutlich erhöhte Muskelmasse der transgenen Maus (2. und 4. Reihe)[2]
| Myostatin | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 109 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Präkursor | (375 aa) | |
| Bezeichner | ||
| Gen-Name | MSTN | |
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | Wirbeltiere[1] | |
Eine Inaktivierung der natürlichen Proteinfunktion von Myostatin führt zu überschießendem Muskelwachstum. Bei Mäusen, Rindern, Schafen und Hunden der Rasse Whippet sind Individuen bekannt, die aufgrund verschiedener Mutationen des Myostatin-Gens eine erheblich größere Muskelmasse als gesunde Tiere entwickeln. Für Whippets konnte festgestellt werden, dass Hunde mit zwei Kopien des mutierten Gens den in der Zucht unerwünschten stämmigen Phänotyp des „Bully whippet“ entwickeln. Hunde mit nur einer Kopie des mutierten Gens entwickelten zwar ebenfalls eine größere Muskelmasse als Hunde des Wildtyps und erreichten im Wettkampf eine signifikant höhere Geschwindigkeit, sie entsprachen jedoch dem Rassestandard.[3][4]
2004 wurde bei einem deutschen Jungen eine Mutation des Myostatin-Gens festgestellt, die die Bildung eines verkürzten und somit nicht voll funktionsfähigen Myostatin-Proteins zur Folge hat. Der Junge ist seit seiner Geburt ungewöhnlich muskulös.[5][6]
In der deutschsprachigen Öffentlichkeit wird seitdem Myostatin immer wieder als Kandidat für Gendoping genannt.[7] Allerdings müsste für ein Gendoping mit Myostatin die Wirkung des im Menschen vorhandenen natürlichen Myostatinproteins erfolgreich antagonisiert werden. Bislang gelingt dieser gentherapeutische Ansatz nur bei Mäusen mit schwerer Muskelerkrankung und auch nur mit mäßigem Erfolg.[8] Demgegenüber stehen konventionelle therapeutische Ansätze, die über eine direkte Blockade der natürlichen Myostatinwirkung im Tierversuch bereits erfolgreich waren. Man hofft hierdurch eines Tages muskeldegenerative Erkrankungen behandeln zu können. Mit MYO-029 (Stamulumab) wurde ein Antikörper, der das natürliche Myostatin hemmt, in einer klinischen Studie geprüft.[9] Dies hatte keinen signifikanten Erfolg. Möglicherweise kann aber ein gezielterer Inhibitor auf eine bessere Wirkung hoffen lassen.
2020 zeigte eine Studie, dass eine Unterdrückung der Signalproteine Myostatin und Activin A durch eine Lösung mit einem, mit diesen bindenden Protein (ACVR2B), dazu führt, dass die Mäuse ihre Muskel- und Knochenmasse in der Schwerelosigkeit auf der ISS beibehalten. Die Mäuse hatten durch eine Editierung der Gene, die für die Produktion von Myostatin verantwortlich sind, etwa die doppelte Muskelmasse gewöhnlicher Mäuse. Eine Therapie mit ACVR2B/Fc kann laut der Studie bei genetisch unmodifizierten Mäusen innerhalb von zwei Wochen zu einem 50 prozentigen Muskelwachstum führen. Die Auswirkungen im Mensch sind ähnlich aber größtenteils, mit nur wenig klinischer Forschung zu Decoy-Rezeptor „ACE-031“, relativ unerforscht und zum Stand Dezember 2020 mit sehr hohen Kosten verbunden.[10][11]
Weblinks
Einzelnachweise
- Homologe bei OMA
- Se-Jin Lee: Quadrupling Muscle Mass in Mice by Targeting TGF-ß Signaling Pathways. In: PLoS ONE. Band 2, Nr. 8, 29. August 2007, S. e789, doi:10.1371/journal.pone.0000789.
- E. A. Ostrander: Genetics and the Shape of Dogs. In: American Scientist. Band 95, Nummer 5, September-Oktober 2007, S. 406–413, ISSN 0003-0996. doi:10.1511/2007.67.3724.
- D. S. Mosher et al.: A mutation in the myostatin gene increases muscle mass and enhances racing performance in heterozygote dogs. In: PLoS Genetics. 3, Nummer 5, 2007, e79, doi:10.1371/journal.pgen.0030079. PMID 17530926.
- H. Dambeck: Wunderknabe trägt Muskel-Gen. In: Spiegel Online. Vom 24. Juni 2004
- M. Schuelke, K. R. Wagner, L. E. Stolz, C. Hübner, T. Riebel, W. Kömen, T. Braun, J. F. Tobin, S. J. Lee: Myostatin mutation associated with gross muscle hypertrophy in a child. In: The New England Journal of Medicine. Band 350, Nummer 26, Juni 2004, S. 2682–2688, ISSN 1533-4406. doi:10.1056/NEJMoa040933. PMID 15215484.
- Gendoping - Supersportler durch Biotechnologie (Memento des Originals vom 30. September 2007 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (www.3sat.de, letzter Zugriff am 24. Juni 2009).
- M. Bartoli, J. Poupiot u. a.: AAV-mediated delivery of a mutated myostatin propeptide ameliorates calpain 3 but not alpha-sarcoglycan deficiency. In: Gene therapy. Band 14, Nummer 9, Mai 2007, S. 733–740, ISSN 0969-7128. doi:10.1038/sj.gt.3302928. PMID 17330087.
- Klinische Studie (Phase I+II): Study Evaluating MYO-029 in Adult Muscular Dystrophy bei Clinicaltrials.gov der NIH
- 'Mighty mice' stay musclebound in space, boon for astronauts (en). In: phys.org.
- Se-Jin Lee, Adam Lehar, Jessica U. Meir, Christina Koch, Andrew Morgan, Lara E. Warren, Renata Rydzik, Daniel W. Youngstrom, Harshpreet Chandok, Joshy George, Joseph Gogain, Michael Michaud, Thomas A. Stoklasek, Yewei Liu, Emily L. Germain-Lee: Targeting myostatin/activin A protects against skeletal muscle and bone loss during spaceflight. In: Proceedings of the National Academy of Sciences. 117, Nr. 38, 22. September 2020, ISSN 0027-8424, S. 23942–23951. doi:10.1073/pnas.2014716117.