Lipidperoxidation
Unter Lipidperoxidation versteht man die oxidative Degradation von Lipiden. Bei diesem Prozess gibt ein Lipid Elektronen an reaktive Radikale ab. Die dadurch in Gang gesetzte radikalische Kettenreaktion kann bei Lipiden in der Zellmembran zur Zellschädigung führen. Bei Low-Density Lipoprotein (einem Lipoprotein, das Lipide im Blut transportiert) kommt es zu oxidativen Modifikationen, die über die Entstehung von Schaumzellen zu Arteriosklerose führen.[1] Die Lipidperoxidation ist außerdem verantwortlich für das Verderben von tierischen und pflanzlichen Ölen und Fetten („ranzig werden“). Meistens sind mehrfach ungesättigte Fettsäuren betroffen, da diese zahlreiche Doppelbindungen beinhalten, zwischen denen sich besonders reaktive Methylengruppen befinden.
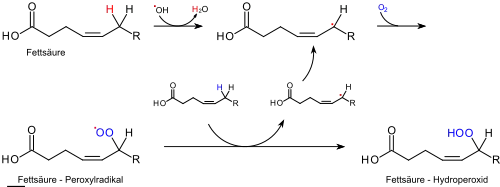
Startreaktion (Initiation)
Durch Reaktion einer Fettsäure (LH) mit einem Radikal entsteht ein reaktives Fettsäure-Radikal (L*), an das im nächsten Schritt der radikalischen Substitution O2 addiert und ein Lipidperoxyl-Radikal (LOO*) generiert, welches dann zu einer Kettenreaktion führt. In biologischen Systemen gibt es zahlreiche Initiatoren – häufig sind es reaktive Sauerstoffspezies. Enzyme wie Lipoxygenasen, Peroxidasen mit H2O2, Myeloperoxidase mit H2O2/Cl− oder Hämoglobin mit H2O2 sowie Makrophagen können Radikale generieren, die Lipidperoxidation auslösen.[2]
Folgereaktion (Prolongation)
Das entstandene Fettsäure-Peroxylradikal kann nun seine Radikal-Funktion durch Wasserstoffabstraktion auf andere ungesättigte Fettsäuren übertragen, die wiederum O2 addieren und so die Kettenreaktion in Gang halten oder mit einem Molekül mit antioxidativen Eigenschaften (z. B. α-Tocopherol oder γ-Tocopherol) reagieren. Im letzteren Fall wird die Kettenreaktion unterbrochen. Die Radikalkettenreaktion kommt zumeist erst dann voll in Gang, sobald alle Antioxidantien vollständig verbraucht sind (lag time).
Abbruchreaktion (Termination)
Die Kettenreaktion wird erst dann unterbrochen, wenn:
- durch Reaktion zweier Radikale ein stabiles Nicht-Radikal entsteht.
- die ungesättigten Fettsäuren verbraucht sind.
- Antioxidantien alle Radikale abfangen.
Es gibt zahlreiche natürliche fettlösliche Antioxidantien. So sind im menschlichen Low Density Lipoprotein im Durchschnitt pro Partikel 7 Moleküle α-Tocopherol vorhanden,[3] die ein vollständiges Ausoxidieren von biologischen Einheiten in lebenden Organismen verhindern.
Literatur
- U. Martens: Die Auswirkungen von wasserstoffperoxidinduzierter Lipidperoxidation auf die Fettsäurenkomposition erythrozytärer Phospholipide. Fragment einer Dissertation an der Uni Heidelberg, veröffentlicht am 25. August 1999, pdf
- Joachim Rassow, Karin Hause, Roland Netzker, Rainer Deutzmann: Duale Reihe – Biochemie. 1. Auflage. Thieme, 2006, ISBN 3-13-125351-7.
Einzelnachweise
- H. Esterbauer, S. P. Gieseg, A. Giessauf, O. Ziouzenkova, P. Ramos: Role of natural antioxidants in inhibiting Cu++-mediated oxidation of LDL. In: G. Bellomo, G. Finardi, E. Maggi, C. Rice-Evans (Hrsg.): Free Radicals Lipoprotein Oxidation and Atherosclerosis-Biological and Clinical Aspects. Richelieu Press, 1995, ISBN 0-903840-10-3, S. 11–26.
- H. Esterbauer, S. P. Gieseg, A. Giessauf, O. Ziouzenkova, P. Ramos: Role of natural antioxidants in inhibiting Cu++-mediated oxidation of LDL. In: G. Bellomo, G. Finardi, E. Maggi, C. Rice-Evans (Hrsg.): Free Radicals Lipoprotein Oxidation and Atherosclerosis-Biological and Clinical Aspects. Richelieu Press, 1995, ISBN 0-903840-10-3, S. 13.
- H. Esterbauer, J. Gebicki, H. Puhl, G. Jürgens: The role of lipid peroxidation and antioxidants in oxidative modification of LDL. In: Free Rad. Biol. Med. 13, 1992, S. 341–390. (englisch).