Styroloxid
Styroloxid (auch [1,2-Epoxyethyl]-benzol, Phenylethylenoxid, Phenyloxiran, Styrolepoxid) ist eine chemische organische Verbindung, die der Stoffgruppe der Epoxiden bzw. Oxiranen zugeordnet werden kann. Es gehört somit zu den substituierten gesättigten 3-Ring-Heterocyclen. In Bezug auf die Phenylgruppe handelt es sich auch um einen substituierten Aromaten. Hinsichtlich der chemischen Ableitung vom Styrol kann es auch als dessen Derivat angesehen werden.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
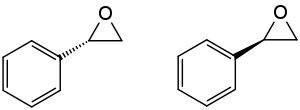 | |||||||||||||||||||
| Strukturformeln der beiden isomeren Styroloxide: (S)- und (R)-Enantiomer | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Styroloxid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C8H8O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit aromatischem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 120,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,05 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
194 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,5342 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Wenn in diesem Text oder in der wissenschaftlichen Literatur „Styroloxid“ ohne weiteren Namenszusatz (Präfix) erwähnt wird, ist (RS)-Styroloxid – also racemisches (±)-Styroloxid – gemeint.
Darstellung und Gewinnung
Styroloxid kann durch eine Addition von hypochloriger Säure an Styrol gefolgt von einer Abspaltung von Chlorwasserstoff in Gegenwart Alkalilauge hergestellt werden.[3] Eine weitere Möglichkeit ist die direkte Einwirkung von Peressigsäure oder Wasserstoffperoxid in einer elektrocyclischen Reaktion auf Styrol.[3]
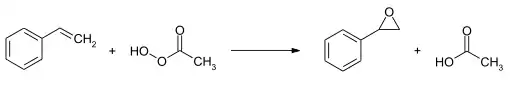
Die einzelnen Enantiomere können mittels einer asymmetrischen Jacobsen-Epoxidierung oder Shi-Epoxidierung synthetisiert werden.[3] Diese sind auch über eine enzymatische oder chemisch kinetische Racematspaltung zugänglich.[3]
Eigenschaften
Styroloxid ist eine farblose Flüssigkeit. Styroloxid reagiert heftig mit Nucleophilen (z. B. Aminen) und Elektrophilen. Hierbei wird die hohe Dreiring-Spannungsenergie freigesetzt.
In Wasser löst sich Styroloxid nur gering. Säurespuren in Wasser bewirken eine spontane Hydrolyse zu Phenylethylenglycol; es bildet sich dabei über eine Benzylkation-Zwischenstufe ein racemisches Wasseraddukt. In vivo bewirkt die Epoxidhydrolase diese Hydrolyse.
Mit Wasser wird ein bei 99,2 °C azeotrop siedendes Gemisch gebildet, welches 77,6 % Styroloxid enthält.[6]
Bei Fehlen genügender Wassermengen isomerisiert es säurekatalysiert zu Phenylacetaldehyd.[7] In Lösung kann durch Zusatz einer schwachen Base wie festes Natriumhydrogencarbonat diese Isomerisierung verhindert werden. In vivo bewirkt die Styroloxid-Isomerase (SOI) diese Isomerisierung.
Styroloxid bildet bei erhöhter Temperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt unterhalb von 74 °C. Der Explosionsbereich liegt zwischen 1,1 Vol.‑% als untere Explosionsgrenze (UEG) und 22 Vol.‑% als obere Explosionsgrenze (OEG). Die Zündtemperatur beträgt 498 °C. Der Stoff fällt somit in die Temperaturklasse T1.[2]
Isomerie
Styroloxid besitzt am benzylischen Kohlenstoffatom ein Stereozentrum, d. h., es ist chiral und es existieren (R)-Styroloxid und (S)-Styroloxid. Unter achiralen Reaktionsbedingungen bildet sich immer das Enantiomerengemisch als racemisches Styroloxid. Styrol-Monooxygenase in Bakterien bildet das (S)-Styroloxid.
Toxikologie
Die Dämpfe wirken reizend auf die Augen und Atemwege. Der direkte Hautkontakt führt zu einer mäßigen Hautreizung. Bei massiver inhalativer Exposition kann eine Irritation der Atemwege, die Bildung eines toxischen Lungenödems, das Auftreten von Übelkeit und einer zentralnervöser Depression erfolgen.[3] In Tierversuchen stellte sich Styroloxid wegen seines hohen Alkylierungspotentials als krebserregend heraus und es gilt daher als giftig. Im Körper werden dessen Zerfallsprodukte Phenylethylenglycol und Phenylacetaldehyd zu Mandelsäure, Phenylglyoxylsäure, Benzoesäure und Hippursäure metabolisiert.
Verwendung
Die Hydrierung ergibt das als Geruchsstoff verwendete 2-Phenylethanol. Die Verbindung kommt in einer Synthese des Choleretikums Fenipentol als Edukt vor. Es ist auch eine Vorstufe für die Herstellung von Polymerisationskatalysatoren und -inhibitoren. Weiterhin wird es als Substrat zur Überprüfung der Aktivität von Hydrolase-Enzymen und zum Test der Effektivität chromatographischer Methoden zur Enantiomerentrennung eingesetzt.[3]
Einzelnachweise
- Eintrag zu STYRENE OXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. September 2021.
- Eintrag zu (Epoxyethyl)benzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu Styroloxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. Dezember 2014.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-430.
- Eintrag zu (epoxyethyl)benzene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- L.H. Horsley: Azeotropic Data II, Advances in Chemistry Series 35, American Chemical Society, Washington D.C., 1962.
- Patentanmeldung DE3546372A1: Neue Phenylacetaldehyde und Verfahren zur Herstellung von Phenylacetaldehyden. Angemeldet am 31. Dezember 1985, veröffentlicht am 2. Juli 1987, Anmelder: BASF AG, Erfinder: Wolfgang Hölderich et al.

