Weißbauchschuppentier
Das Weißbauchschuppentier (Phataginus tricuspis, Syn.: Manis tricuspis) ist eine Säugetierart aus der Familie der Schuppentiere (Manidae). Es kommt im westlichen und zentralen Afrika vor und bevorzugt tropische Regenwälder als Lebensraum. Überwiegend sind die Tiere nachtaktiv und leben als Einzelgänger. Mit dem ausgesprochen langen Schwanz und dem kleinen Körperbau ist das Weißbauchschuppentier an ein Leben in Bäumen angepasst, es kommt aber auch auf dem Boden vor und ist zusätzlich ein guter Schwimmer. Die Ernährungsweise der Schuppentierart ist stark spezialisiert, ihre Hauptnahrung besteht überwiegend aus Termiten, seltener frisst sie Ameisen. Übermäßige Bejagung zu Ernährungszwecken und für eine Verwendung einzelner Körperteile, hauptsächlich der Schuppen, in verschiedenen medizinischen Bräuchen haben zu einem deutlichen Rückgang lokaler Populationen geführt. Dadurch wird der Gesamtbestand heute als gefährdet angesehen. Die wissenschaftliche Erstbeschreibung erfolgte 1821. Vermutlich schließt das Weißbauchschuppentier mehrere kryptische Arten ein.
| Weißbauchschuppentier | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Weißbauchschuppentier (Phataginus tricuspis) im Zoo San Diego. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Phataginus tricuspis | ||||||||||||
| (Rafinesque, 1821) |
Merkmale
Habitus
Das Weißbauchschuppentier zählt neben dem nahe verwandten Langschwanzschuppentier (Phataginus tetradactyla) zu den kleinsten Schuppentieren. Es erreicht eine Kopf-Rumpf-Länge von 35 bis 43 cm, der Schwanz wird rund 34 bis 62 cm lang. Damit ist der Schwanz etwa anderthalbmal so lang wie der restliche Körper, allerdings verhältnismäßig kürzer als beim Langschwanzschuppentier. Das Gewicht variiert von 1,6 bis 3,0 kg, männliche Tiere sind meist größer als weibliche. Wie bei allen Schuppentieren sind die Oberseite des Kopfes, der Rücken und die Flanken, die Außenseiten der Gliedmaßen (allerdings nicht die Unterarme) sowie der Schwanz mit Hornschuppen bedeckt. Die Schuppen zeigen eine einheitliche Färbung, die von graubraun über rötlichbraun bis braungelb variiert. Die Schuppen sind relativ klein, länger als breit und haben drei, nach hinten zeigenden Spitzen. Sie bilden am Körper 19 bis 22, teilweise auch 25 quer verlaufende Reihen. Eine längs über den Rücken ziehende Mittelreihe reicht bis auf den Schwanz. Sie besteht dort aus 30 bis 33 Schuppen, bricht aber kurz vor dem Schwanzende ab und wird durch eine Reihe aus 3 bis 6 Schuppenpaaren ersetzt. An den Seiten des Schwanzes befinden sich noch einmal je 34 bis 37 Schuppen. Das untere Schwanzende ist nicht mit Schuppen bedeckt, stattdessen besitzt das Weißbauchschuppentier dort ein Hautpolster. Die Haut an den unbeschuppten Körperteilen weist einen bräunlichen Farbton auf. Am Bauch ist sie mit weißlichen, dünnen und langen Haaren bedeckt, die an den Beinen in eine bräunliche Farbe übergehen. Der Kopf zeigt eine konische Form, die Schnauze ist gegenüber dem Langschwanzschuppentier dicker, wodurch der Schädel massiger wirkt. Er ist nur spärlich behaart und besitzt dunkle Flecken unter den Augen. Die Augen sind klein mit dunkler Iris und treten hervor. Ohrwülste werden nicht ausgebildet, dafür umgibt die Ohröffnung ein dichtes Haarbüschel. Die Vorderbeine sind etwas kürzer als die Hinterbeine. Alle Gliedmaßen enden in fünf Zehen mit kräftigen, gebogenen Krallen. Die mittlere der Vorderfüße ist zu einer großen Grabkralle verlängert, die die anderen um das Doppelte an Länge übertrifft. Der Hinterfuß erreicht eine Länge von 4,4 bis 5,4 cm.[1][2]
Schädel- und Skelettmerkmale

Der Schädel des Weißbauchschuppentiers wird zwischen 6 und 8 cm lang. Die Wirbelsäule setzt sich aus 7 Hals-, 13 Brust-, 6 Lenden-, 2 Kreuzbein- und 41 Schwanzwirbeln zusammen, insgesamt sind somit 69 Wirbel ausgebildet.[3] Der Schwanz umfasst somit etwas weniger Wirbel als beim Langschwanzschuppentier.[1][2]
Verbreitung und Lebensraum
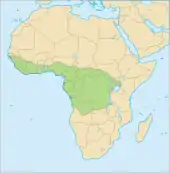
Das Verbreitungsgebiet des Weißbauchschuppentiers umfasst Teile von West- und Zentralafrika. Es erstreckt sich von Guinea bis in die Länder des Kongobeckens bis etwa in die nördlichsten Bereiche von Angola. Im Osten ist es noch im Südwesten Kenias sowie im Nordwesten Tansanias und Sambias anzutreffen. Angaben über Vorkommen im Norden von Mosambik und Malawi sind eher zweifelhaft. Hauptsächlich bewohnt die Schuppentierart tropische Regenwälder, sie kommt aber auch in Mosaiklandschaften und offeneren Savannenlandschaften vor, ebenso wie in Sekundärwäldern. Teilweise wurde sie auch in aufgelassenen landwirtschaftlichen Nutzflächen beobachtet, etwa auf verlassenen oder wenig begangenen Ölpalmenplantagen. Dies lässt annehmen, dass die Tiere einen gewissen Grad an Landschaftsbeeinflussung tolerieren. Über weite Teile des Verbreitungsgebietes tritt das Weißbauchschuppentier sympatrisch mit dem Langschwanzschuppentier auf, das aber sumpfigere Regionen bevorzugt. Beobachtungen in Nigeria geben an, dass das Weißbauchschuppentier deutlich häufiger vorkommt als sein naher Verwandter.[4] In nahrungsreichen Gebieten kann die Populationsdichte verhältnismäßig hoch sein.[1][2] Für das Lama-Waldreservat in Benin wurden 38 Weißbauchschuppentiere auf 45 km² ermittelt, was 0,84 Individuen je Quadratkilometer entspricht. Hier konnte kein größerer Unterschied in der Häufigkeit der Schuppentierart zwischen den Primärwäldern im Zentrum des Schutzgebietes und den umliegenden alten Plantagen ermittelt werden.[5]
Lebensweise
Territorialverhalten

Das Weißbauchschuppentier gehört neben dem Langschwanzschuppentier zu den am besten ausgeprägten Baumbewohnern innerhalb der Schuppentiere, abweichend von diesem ist es aber wesentlich stärker nachtaktiv. Seine Aktivitätsphase beginnt zwischen 18:00 Uhr und Mitternacht. Sie dauert etwa drei bis vier Stunden bei Weibchen an und bis zu zehn Stunden bei Männchen. Meist ruht das Weißbauchschuppentier in Baumhöhlen etwa 10 bis 15 m über dem Erdboden. In Benin konnten Tiere bevorzugt in Höhlen des Kapokbaumes oder aber von Dialium guineense beobachtet werden.[5] Teilweise graben sie auch kleine Erdhöhlen von 30 bis 40 cm Tiefe. Der außerordentlich lange Schwanz des Weißbauchschuppentiers ist eine deutliche Anpassung an das Baumleben. Er dient als Greifschwanz und kann als „fünfte Gliedmaße“ das Gewicht eines Tieres für längere Zeit allein halten. In den Bäumen klettert es mit Hilfe seiner Krallen und des Schwanzes, der zum Abstützen häufig um Äste und Stämme gerollt wird. Vorder- und Hinterbeine werden paarweise bewegt, sodass ein typisch raupenartiger Gang mit sich beugendem und streckendem Rücken entsteht. Beim Absteigen vom Baum bewegt sich ein Tier spiralartig um den Stamm. Manchmal lässt es sich auch zu einer Kugel zusammengerollt herabfallen, was als Reaktion auf brechende Äste angesehen wird. Am Boden nutzt das Weißbauchschuppentier verschiedene Fortbewegungsweisen. Am häufigsten ist der normale vierfüßige Gang, bei dem es Geschwindigkeiten zwischen 1,0 und 1,5 km/h erreicht und die Vorderfüße mit der Fußfläche aufsetzt. Beim schnelleren Lauf fällt es ebenfalls in eine raupenartige Bewegung, wobei der Schwanz dann erhöht gehalten wird. Dabei liegt das größte Gewicht auf den Hinterbeinen. Die Schuppentierart kann sehr gut schwimmen. Dabei bewegt sich der Schwanz undulierend ähnlich einer Schlange und gibt den Vortrieb. Vor dem Schwimmen nimmt ein Tier extra Luft auf, sodass der Körperdurchmesser um bis zu 11 cm zunehmen kann. Diese zusätzliche Luft sorgt dafür, dass der Körper über Wasser gehalten werden kann. Nach dem Schwimmen wird die Luft ausgestoßen, was mit einem trompetenartigen Geräusch einhergeht.[1][2]
Überwiegend lebt das Weißbauchschuppentier einzelgängerisch und benutzt Aktionsräume, die bei weiblichen Individuen 3 bis 4 ha groß sind, bei männlichen mit über 30 ha aber mehr als die siebenfache Fläche einnehmen. Letztere legen bei ihren nächtlichen Streifzügen bis zu 1,8 km zurück, was im Vergleich zu ihrem großen Aktionsraum relativ wenig ist. Im Aktionsraum befinden sich mehrere Baumhöhlen, die abwechselnd genutzt werden. Männliche Tiere wechseln ihren Unterschlupf täglich, weibliche seltener. Die Reviere der Männchen können sich mit bis zu zehn der Weibchen überlappen. Männliche Tiere tolerieren weibliche in ihrem Territorium, verjagen aber allein umherziehende Jungtiere. Zwischen männlichen Tieren gibt es eine gewisse Territorialität, Kämpfe werden mit synchronisierten Schlägen der Vorderbeine ausgetragen. Zumindest in Gefangenschaft kamen dabei einzelne Tiere ums Leben. Die soziale Kommunikation findet über den hervorragenden Geruchssinn statt. Das Streifgebiet wird mit einem Sekret aus den Analdrüsen markiert. Sekrete aus den Perinealdrüsen kommen bei Aggression und bei Sexualkontakten zum Einsatz.[1][2]
Ernährung
Die Nahrung des Weißbauchschuppentiers besteht aus staatenbildenden Insekten, wodurch die Schuppentierart strikt myrmecophag lebt. Abweichend vom Langschwanzschuppentier bevorzugt sie Termiten vor allem der Gattungen Nasutitermes und Microcerotermes, von denen sie die ausgewachsenen Individuen und die Nymphen vertilgt. Seltener frisst das Weißbauchschuppentier dagegen Ameisen. Unter diesen überwiegen Wanderameisen wie Dorylus oder Mirmicaria, aber auch Arten der Gattungen Camponotus, Cataulcus, Crematogaster oder Oceophylla gehören zum Nahrungsspektrum. Die Tiere fressen sowohl baumlebende als auch bodenbewohnende Kolonien, letztere überwiegen aber bei Männchen und subadulten Individuen. Die Nahrung wird mit dem exzellenten Geruchssinn aufgespürt, häufig sucht das Weißbauchschuppentier unter umgefallenen Bäumen oder im Laub. Es attackiert die Nester der Insekten von mehreren Seiten und bricht sie mit den Krallen der Vorderfüße häufig an mehreren Stellen auf. Die Beute verschlingt es mit Hilfe der langen, klebrigen Zunge, die bis zu 30 cm lang werden kann. In der Regel werden die Nester nicht vollständig zerstört, sondern einzelne Tiere kehren mehrmals hintereinander zur gleichen Nahrungsquelle zurück. Weibchen suchen meist Nester in der Nähe des Baus auf, nur wenige hundert Meter entfernt, und fressen rund drei bis vier Stunden täglich. Dagegen entfernen sich Männchen weiter vom Bau und verbringen fünf bis sechs Stunden mit der Nahrungsaufnahme. Täglich kann das Weißbauchschuppentier zwischen 150 und 200 g Insekten vertilgen. Nach dem Fressen wälzt sich ein Tier häufig am Boden, rutscht über diesen, reibt sich an Gegenständen oder spreizt die Schuppen und kratzt sich mit den Krallen, um Insekten zu zerquetschen, die während der Verteidigung des Nestes zwischen die Schuppen gekrabbelt sind.[6][1][2]
Fortpflanzung
Die Fortpflanzung erfolgt ganzjährig. Männliche Tiere durchqueren täglich mehrere Aktionsräume, um nach empfangsbereiten Weibchen Ausschau zu halten. Die Brunft setzt bei weiblichen Tieren alle 3 bis 29 Tage ein, durchschnittlich beträgt der Abstand 9 Tage. Das Vorspiel besteht aus ritualisierten Kämpfen Brust gegen Brust. Danach klettern beide Partner auf einen Baum, in der Regel klammert sich das Weibchen an den Schwanz des Männchens. Während des Geschlechtsaktes, der im Baum stattfindet, sind die Schwänze der beiden Tiere miteinander verflochten. Die Tragzeit wird häufig mit rund 150 Tage angegeben, einzelne Beobachtungen gehen von 112 bis 168 Tagen aus. Sie könnte sich aber auch insgesamt über einen Zeitraum von 7 bis 9 Monate erstrecken. Bei zehn in Gefangenschaft untersuchten trächtigen Weibchen verlief gut die Hälfte der Geburt problematisch und endete mit dem Tod des Jung- und/oder des Muttertiers.[7] In der Regel kommt nur ein Jungtier zur Welt. Dieses ist etwa 29 cm lang und 100 g schwer. Es hat geöffnete Augen, eine rosa Hauttönung und ist haarlos mit Ausnahme der Augenlider. Die ersten ein bis zwei Wochen verbringt das Junge in einer Baumhöhle, danach verlässt es diese auf der Schwanzwurzel der Mutter reitend. Die Saugphase endet nach rund vier Monaten, das Gewicht liegt dann bei etwa 750 g. Mit der Geburt des nächsten Jungtiers verlässt das ältere Junge das Muttertier und geht auf Wanderschaft ohne festen Aktionsraum. Die sexuelle Reife ist mit rund acht Monaten erreicht, nach 15 Monaten wiegt das Junge über 1 kg und ist dann vollständig ausgewachsen, ab dieser Zeit lebt es in seinem eigenen Aktionsraum.[1][2]
Fressfeinde und Feindverhalten

Als hauptsächlicher Fressfeind tritt der Leopard auf. Untersuchte Kotreste der Raubkatze im Lopé- und Nationalpark Ivindo in Gabun zeigen aber nur einen geringen Anteil im weiten Beutespektrum.[8][9] Das Gleiche gilt für die Afrikanische Goldkatze, deren Fäzes im Ituri forest im nordöstlichen Teil des Kongobeckens genauer untersucht wurden.[10] Darüber hinaus stellen auch der Honigdachs und Schakale dem Weißbauchschuppentier nach. Teilweise werden Tiere Opfer des Nördlichen Felsenpythons und von Schimpansen.[11] Häufig findet die Bejagung am Boden statt. Bei unmittelbarer Gefahr stößt ein Tier Sekrete aus seinen Drüsen aus oder rollt sich ein und bedeckt unbeschuppte Körperstellen mit dem Schwanz, ansonsten flüchtet es häufig auf einen Baum.[1][2]
Parasiten
Äußere Parasiten stellen Zecken der Gattung Amblyomma dar, die sich meist unter den Nacken- und Rückenschuppen einnisten.[6][12] Bei Untersuchungen von 26 Weißbauchschuppentieren aus verschiedenen Regionen Ghanas konnte die Zeckengattung an allen Individuen festgestellt werden, darüber hinaus kam äußerst selten noch ein Vertreter der Gattung Haemaphysalis vor.[13] Als innere Parasiten sind vor allem Fadenwürmer und das zu den Kokzidien zählende Eimeria bekannt.[14]
Systematik
Innere Systematik der Manidae nach Gaubert et al. 2018[15]
|
Das Weißbauchschuppentier ist eine Art aus der Gattung Phataginus, die mit dem Langschwanzschuppentier (Phataginus tetradactyla) noch eine weitere enthält. Beide Arten repräsentieren die baumbewohnenden Schuppentiere Afrikas, diese trennten sich laut molekulargenetischen Analysen im Mittleren Miozän vor etwa 13,3 Millionen Jahren voneinander ab. Phataginus formt die eigenständige Unterfamilie der Phatagininae. Ihr gegenüber steht die Unterfamilie der Smutsiinae mit der Gattung Smutsia, in der die bodenbewohnenden Schuppentiere Afrikas vereint sind. Als Schwestertaxon der beiden afrikanischen Linien gelten die asiatischen Schuppentiere der Unterfamilie Maninae mit der Gattung Manis. Alle drei Gruppen zusammen bilden die Familie der Schuppentiere (Manidae). Die Schuppentiere umfassen das gegenwärtig einzige Mitglied der Ordnung der Pholidota, diese sind somit rezent monotypisch. Die Gruppe ist weitläufig mit den Raubtieren (Carnivora) verwandt, die Beziehung zueinander wurde aber erst durch molekulargenetische Untersuchungen ermittelt und abgesichert.[16][17][15]
Allerdings wird in einigen anderen Gliederungsversuchen der Schuppentiere die Gattung Manis, die hier die asiatischen Vertreter umfasst, als einzige anerkannte Gattung der Schuppentiere angesehen. Alle anderen Gattungen einschließlich Phataginus haben dann den Status von Untergattungen.[18][1] Andererseits besteht auch die Auffassung einer weitaus stärkeren Aufsplitterung der Schuppentiere. Hier wiederum bildet das Weißbauchschuppentier den einzigen Vertreter der Gattung Phataginus, das nahe verwandte Langschwanzschuppentier steht dann in der Gattung Uromanis.[19] Die heute favorisierte Aufteilung der Familie der Schuppentiere in die drei Gattungen Manis, Phataginus und Smutsia wurde erstmals Ende der 1990er Jahre vorgeschlagen.[20][21] Nachfolgende anatomische und phylogenetische Studien untermauerten diese Ansicht.[17][15]
Einige Autoren unterscheiden zwei Unterarten des Weißbauchschuppentiers:[18][1]
- M. t. mabirae (Rafinesque, 1821)
- M. t. tricuspis Allen & Loveridge , 1942
Das Typusexemplar von M. t. mabirae stammt aus Uganda, wo es 1938 von Arthur Loveridge gesammelt worden war, und verfügt neben einigen abweichenden Schädelmerkmalen über eine orange- bis zimtfarbene Bauchfelltönung.[22]
Innere Systematik des Weißbauchschuppentiers nach Gaubert et al. 2016[23]
|

Die Aufteilung in mehrere Unterarten ist aber aufgrund der hohen Variabilität des Weißbauchschuppentiers nicht allgemein anerkannt, aufgrund dessen wird es meist als monotypisch angesehen. Molekulargenetische Untersuchungen aus dem Jahr 2015 lassen große Unterschiede zwischen den westlichen und den östlichen Populationen erkennen, die gemäß den Autoren der Studie möglicherweise eine Differenzierung auf Artniveau befürworten. Unterstützt wird diese Ansicht dadurch, dass zwischen Kamerun und Gabun eine biogeographische Barriere besteht, die sogenannte charnière climatique, die beide Populationen voneinander trennt.[24] Weitere Analysen aus den folgenden Jahren an über 100 Weißbauchschuppentieren zeigen eine weitaus komplexere Gliederung auf. Es können insgesamt sechs phylogenetische Linien ermittelt werden, die wahrscheinlich jeweils eigenständige Arten darstellen. Die Aufgliederung dieser weitverzweigten Gruppe begann bereits im Übergang vom Pliozän zum Pleistozän vor etwa 2,7 Millionen Jahren.[23][15] Neben der genetischen Diversität zeigen sich auch Unterschiede im Schädelbau zwischen den einzelnen Populationen.[25] Fossilfunde der Schuppentierart sind nicht bekannt.[1][2]
Das Weißbauchschuppentier wurde im Jahr 1821 von Constantine S. Rafinesque-Schmaltz unter der Bezeichnung Manis tricuspis wissenschaftlich erstbeschrieben. Die Typuslokalität gab Rafinesque mit Guinée an, er sah sein Manis tricuspis aber als synonym zu Manis tetradactyla an, dem Langschwanzschuppentier, welches bereits 1766 von Linnaeus benannt worden war. In der gleichen Arbeit stellte Rafinesque die Art Manis ceonyx auf, die heute als identisch mit dem Langschwanzschuppentier gilt. Für die beiden von ihm angegebenen Arten etablierte Rafinesque gleichzeitig Phataginus als neue Untergattung für Manis. Für Phataginus ermittelte er Unterschiede im Bau des Fußes im Vergleich zum damals bekannten Chinesischen Schuppentier (Manis pentadactyla) als asiatischem Vertreter von Manis, dem Rafinesque eine Zuweisung zur Untergattung Pangolinus bescheinigte. Für das Weißbauchschuppentier führte Rafinesque zudem die umgangssprachliche Bezeichnung Phatagin tricuspidé ein. Das Artepitheton tricuspis bezieht sich auf die drei Spitzen der Schuppen.[26]
Bedrohung und Schutz
Das Weißbauchschuppentier wird stark bejagt. Sein Fleisch gilt als Delikatesse und gelangt lokal auf Märkte, wo es als Bushmeat angeboten wird. Daneben finden die Schuppen und andere Körperteile Verwendung bei traditionellen, medizinischen Gebräuchen in Afrika, etwa beim juju, da ihnen Heilkräfte zugesprochen werden.[4] Die Yoruba in Nigeria nutzen Körperteile des Weißbauchschuppentiers bei mehr als 40 Krankheiten, etwa die Schuppen bei Magenproblemen oder Durchfall, das Fleisch zur Beruhigung oder die Augen gegen Kleptomanie. Allein zwischen April und Juli 2007 boten Händler auf Märkten im nigerianischen Bundesstaat Ogun Untersuchungen zufolge 178 Weißbauchschuppentiere für medizinische Zwecke an.[27][28] Studien in der Bombali-Region von Sierra Leone ergaben, dass insgesamt 22 verschiedene Körperteile zur Heilung unterschiedlichster Krankheiten genutzt werden, wobei die Schuppen bei Weitem überwiegen.[29] Zunehmend gerät das Weißbauchschuppentier auch in den internationalen Handel, wobei der größte Teil nach Ostasien exportiert wird, wo Schuppentiere in der traditionellen chinesischen Medizin genutzt werden. So wurden im Jahr 2011 in Belgien wenigstens 100 Häute mit Schuppen des Weißbauchschuppentiers beschlagnahmt.[30] Aufgrund dieser drei Bedrohungen kam es in der Vergangenheit zu einem stark rückläufigen Bestand der Schuppentierart. Sie ist Schätzungen zufolge in Ruanda bereits ausgestorben. Berichten von Jägern zufolge, war in Nigeria bereits in den 1990er Jahren die Anzahl der Tiere rückläufig.[4] Seit dem Jahr 2000 ist der Handel mit dem Weißbauchschuppentier oder dessen Körperteilen gemäß dem Washingtoner Artenschutz-Übereinkommen (CITES) verboten, es unterliegt der zero annual export quota des CITES. Darüber hinaus übt die Lebensraumzerstörung durch Waldrodungen weiteren Druck auf die lokalen Bestände aus, was vor allem in Westafrika der Fall ist. Teilweise werden Tiere auch Opfer von Verkehrsunfällen.[31] Die IUCN listet die Art daher als „gefährdet“ (vulnerable). Das Weißbauchschuppentier ist in mehreren geschützten Gebieten präsent. Notwendig für die Erhaltung der Bestände sind die weitere Erforschung der Lebensweise der Schuppentierart und die Wirkung des Jagddrucks auf die einzelnen Populationen. Weiterhin erforderlich ist die Entwicklung nationaler Schutzstandards ebenso wie die Untersuchung der Wege im internationalen Handel.[32]
Literatur
- Phillipe Gaubert: Order Pholidota. In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 82–103 (S. 102–103)
- Jonathan Kingdon und Michael Hoffmann: Phataginus tricuspis Tree Pangolin (African White-bellied Pangolin). In: Jonathan Kingdom, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume V. Carnivores pangolins, equids and rhinoceroses. Bloomsbury, London, 2013, S. 391–395
- Ronald M. Nowak: Walker's Mammals of the World. Johns Hopkins University Press, 1999 ISBN 0-8018-5789-9
- Don E. Wilson, DeeAnn M. Reeder (Hrsg.): Mammal Species of the World. 3. Ausgabe. The Johns Hopkins University Press, Baltimore 2005, ISBN 0-8018-8221-4.
Einzelnachweise
- Phillipe Gaubert: Order Pholidota. In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 82–103 (S. 102–103)
- Jonathan Kingdon und Michael Hoffmann: Phataginus tricuspis Tree Pangolin (African White-bellied Pangolin). In: Jonathan Kingdom, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume V. Carnivores pangolins, equids and rhinoceroses. Bloomsbury, London, 2013, S. 391–395
- F. A. Jentink: Revision of the Manidae in the Leyden Museum. Notes from the Leyden Museum 4, 1882, S. 193–209
- Olufemi A. Sodeinde und Segun R. Adedipe: Pangolins in south-west Nigeria – current status and prognosis. Oryx 28 (1), 1994, S. 43–50
- Hugues A. Akpona, Chabi A. M. S. Djagoun und Brice Sinsin: Ecology and ethnozoology of the three-cusped pangolin Manis tricuspis (Mammalia, Pholidota) in the Lama forest reserve, Benin. Mammalia 72, 2008, S. 98–202
- U Rahm: Beobachtungen an den Schuppentieren Manis tricuspis und Manis longicaudata der Elfenbeinküste. Revue Suisse De Zoologie 62, 1955, S. 361–367
- Copper Aitken-Palmer, Thomas W. deMaar, James G. Johnson III, Jennifer Langan, Jonathan Bergmann, Sathya Chinnadurai, Hector Guerra, Deborah A. Carboni und Michael J. Adkesson: Complications associated with pregnancy and parturition in African White-bellied pangolins (Phataginus tricuspis). Journal of Zoo and Wildlife Medicine 50 (3), 2019, S. 678–687, doi:10.1638/2019-0019
- P. Henschel, L. T. B. Hunter, L. Coad, K. A. Abernethy und M. Mühlenberg: Leopard prey choice in the Congo Basin rainforest suggests exploitative competition with human bushmeat hunters. Journal of Zoology 285 (1), 2011, S. 11–20
- P. Henschel, K. A. Abernethy und L. J. T. White: Leopard food habits in the Lopé national park, Gabon, Central Africa. African Journal of Ecology 43, 2005, S. 21–28
- John A. Hart, M. Katembo und K. Punga: Diet, prey selection and ecological relations of leopard and golden cat in the Ituri forest, Zaire. African Journal of Ecology 34, 1996, S. 364–379
- Kay H. Farmer, Hannah M. Buchanan-Smith und Aliette Jamart: Behavioral Adaptation of Pan troglodytes troglodytes. International Journal of Primatolog, 27(3), 2006, S. 747–765
- André Aeschlimann: Observations sur la morphologie, la biologie et le développment d’Amblyomma compressum (Macalister, 1872) la tique des pangolins d’Afrique occidentale. Acta Tropica 20, 1963, S. 154–177
- Y. Ntiamoa-Baidu, C. Carr-Saunders, B.E. Matthews, P.M. Preston und A.R. Walker: Ticks associated with wild mammals in Ghana. Bulletin of Entomological Research 95, 2005, S. 205–219
- Miloslav Jirků, Jana Kvičerová, David Modrý und Václav Hypša: Evolutionary Plasticity in Coccidia – StrikingMorphological Similarity of Unrelated Coccidia(Apicomplexa) from Related Hosts: Eimeria spp.from African and Asian Pangolins (Mammalia:Pholidota). Protist 164, 2013, S. 470–481
- Philippe Gaubert, Agostinho Antunes, Hao Meng, Lin Miao, Stéphane Peigné, Fabienne Justy, Flobert Njiokou, Sylvain Dufour, Emmanuel Danquah, Jayanthi Alahakoon, Erik Verheyen, William T. Stanley, Stephen J. O’Brien, Warren E. Johnson und Shu-Jin Luo: The Complete Phylogeny of Pangolins: Scaling Up Resources for the Molecular Tracing of the Most Trafficked Mammals on Earth. Journal of Heredity 109, 2018, S. 347–359, doi:10.1093/jhered/esx097
- William J. Murphy, Eduardo Eizirik, Stephen J. O’Brien, Ole Madsen, Mark Scally, Christophe J. Douady, Emma Teeling, Oliver A. Ryder, Michael J. Stanhope, Wilfried W. de Jong und Mark S. Springer: Resolution of the Early Placental Mammal Radiation Using Bayesian Phylogenetics. Science 294, 2001, S. 2348–2351
- Timothy J. Gaudin, Robert J. Emry und John R. Wible: The Phylogeny of Living and Extinct Pangolins (Mammalia, Pholidota) and Associated Taxa: A Morphology Based Analysis. Journal of Mammalian Evolution 16, 2009, S. 235–305
- Don E. Wilson, DeeAnn M. Reeder (Hrsg.): Mammal Species of the World. 3. Ausgabe. The Johns Hopkins University Press, Baltimore 2005, ISBN 0-8018-8221-4 ()
- Malcolm C. McKenna und Susan K. Bell: Classification of mammals above the species level. Columbia University Press, New York, 1997, S. 1–631 (S. 221–222)
- Timothy J. Gaudin und John R. Wible: The entotympanic of pangolins and the phylogeny of the Pholidota. Journal of Mammalian Evolution 6 (1), 1999, S. 39–65
- Wighart von Koenigswald: Order Pholidota. In: Gertrud E. Rössner und Kurt Heissig: The Miocene land mammals of Europe. München, 1999, S. 75–79
- Glover Morrill Allen und Arthur Loveridge: Scientific results of a fourth expedition to forested areas in East and Central Africa. Bulletin of the Museum of Comparative Zoology 89 (4), 1942, S. 147–214
- Philippe Gaubert, Flobert Njiokou, Gabriel Ngua, Komlan Afiademanyo, Sylvain Dufour, Jean Malekani, Sery Gonedelé Bi, Christelle Tougard, Ayodeji Olayemi, Emmanuel Damquah, Chabi A. M. S. Djagoun, Prince Kaleme, Casimir Nebesse Mololo, William Stanley, Shu-Jin Luo und Agostinho Antunes: Phylogeography of the heavily poached African common pangolin (Pholidota, Manis tricuspis) reveals six cryptic lineages as traceable signatures of Pleistocene diversification. Molecular Ecology 25, 2016, S. 5975–5993
- Alexandre Hassanin, Jean-Pierre Hugot und Bettine Jansen van Vuuren: Comparison of mitochondrial genome sequences of pangolins (Mammalia, Pholidota). Comptes Rendus Biologies 338, 2015, S. 260–265
- Sérgio Ferreira-Cardoso, Guillaume Billet, Philippe Gaubert, Frédéric Delsuc und Lionel Hautier: Skull shape variation in extant pangolins (Pholidota: Manidae): allometric patterns and systematic, implications. Zoological Journal of the Linnean Society, 2019, doi:10.1093/zoolinnean/zlz096
- Constantine S. Rafinesque-Schmaltz: Sur le genre Manis et description d’une nouvelle espèce: Manis Ceonyx. Annales generales des sciences physiques 7, 1820 (1821), S. 214–215
- Durojaye A Soewu und Ibukun A Ayodele: Utilisation of Pangolin (Manis sps) in traditional Yorubic medicine in Ijebu province, Ogun State, Nigeria. Journal of Ethnobiology and Ethnomedicine 5, 2009, S. 39 ()
- Durojaye A Soewu und Temilolu A Adekanola: Traditional-Medical Knowledge and Perception of Pangolins (Manis sps) among the Awori People, Southwestern Nigeria. Journal of Ethnobiology and Ethnomedicine 7, 2011, S. 25 ()
- Maxwell K Boakye, Darren W Pietersen, Antoinette Kotzé, Desiré L Dalton und Raymond Jansen: Ethnomedicinal use of African pangolins by traditional medical practitioners in Sierra Leone. Journal of Ethnobiology and Ethnomedicine 10, 2014, S. 76
- Daniel W. S. Challender und Lisa Hywood: African pangolins under increased pressure from poaching and intercontinental trade. TRAFFIC Bulletin 24 (2), 2012, S. 53–55
- William F. Laurance, Barbara M. Croes, Nicaise Guissouegou, Ralph Buij, Marc Dethier und Alfonso Alonso: Impacts of Roads, Hunting, and Habitat Alteration on Nocturnal Mammals in African Rainforests. Conservation Biology 22 (3), 2008, S. 721–732
- C. Waterman, D. Pietersen, D. Soewu, L. Hywoodund P. Rankin: Phataginus tricuspis. The IUCN Red List of Threatened Species. Version 2014.3. (); zuletzt abgerufen am 19. Dezember 2014
Weblinks
- Phataginus tricuspis in der Roten Liste gefährdeter Arten der IUCN 2006. Eingestellt von: Pangolin Specialist Group, 1996. Abgerufen am 19. Dezember 2014.
- CITES: Appendices I, II and III, valid from 12 June 2013 (Schuppentiere (Pholidota) bei CITES)
- Informationen im Animal Diversity Web