Riesenschuppentier
Das Riesenschuppentier (Smutsia gigantea, teilweise auch Manis gigantea) ist eine Säugetierart aus der Familie der Schuppentiere (Manidae). Es ist der größte Vertreter dieser Gruppe. Das Verbreitungsgebiet umfasst das westliche und mittlere Afrika, wo die Tiere verschiedenste bewaldete Landschaften bewohnen. Sie leben einzelgängerisch und sind nachtaktiv. Zudem ist das Riesenschuppentier ein guter Bodengräber, der sehr kräftige Vordergliedmaßen besitzt und mitunter relativ lange, unterirdische Tunnel anlegt. Als Hauptnahrung dienen überwiegend staatenbildende Insekten. Die versteckte Lebensweise bedingt, dass es nur wenige Informationen über das genaue Verhalten gibt. Das Fleisch des Riesenschuppentiers wird vom Menschen zu Nahrungszwecken genutzt, teilweise werden der Schuppentierart auch Heilkräfte nachgesagt, sodass sie in einigen lokalen medizinischen Gebräuchen Verwendung findet. Der dadurch ausgelöste hohe Jagddruck hat zum Rückgang einzelner Bestände geführt. Aufgrund dessen gilt das Riesenschuppentier als bedroht.
| Riesenschuppentier | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Riesenschuppentier (Smutsia gigantea) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Smutsia gigantea | ||||||||||||
| (Illiger, 1815) |
Merkmale
Habitus
Das Riesenschuppentier ist der größte heute lebende Vertreter der Schuppentiere. Es erreicht eine Kopf-Rumpf-Länge von 67 bis 81 cm, der massig gebaute Schwanz wird 55 bis 70 cm lang. Der Schwanz ist damit etwas kürzer als der restliche Körper. Das Gewicht variiert zwischen 30 und 35 kg. Männliche Tiere sind in der Regel größer als weibliche. Die Oberseite des Kopfes, der Rücken und die Flanken, die Außenseiten der Gliedmaßen und der Schwanz sind wie bei allen Schuppentieren mit Hornschuppen bedeckt. Sie sind massiv gebaut, wobei die größten sich etwa in der Mitte des Rumpfes befinden, und drei nach hinten weisende Spitzen besitzen, die aber bei älteren Tieren häufig durch Abnutzung nicht mehr eindeutig zu erkennen sind. Die Färbung der Schuppen ist einheitlich und variiert von graubraun zu gelbbraun. Die Schuppen ordnen sich am Rumpf zu 15 bis 17 oder mehr quer verlaufenden Reihen. Über die Mitte des Rückens zieht eine einzelne Schuppenreihe. Diese bricht kurz vor dem Ende des Schwanzes ab. An der Schwanzseite befinden sich noch einmal jeweils 15 bis 19 scharfkantige Schuppen. Die Unterseite der Schwanzspitze ist vollständig mit Schuppen bedeckt. Am unbeschuppten Bauch wachsen sehr kurze, dicht stehende und hell gefärbte Haare und bedecken die fahl-gelbliche bis rosafarbene Haut, die übrigen schuppenfreien Körperpartien sind weitgehend unbehaart. Der Kopf ist konisch geformt und durch eine lang ausgezogene Schnauze charakterisiert. Die Nase weist etwa die gleiche Färbung wie die übrige Haut auf. Die Augen sind klein und mit einer dunklen Iris versehen. Sie werden von dicken, wulstartigen Augenlidern umgeben und können im wachen Zustand etwas herausgestülpt, in der Schlafphase oder in einer eingerollten Pose auch eingezogen werden. Die Ohren zeigen keine äußeren Haut- oder Knorpelwülste. Die Gliedmaßen sind allgemein kurz und kräftig, die Vorderbeine sind jedoch nicht ganz so kurz wie beim verwandten Steppenschuppentier und erreichen gut drei Viertel der Länge der Hinterbeine.[1] Vorder- und Hinterbeine enden in je fünf Zehen mit Krallen. An den Vorderfüßen sind die mittleren drei Krallen zu großen Grabkrallen umgestaltet, wobei die zentrale am kräftigsten und längsten ist. Die jeweils innere und äußere Kralle erscheinen dagegen sehr kurz und sind funktionslos. Die Krallen der Hinterfüße besitzen nur eine leicht gebogene Form und sind merklich kürzer als die der Vorderfüße.[2][3]
Schädel- und Skelettmerkmale
Der Schädel besitzt eine Länge von 13 bis 16 cm und ist sehr massiv gestaltet, was vor allem durch die sehr dichte Knochenstruktur erreicht wird. Die Wirbelsäule setzt sich aus 7 Hals-, 14 Brust-, 5 Lenden-, 4 Kreuzbein- und 23 bis 27 Schwanzwirbeln zusammen, sie umfasst somit 53 bis 57 Wirbel.[4] Das Becken ist kräftig gebaut und im Gegensatz zum Steppenschuppentier eher horizontal gelagert.[2][3]
Verbreitung und Lebensraum
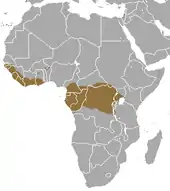
Das Riesenschuppentier kommt in West- und Zentralafrika vor. Dabei ist sein Verbreitungsgebiet zweigeteilt. In Westafrika umfasst es den Bereich vom südlichen Senegal ostwärts bis nach Ghana. Informationen aus Togo, Benin und Nigeria sind unsicher. In Zentralafrika reicht das Verbreitungsgebiet vom Ostufer des Flusses Sanaga in Kamerun quer durch das gesamte Kongobecken bis in das westlichste Kenia und Tansania sowie das nördlichste Angola (in der Exklave Cabinda). Darüber hinaus ist das Riesenschuppentier auf der Insel Bioko nachgewiesen. Es ist deutlich an Waldlandschaften wie tropische Regenwälder, Uferwälder oder Savanne-Wald-Mosaiklandschaften gebunden, deren Verbreitung auch seinen Lebensraum eingrenzen. Zudem kommt es in sekundären Offenlandschaften mit hohen Niederschlägen vor, es meidet aber von Menschen beeinflusste Landschaften. Meist bewohnt die Schuppentierart Tiefländer, in der Region von Itombwe im westlichen Verbreitungsgebiet kann sie auch in höheren Lagen angetroffen werden, wo weiche, zum Graben geeignete Böden ausgebildet sind. Im südlichen Buganda am Victoriasee wurde sie von höher gelegenen Hügellandschaften hinab bis in versumpfte, von Wald und Papyrus bestandene Täler beobachtet. Voraussetzung für die Anwesenheit des Riesenschuppentiers ist ein ausreichend großes Nahrungsangebot und genügend Wasser. Über die Populationsdichte ist wenig bekannt, sie ist aber ausgehend von der Größe der einzelnen Tiere und ihrer speziellen Ernährung wohl eher niedrig.[2][3][5]
Lebensweise
Territorialverhalten

Die Lebensweise des Riesenschuppentiers ist nur ungenügend untersucht. Es lebt einzelgängerisch als nachtaktiver Bodenbewohner. Dort bewegt es sich überwiegend vierfüßig fort mit meist waagerecht gehaltenem Schwanz. Die Hände stützt es dabei auf die Außenkanten, sodass die Krallen geschont werden, die Hinterfüße setzen mit der gesamten Sohle auf. In eine rein zweifüßige Fortbewegung nur auf den Hinterbeinen wechselt das Riesenschuppentier wesentlich seltener als dies vergleichsweise beim Steppenschuppentier (Smutsia temminckii) der Fall ist. Es ist außerdem ein schlechter Schwimmer, das Wasserflächen mit den Füßen paddelnd überquert, wobei sich der Körper – bis auf die Nase – vollständig unter Wasser befindet. Ebenso ist es ein schlechter Baumkletterer, da der Schwanz wenig beweglich ist und so das Tier beim Klettern kaum unterstützen kann. Die Hauptaktivitätszeit liegt zwischen Mitternacht und dem Morgengrauen, sie kann aber auch schon wesentlich früher beginnen. Tagsüber ruhen die Tiere in unterirdischen Erdbauen, in Gebüschen oder unter umgefallenen Bäumen. Die Erdbaue sind häufig selbst gegraben, teilweise nutzt das Riesenschuppentier aber auch solche des Erdferkels. Untersuchte Baue erreichen bis zu 40 m Länge, die Tunnel liegen dabei durchschnittlich 50 bis 60 cm unter der Erdoberfläche, die manchmal vergrößerte Kammer am Ende kann bis zu 5 m tief liegen. Häufig führen mehrere Eingänge in den Bau. Die einzelnen Tiere unterhalten Aktionsräume, die sie Untersuchungen zufolge wenigstens zwei Jahre nutzen. Über die individuelle Größe der einzelnen Streifgebiete liegen keine Informationen vor, es wird aber angenommen, dass sie aufgrund der zeitlich begrenzten Nutzung eher klein sind. Viel begangene Wege oder Kothaufen werden mit Sekreten aus den Analdrüsen markiert. Dadurch erfolgt der größte Teil der innerartlichen Kommunikation über den ausgesprochen gut entwickelten Geruchssinn. Da die Drüsen bei männlichen Tieren auffallend größer ausgebildet sind, kann eventuell von einer gewissen Territorialität ausgegangen werden.[2][3]
Ernährung
Die Nahrung des Riesenschuppentieres besteht vorwiegend aus staatenbildenden Insekten. Zur bevorzugten Beute gehören unter den Termiten Vertreter der Gattungen Macrotermes, Apicotermes, Pseudoacanthotermes und Protermes , aus der Gruppe der Ameisen zählen dazu Gattungen wie Palthothyreus und Anomma. Aufgrund dessen kann das Riesenschuppentier als strikt myrmecophag angesehen werden. Gelegentlich frisst es aber auch andere Insekten wie etwa Schwimmkäfer, die es mit seiner Zunge von der Wasseroberfläche sammelt. Die Nahrung sucht das Riesenschuppentier überwiegend am Boden und stöbert sie mit Hilfe des Geruchssinns auf. Die Insektenbaue oder verrottenden Baumstämme, in denen sich die bevorzugte Beute aufhält, bricht die Schuppentierart mit den großen Grabkrallen der Vorderfüße auf. Die extrem kräftige Armmuskulatur ermöglicht es ihr, auch sehr feste Insektenbaue aufzureißen. Die Beute verschlingt sie mit der langen, klebrigen Zunge, die bis zu 70 cm lang wird und bis zu 30 cm aus dem Maul herausgestreckt werden kann. Während der Nahrungssuche legen einzelne Tiere mehrere Kilometer zurück und fressen an rund einem Dutzend verschiedener Insektenbaue. Diese werden beim Fressen nicht vollständig zerstört, sondern mehrfach hintereinander besucht. Innerhalb eines Tages nimmt das Riesenschuppentier so bis zu 2 l Nahrung zu sich. Periodisch kommt es aber beim Riesenschuppentier zu einer Inaktivität, während der es keine Nahrung zu sich nimmt. Diese Phase kann mitunter sehr lang sein und wird als eine Art Sommerruhe (Ästivation) angesehen. Möglicherweise helfen gespeicherte Fettreserven, solche Zeiten von Nahrungsknappheit zu überwinden.[2][3]
Fortpflanzung
Über die Fortpflanzung ist wenig bekannt. Wahrscheinlich erfolgt sie ganzjährig, kann sich aber auch in bestimmten Regionen auf eine Jahreszeit konzentrieren. Es wird eine Tragzeit von rund fünf Monaten angenommen. Aus Uganda wurde von Geburten im September und Oktober berichtet. Das Weibchen bringt in der Regel ein einzelnes Jungtier zur Welt. Das Neugeborene erreicht eine Länge von bis zu 45 cm und wiegt über 500 g. Es ist relativ weit entwickelt und besitzt geöffnete Augen sowie weiche Schuppen, die erst nach einigen Tagen aushärten. Der Schwanz zeichnet sich durch eine außerordentlich hohe Beweglichkeit aus und das Junge verfügt über einen kräftigen Klammerreflex. Allerdings kann es noch nicht laufen und krabbelt mit ausgestreckten Beinen auf die Schwanzwurzel der Mutter. Nach etwa drei Monaten nimmt das Junge erste feste Nahrung zu sich. Mutter- und Jungtier bleiben in der Regel bis zur nächsten Geburt zusammen. Die Lebenserwartung in freier Wildbahn ist unbekannt.[2][3]
Fressfeinde und Feindverhalten
Unter den Fressfeinden ist besonders der Leopard hervorzuheben. Untersuchte Kotreste der Raubkatze im Lopé-Nationalpark geben aber nur einen geringen Anteil der Schuppentierart im gesamten Nahrungsspektrum an. Zudem wurden alle Tiere während der Regenzeit erbeutet.[6] Weitere potentielle Beutegreifer stellen der Nördliche Felsenpython und Krokodile dar. Bei Gefahr rollt sich ein Tier zu einer Kugel ein und bedeckt mit dem Schwanz unbeschuppte Körperteile. Es kann aber auch Schläge mit dem Schwanz oder mit den überaus kräftigen Krallen der Vorderfüße austeilen. Ein bedrängtes oder belästigtes Riesenschuppentier zischt laut.[2][3]
Systematik
Innere Systematik der Manidae nach Gaubert et al. 2018[7]
|
Das Riesenschuppentier ist eine Art aus der Gattung Smutsia. Innerhalb der Gattung ist das Steppenschuppentier (Smutsia temminckii) als nächster Verwandter anzusehen. Die beiden Arten trennten sich laut molekulargenetischen Analysen im Oberen Miozän vor etwa 9,8 Millionen Jahren. Smutsia vereint somit die beiden bodenbewohnenden Schuppentiere Afrikas. Außerdem stellt die Gattung das einzige Mitglied der Unterfamilie der Smutsiinae innerhalb der Familie der Schuppentiere (Manidae) dar. Als Schwestertaxon der Smutsiinae können die Phatagininae mit den beiden baumbewohnenden, afrikanischen Arten der Gattung Phataginus angesehen werden. Die asiatischen Schuppentiere, die zur Gattung Manis und zur Unterfamilie der Maninae gezählt werden, gehören dagegen einer entfernteren Verwandtschaftsgruppe an. Die Schuppentiere sind das gegenwärtig einzige Mitglied der somit monotypischen Ordnung der Pholidota. Zur weitläufigen Verwandtschaft der Ordnung zählen die Raubtiere (Carnivora), allerdings wurde die Beziehung zueinander erst durch genetische Untersuchungen ermittelt und abgesichert.[8][9][7]
Abseits der hier dargestellten systematischen Gliederung der Schuppentiere gibt es aber noch andere Ansätze. Einerseits wird die Gattung Manis, die hier die asiatischen Vertreter umfasst, häufig als einzige anerkannte Gattung der Schuppentiere angesehen, die anderen Gattungen einschließlich Smutsia besitzen dann den Status von Untergattungen.[10][2] Andererseits vertreten einige Forscher die Auffassung einer weitaus stärkeren Aufsplitterung der Schuppentiere. Dabei werden die afrikanischen Arten zu insgesamt drei Gattungen verwiesen. Smutsia schließt hier ebenfalls die bodenbewohnenden Schuppentiere ein, die baumlebenden werden dann aber in die Gattungen Phataginus (Weißbauchschuppentier) und Uromanis (Langschwanzschuppentier) aufgeteilt.[11] Die heute favorisierte Aufteilung der Familie der Schuppentiere in die drei Gattungen Manis, Phataginus und Smutsia wurde erstmals Ende der 1990er Jahre vorgeschlagen.[12][13] Nachfolgende anatomische und phylogenetische Studien untermauerten diese Ansicht.[9][7]
Es sind keine Unterarten des Riesenschuppentieres bekannt. Fossilbelege der Schuppentierart reichen bis in das Untere Pliozän vor rund 5 Millionen Jahren zurück, können wie bei allen Schuppentieren aber als rar angesehen werden. Herausragend ist der Fund eines Teilskelettes an der bedeutenden Fundstelle Langebaanweg im südwestlichen Südafrika, das bereits 1976 entdeckt worden war. Unter den erhaltenen Knochen finden sich unter anderem der Schädel, Teile des Bewegungsapparates und zudem mit insgesamt 21 erhaltenen Wirbeln der fast vollständige Schwanz, dessen Länge rekonstruiert rund 63 cm betrug. Das Skelett zeigt einige pathologische Veränderungen, doch kann es anhand der Beinproportionen und der Robustizität der Knochen mit dem Riesenschuppentier in Verbindung gebracht werden. Dieser frühe Vertreter war aber noch etwas kleiner als die heutigen Individuen, allerdings größer als das Steppenschuppentier. Neben dem Teilskelett barg die Fundstelle einzelne weitere Reste der Gliedmaßen.[1] Aus Uganda wurde wiederum der Fund einer vollständigen Speiche berichtet, die ein Alter zwischen 3,6 und 3,45 Millionen Jahren aufweist.[14]
Die wissenschaftliche Erstbeschreibung erfolgte im Jahr 1815 durch Johann Karl Wilhelm Illiger. Allerdings gab Illiger in seiner Publikation keine Typuslokalität an, sondern wies lediglich darauf hin, dass, das von ihm als Manis gigantea bezeichnete Riesenschuppentier auch „Guineisches Schuppenthier“ genannt wird. Darüber hinaus schloss er eine nähere Verwandtschaft mit dem Vorderindischen Schuppentier Manis crassicaudata aus.[15] Die heute gültige Gattungsbezeichnung Smutsia führte John Edward Gray im Jahr 1865 ein.[16]
Bedrohung
Wie andere Schuppentiere auch unterliegt das Riesenschuppentier einer starken Bejagung durch den Menschen. Dabei wird das Fleisch als Nahrungsressource genutzt, als exotische Spezialität (Bushmeat) kommt es auf lokale Märkte. Daneben werden die Tiere auch in örtlichen medizinischen Gebräuchen wie dem muti oder juju eingesetzt, da sie oder verschiedene Körperteile von ihnen als heilkräftig angesehen werden.[17] Im Jahr 2004 wurden so Untersuchungen zufolge allein auf fünf Märkten in Gabun Riesenschuppentiere mit einer Gesamtmenge von insgesamt 5 t gehandelt, was mehr als der doppelten Menge wie beim Weißbauchschuppentier im gleichen Zeitraum entspricht.[3] Experten nehmen zudem an, dass die gehandelte Menge an Riesenschuppentieren insgesamt rund 2 % der gesamten erlegten Biomasse einer Region ausmacht. Teilweise werden Riesenschuppentiere auch im internationalen Handel registriert, allerdings seltener als andere afrikanische Schuppentiere. Ziel dieser Exporte ist überwiegend Ost- und Südostasien, wo Schuppentiere allgemein für die Traditionelle Chinesische Medizin von Bedeutung sind. Teilweise verläuft der Handel auch über Europa. So wurde im Jahr 2008 ein Individuum in Paris von Behörden konfisziert,[18] 2012 wiederum Schuppen einer unbekannten Anzahl von Tieren in Belgien.[19] Das Riesenschuppentier unterliegt seit dem Jahr 2000 dem Washingtoner Artenschutz-Übereinkommen (CITES), jeglicher Handel mit der Schuppentierart oder deren Körperteilen ist verboten, wodurch die zero annual export quota des CITES gilt. Aufgrund der starken Bejagung wird von einem Populationsrückgang um 20 bis 25 % seit dem Ende der 1990er Jahre ausgegangen. Die geringe Individuendichte aber auch die geringe Reproduktionsrate und die terrestrische Lebensweise machen einzelne Bestände anfällig für Überjagung, in Ruanda ist das Riesenschuppentier möglicherweise bereits ausgestorben. Aufgrund dessen listet die IUCN die Art als „gefährdet“ (vulnerable). Sie ist in mehreren Naturschutzgebieten vertreten. Zur Bestandserhaltung sind weitere Untersuchungen zur Verbreitung der Art sowie zu Auswirkungen der intensiven Jagd erforderlich, ebenso wie zum Umfang des internationalen Handels. Zudem hat die Etablierung lokaler Schutzstandards Vorrang.[5]
Literatur
- Phillipe Gaubert: Order Pholidota. In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 82–103 (S. 99–100)
- Jonathan Kingdon, Michael Hoffmann und Reginald Hoyt: Smutsia gigantea Giant Pangolin. In: Jonathan Kingdom, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume V. Carnivores pangolins, equids and rhinoceroses. Bloomsbury, London, 2013, S. 396–399
- Ronald M. Nowak: Walker's Mammals of the World. Johns Hopkins University Press, 1999 ISBN 0-8018-5789-9
- Don E. Wilson, DeeAnn M. Reeder (Hrsg.): Mammal Species of the World. 3. Ausgabe. The Johns Hopkins University Press, Baltimore 2005, ISBN 0-8018-8221-4.
Einzelnachweise
- Jennifer Botha und Timothy Gaudin: An Early Pliocene pangolin (Mammalia; Pholidota) from Langebaahnweg, South Africa. Journal of Vertebrate Paleontology 27 (2), 2007, S. 484–491
- Phillipe Gaubert: Order Pholidota. In: Don E. Wilson und Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 2: Hooved Mammals. Lynx Edicions, Barcelona 2011, ISBN 978-84-96553-77-4, S. 82–103 (S. 99–100)
- Jonathan Kingdon, Michael Hoffmann und Reginald Hoyt: Smutsia gigantea Giant Pangolin. In: Jonathan Kingdom, David Happold, Michael Hoffmann, Thomas Butynski, Meredith Happold und Jan Kalina (Hrsg.): Mammals of Africa Volume V. Carnivores pangolins, equids and rhinoceroses. Bloomsbury, London, 2013, S. 396–399
- F. A. Jentink: Revision of the Manidae in the Leyden Museum. Notes from the Leyden Museum 4, 1882, S. 193–209
- C. Waterman, Darren W. Pietersen, L. Hywood, P. Rankin und D. Soewu: Smutsia gigantea. The IUCN Red List of Threatened Species. Version 2014.3. (); zuletzt abgerufen am 6. Januar 2015
- P. Henschel, K. A. Abernethy und L. J. T. White: Leopard food habits in the Lopé national park, Gabon, Central Africa. African Journal of Ecology 43, 2005, S. 21–28
- Philippe Gaubert, Agostinho Antunes, Hao Meng, Lin Miao, Stéphane Peigné, Fabienne Justy, Flobert Njiokou, Sylvain Dufour, Emmanuel Danquah, Jayanthi Alahakoon, Erik Verheyen, William T. Stanley, Stephen J. O’Brien, Warren E. Johnson und Shu-Jin Luo: The Complete Phylogeny of Pangolins: Scaling Up Resources for the Molecular Tracing of the Most Trafficked Mammals on Earth. Journal of Heredity 109, 2018, S. 347–359, doi:10.1093/jhered/esx097
- William J. Murphy, Eduardo Eizirik, Stephen J. O’Brien, Ole Madsen, Mark Scally, Christophe J. Douady, Emma Teeling, Oliver A. Ryder, Michael J. Stanhope, Wilfried W. de Jong und Mark S. Springer: Resolution of the Early Placental Mammal Radiation Using Bayesian Phylogenetics. Science 294, 2001, S. 2348–2351
- Timothy J. Gaudin, Robert J. Emry und John R. Wible: The Phylogeny of Living and Extinct Pangolins (Mammalia, Pholidota) and Associated Taxa: A Morphology Based Analysis. Journal of Mammalian Evolution 16, 2009, S. 235–305
- Don E. Wilson, DeeAnn M. Reeder (Hrsg.): Mammal Species of the World. 3. Ausgabe. The Johns Hopkins University Press, Baltimore 2005, ISBN 0-8018-8221-4 ()
- Malcolm C. McKenna und Susan K. Bell: Classification of mammals above the species level. Columbia University Press, New York, 1997, S. 1–631 (S. 221–222)
- Timothy J. Gaudin und John R. Wible: The entotympanic of pangolins and the phylogeny of the Pholidota. Journal of Mammalian Evolution 6 (1), 1999, S. 39–65
- Wighart von Koenigswald: Order Pholidota. In: Gertrud E. Rössner und Kurt Heissig: The Miocene land mammals of Europe. München, 1999, S. 75–79
- Timothy J. Gaudin: Pholidota. In: Lars Werdelin und William Joseph Sanders (Hrsg.): Cenozoic Mammals of Africa. University of California Press, Berkeley, London, New York, 2010, S. 599–602
- Johann Karl Wilhelm Illiger: Ueberblick der Säugethiere nach ihrer Vertheilung über die Welttheile. Abhandlungen der physikalischen Klasse der Königlich-Preußischen Akademie der Wissenschaften 1815, S. 39–159 (S. 84) ()
- John Edward Gray: Revision of the genera and species of entomophagous Edentata, founded on the examination of the specimens in the British Museum. Proceedings of the Zoological Society of London 1965, S. 359–386 (S. 360, 369) ()
- Amie Bräutigam, John Howes, Tamsien Humphreys und Jonathan Hutton: Recent information on the status and utilization of African pangolins. TRAFFIC Bulletin 15, 1994, S. 15–22
- Anne-Lise Chaber, Sophie Allebone-Webb, Yves Lignereux, Andrew A. Cunningham und J. Marcus Rowcliffe: The scale of illegal meat importation from Africa to Europe via Paris. Conservation Letters 3, 2010, S. 317–323
- Daniel W. S. Challender und Lisa Hywood: African pangolins under increased pressure from poaching and intercontinental trade. TRAFFIC Bulletin 24 (2), 2012, S. 53–55
Weblinks
- Smutsia gigantea in der Roten Liste gefährdeter Arten der IUCN 2006. Eingestellt von: Pangolin Specialist Group, 1996. Abgerufen am 6. Januar 2015.
- CITES: Appendices I, II and III, valid from 12 June 2013 (Schuppentiere (Pholidota) bei CITES)
- Informationen im Animal Diversity Web