Maleinsäure
Maleinsäure ist der Trivialname für cis-Butendisäure (auch cis-Ethylendicarbonsäure oder Toxilsäure genannt), eine Dicarbonsäure. Ihre Salze heißen Male(in)ate. Die isomere trans-Form heißt Fumarsäure.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
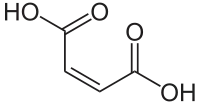 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Maleinsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C4H4O4 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes, kristallines Pulver mit schwach säuerlichem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 116,07 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Dichte |
1,59 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
1,9 und 6,5[4] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−789,4 kJ/mol[7] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte
Maleinsäure wurde erstmals im Jahre 1834 von Théophile-Jules Pelouze durch das Erhitzen von Äpfelsäure erhalten. Industriell zugänglich wurde die Verbindung ab 1919 durch die von der US-Firma Barrett Co. eingeführte katalytische Gasphasenoxidation von Benzol. Der Name „Maleinsäure“ leitet sich von der Äpfelsäure (Apfel = lat. „malum“) ab.[3]
1874 wurde die räumliche Struktur aus dem chemischen Verhalten – der Anhydridbildung – abgeleitet.
Gewinnung und Darstellung
Maleinsäure wird technisch durch Hydratisierung von Maleinsäureanhydrid bei Temperaturen von 65–85 °C hergestellt.[8]
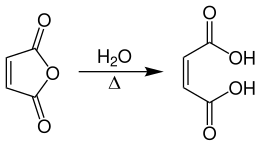
Man arbeitet kontinuierlich in einem Rührkesselreaktor und hält die Temperatur in einem konstanten Bereich. Dadurch kann die Bildung der isomeren Fumarsäure auf weniger als 0,1 % reduziert werden.[9]
Eigenschaften
Physikalische Eigenschaften
Maleinsäure bildet bei Raumtemperatur farblose Kristalle. Beim Erhitzen wird oberhalb von 135 °C eine Zersetzung beobachtet.[2] Sie ist in Wasser sehr gut löslich, wobei die Löslichkeit mit steigender Temperatur stark ansteigt.[3] Wässrige Lösungen der Verbindung sind stark sauer: die zweiprotonige Säure besitzt einen pKs1 von 1,9 und einen pKs2 von 6,5.[4]
| Löslichkeit von Maleinsäure in 100 g Wasser[3] | ||||||||||||
| Temperatur | in °C | 25 | 40 | 60 | 97,5 | |||||||
| Löslichkeit | in g pro 100 g | 78,9 | 112,3 | 148,8 | 392,6 | |||||||
Die molare Bildungsenthalpie beträgt −788,3 kJ·mol−1, die Verbrennungswärme −1358,9 kJ·mol−1.[3] Für die Wärmekapazität wurde bei 21 °C ein Wert von 135,6 J·mol−1·K−1 bzw. 1,17 J·g−1·K−1 bestimmt.[10]
Chemische Eigenschaften
Maleinsäure ist chemisch sehr reaktiv hinsichtlich von Reaktionen der Carbonylfunktionen sowie der Doppelbindung.[3] Beim Erhitzen auf Temperaturen oberhalb 100 °C geht sie unter Wasserabspaltung in Maleinsäureanhydrid über.[3] Das Anhydrid bildet beim Auflösen in Wasser dann wieder Maleinsäure. Bei weiterem Erhitzen und mittels Katalysatoren kann eine Decarboxylierung zur Acrylsäure erreicht werden. Bei längerem Erhitzen auf 150 °C sowie bei UV-Bestrahlung isomerisiert die Maleinsäure zur stabileren Fumarsäure. Mit Maleinsäure können alle typischen Carbonylreaktionen wie Veresterungen oder Aminierungen durchgeführt werden. Es wird allerdings kein Säurechlorid gebildet. Eine Addition von Wasser an die Doppelbindung bei erhöhter Temperatur und erhöhtem Druck ergibt die Äpfelsäure, die Addition von Halogenen Dihalogenbernsteinsäuren, eine katalytische Hydrierung die Bernsteinsäure. Durch die Umsetzung mit Ozon wird Glyoxylsäure erhalten.[3] Bei schnellem Erhitzen von Äpfelsäure auf 250 °C spaltet diese 2 Moleküle Wasser ab, wobei Maleinsäureanhydrid entsteht.[11]
Physiologische Eigenschaften
Maleinsäure und ihre Salze sind bei oraler Aufnahme höherer Dosen nierenschädigend.[12] Diese Eigenschaft wird beispielsweise im Tiermodell Farbratte genutzt, um die Symptome des De-Toni-Fanconi-Syndroms hervorzurufen.[13] Dabei werden gezielt die Proximalen Tubuluszellen geschädigt.[14] Die zur Induktion der Nierenfunktionsstörung notwendigen Dosen liegen im Bereich von 200 mg/kg KG bei intraperitonealer Gabe.[15]
Verwendung
Maleinsäure wird zur Herstellung von Polymeren, Kunstharzen und Maleinsäureestern, zur Veredelung und beim Färben von Baumwolle sowie als Inhaltsstoff von Entkalkungsmitteln auf der Basis von Amidosulfonsäure oder Citronensäure eingesetzt, welcher einer schnellen Wiederverkalkung entgegenwirken soll.
In der Pharmakologie dienen Lösungen der Maleate von Antihistaminen als injizierbare Medikamente für den akuten Einsatz. In der präparativen Chemie wird Maleinsäure häufig als Agens für Diels-Alder-Reaktion benutzt.
In der Zahnmedizin wird Maleinsäure in selbstätzenden Adhäsivsystemen verwendet, um Dentin zu konditionieren.
Maleat: Verwechslungsgefahr mit Malonat und Malat
Maleat darf nicht mit dem Säureanion der Äpfelsäure, dem Malat-Ion, oder dem Anion der Malonsäure, dem Malonat verwechselt werden.[16]
Weblinks
Einzelnachweise
- Eintrag zu MALEIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Maleinsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- K. Lohbeck, H. Haferkorn, W. Fuhrmann, N. Fedke: Maleic and Fumaric Acids. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim, 2012, doi:10.1002/14356007.a16_053.
- A. Reichert: Potentiometrische Titrationen in Theorie und Praxis. (Memento vom 1. April 2007 im Internet Archive)
- Eintrag zu Maleinsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 31. Januar 2019.
- Eintrag zu Maleic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- Patent EP0864558A1: Process for producing maleic acid. Veröffentlicht am 16. September 1998, Anmelder: The Procter & Gamble Company, Erfinder: Christian Dethloff, Barbarino, Sergio.
- Timothy R. Felthouse, Joseph C. Burnett, Ben Horrell, Michael J. Mummey, Yeong‐Jen Kuo: Maleic Anhydride, Maleic Acid, and Fumaric Acid. In: Kirk-Othmer Encyclopedia of Chemical Technology. Wiley‐VCH Verlag GmbH & Co. KGaA., 18. Oktober 2001, S. 9, doi:10.1002/0471238961.1301120506051220.a01.pub2.
- Parks, G.S.; Huffman, H.M.: Thermal data on organic compounds. IX. A study of the effect of unsaturation on the heat capacities, entropies and free energies of some hydrocarbons and other compounds in J. Am. Chem. Soc. 52 (1930) 4381–4391, doi:10.1021/ja01374a029.
- Beyer-Walter: Lehrbuch der Organischen Chemie, 23. Auflage, S. 356, S. Hirzel Verlag 1998. ISBN 3-7776-0808-4.
- R. M. Everett, G. Descotes u. a.: Nephrotoxicity of pravadoline maleate (WIN 48098-6) in dogs: evidence of maleic acid-induced acute tubular necrosis. In: Fundamental and applied toxicology : official journal of the Society of Toxicology. Band 21, Nummer 1, Juli 1993, S. 59–65. PMID 8365586.
- Cosmetic Ingredient Review Expert Panel: Final report on the safety assessment of Maleic Acid. In: International journal of toxicology. Band 26 Suppl 2, 2007, S. 125–130, doi:10.1080/10915810701351251. PMID 17613135 (Review).
- R. A. Zager, A. C. Johnson u. a.: Maleate nephrotoxicity: mechanisms of injury and correlates with ischemic/hypoxic tubular cell death. In: American Journal of Physiology - Renal physiology. Band 294, Nummer 1, Januar 2008, S. F187–F197, doi:10.1152/ajprenal.00434.2007. PMID 17942567.
- W. Pfaller, G. Gstraunsthaler, P. Kontanko: Nephrotoxizität: Morphologie – Funktionsbeziehung. In: Walter G. Guder, Hermann Lang (Hrsg.): Pathobiochemie und Funktionsdiagnostik der Niere. Springer-Verlag, 2013, ISBN 978-3-642-84384-6, S. 92 (eingeschränkte Vorschau in der Google-Buchsuche).
- William B. Jensen: The Origin of the Names Malic, Maleic, and Malonic Acid. In: J. Chem. Educ. 84, 2007, S. 924, doi:10.1021/ed084p924.

