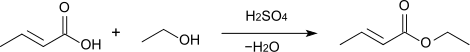Crotonsäure
Crotonsäure, auch trans-Butensäure genannt, ist eine kurzkettige, einfach ungesättigte trans-Fettsäure, eine Monocarbonsäure in der Gruppe der Alkensäuren. Die Crotonsäure verdankt ihren Namen dem Crotonöl, es wurde fälschlicherweise angenommen, dass Crotonsäure durch Verseifung von Crotonöl entsteht. Crotonsäure bildet nadelförmige Kristalle. Das cis-Isomere der Crotonsäure wird Isocrotonsäure genannt. Die Salze und Ester der Crotonsäure werden als Crotonate bezeichnet.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
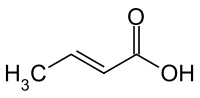 | ||||||||||||||||||||||
| trans-Crotonsäure | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Crotonsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C4H6O2 | |||||||||||||||||||||
| Kurzbeschreibung |
weiße bis gelbliche Kristallnadeln mit scharfem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 86,09 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,02 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
185 °C[2] | |||||||||||||||||||||
| pKS-Wert |
4,69[3] | |||||||||||||||||||||
| Löslichkeit |
schwer in Wasser (6,2 g·l−1 bei 20 °C)[1] | |||||||||||||||||||||
| Brechungsindex |
1,4249 (77 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Gewinnung und Darstellung
Crotonsäure kann durch Oxidation von Crotonaldehyd gewonnen werden.[6]
![]()
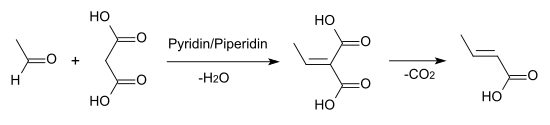
Auch durch Knoevenagel-Kondensation von Acetaldehyd mit Malonsäure in Pyridinlösung entsteht Crotonsäure.[6]
Bei der alkalischen Hydrolyse von Allylcyanid entsteht nach einer intramolekularen Umlagerung der Doppelbindung ebenfalls Crotonsäure.[7][8]
![]()
Crotonsäure entsteht auch bei der Destillation von 3-Hydroxybutansäure.[9]
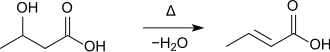
Eigenschaften
Crotonsäure kristallisiert in langen Kristallnadeln oder auch als große Tafeln im monoklinen Kristallsystem in der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3) mit den Gitterparametern a = 971 pm, b = 690 pm, c = 775 pm und β = 104,0°. In der Elementarzelle befinden sich vier Formeleinheiten.[10] Die Verbindung ist löslich in Wasser und vielen organischen Lösungsmitteln wie Ethanol, Aceton oder Toluol. Sie hat einen mit Buttersäure vergleichbaren Geruch und reizt Augen, Haut und Atmungsorgane.[5]
Reaktionen
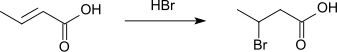
Crotonsäure kann durch Hydrierung mit Zink und Schwefelsäure zu Buttersäure umgewandelt werden.[3]
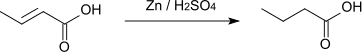
Mit elementarem Chlor bzw. Brom bilden sich die entsprechenden 2,3-Dihalogenbutansäuren.[3]
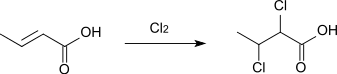
Bei der elektrophilen Addition von Bromwasserstoff bildet sich 3-Brombutansäure.[11][3] Die Substitutionsrichtung ergibt sich aus dem elektronenziehenden Effekt der Carboxygruppe, der zur Folge hat, dass an der Position 3 das stabilere Carbeniumion entsteht, an das sich das Brom anlagert.
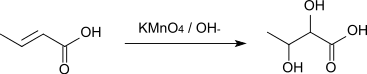
Die Reaktion von Crotonsäure mit alkalischer Kaliumpermanganatlösung ergibt 2,3-Dihydroxybutansäure.[3]
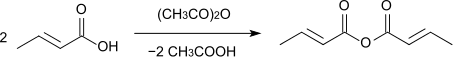
Durch Kochen mit Essigsäureanhydrid entsteht Crotonsäureanhydrid,[12] dessen Siedepunkt bei 248 °C liegt.[13]
Die Veresterung von Crotonsäure mit Methanol bzw. Ethanol mit Schwefelsäure als Katalysator liefert die entsprechenden Ester, deren Siedepunkte bei 118–120 °C (Methylcrotonat)[14] bzw. 142–143 °C (Ethylcrotonat)[15] liegen.
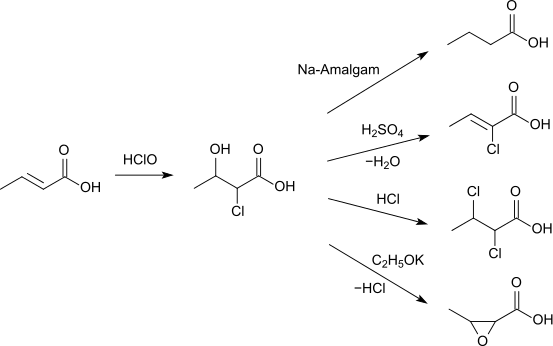
Crotonsäure reagiert mit Hypochloriger Säure zu 2-Chlor-3-Hydroxybutansäure, welche mit Natriumamalgam zur Buttersäure reduziert wird, mit Schwefelsäure 2-Chlorcrotonsäure bildet, sich mit Chlorwasserstoff zu 2,3-Dichlorbuttersäure verbindet, sowie mit Kaliumethanolat zur 3-Methyloxiran-2-carbonsäure umgesetzt wird.[16]
Verwendung
Crotonsäure wird zur Herstellung von Retinol und DL-Threonin[17] verwendet. Für die Kunststoffherstellung kann sie mit Vinylacetat copolymerisiert werden.[5]
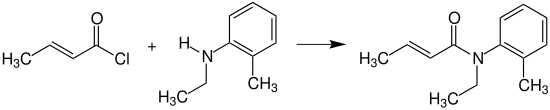
Crotonsäurechlorid reagiert mit N-Ethyl-2-methylanilin (N-Ethyl-o-toluidin) zum N-Ethyl-o-crotonotoluidin (INN: Crotamiton), das als Mittel gegen Krätzemilben (Skabies) eingesetzt wird.[18]
Siehe auch
Einzelnachweise
- Eintrag zu Crotonsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 978-0-911910-00-1, S. 436.
- Ian Heilbron, H. M. Bunbury: Dictionary of organic compounds. Volume One, 1953, S. 615, archive.org.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-74.
- Eintrag zu Butensäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. März 2014.
- Hans Beyer und Wolfgang Walter: Organische Chemie. S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2, S. 229 f.
- A. Rinne, B. Tollens: Ueber das Allylcyanür oder Crotonitril. In: Justus Liebigs Annalen der Chemie. 159(1), 1871, S. 105–109; doi:10.1002/jlac.18711590110.
- C. Pomeranz: Ueber Allylcyanid und Allylsenföl. In: Justus Liebigs Annalen der Chemie. 351, 1907, S. 354–362, doi:10.1002/jlac.19073510127.
- F. Beilstein: Handbuch der organischen Chemie. 3. Auflage. 1. Band. Verlag Leopold Voss, 1893, S. 506 f, archive.org.
- Shozo Shimizu, Shinji Kekka, Setsuo Kashino, Masao Haisa: Topochemical Studies. III. The Crystal and Molecular Structures of Crotonic Acid, CH3CH=CHCOOH, and Crotonamide, CH3CH=CHCONH2. In: Bulletin of the Chemical Society of Japan. Band 47, Nr. 7, 1974, S. 1627–1631, doi:10.1246/bcsj.47.1627.
- J. M. Lovén, H. Johansson: Einige schwefelhaltige β-Substitutionsderivate der Buttersäure. In: Berichte der deutschen chemischen Gesellschaft. 48(2), 1915, S. 1254–1262, doi:10.1002/cber.19150480205.
- A. M. Clover, G. F. Richmond: The Hydrolysis of Organic Peroxides and Peracids. In: American Chemical Journal. 29(3), 1903, S. 179–203, archive.org.
- Datenblatt Crotonic anhydride bei Sigma-Aldrich, abgerufen am 4. Juni 2011 (PDF).
- Datenblatt Methyl crotonate bei Sigma-Aldrich, abgerufen am 4. Juni 2011 (PDF).
- Eintrag zu CAS-Nr. 623-70-1 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Juni 2011. (JavaScript erforderlich)
- F. Beilstein: Handbuch der organischen Chemie. 3. Auflage. 1. Band. Verlag Leopold Voss, 1893, S. 562, archive.org.
- H. E. Carter, H. D. West: dl-Threonine In: Organic Syntheses. 20, 1940, S. 101, doi:10.15227/orgsyn.020.0101; Coll. Vol. 3, 1955, S. 813 (PDF).
- A. Kleemann, J. Engel: Pharmazeutische Wirkstoffe: Synthesen, Patente, Anwendungen. Band 5, 2. Aufl., Thieme Verlag Stuttgart / New York 1982, ISBN 3-13-558402-X, S. 251.