Klatskintumor
Ein Klatskintumor ist ein seltener bösartiger Tumor der Gallengänge (Cholangiokarzinom) in der Leberpforte (Hilus). Er liegt typischerweise im Bereich der Vereinigung des rechten und linken Lebergangs zum Ductus hepaticus communis. Gallengangskarzinome in der Leberpforte werden synonym auch hiläre oder perihiläre Cholangiokarzinome genannt. Benannt ist der Tumor nach dem US-amerikanischen Gastroenterologen Gerald Klatskin, der ihn 1965 beschrieb.
| Klassifikation nach ICD-10 | |
|---|---|
| C24.0[1] | Bösartige Neubildung extrahepatischer Gallengang |
| ICD-10 online (WHO-Version 2019) | |
Die Erkrankung verursacht anfangs eher unspezifische Symptome wie Gewichtsverlust und Abgeschlagenheit. Im Verlauf kommt es durch das Tumorwachstum häufig zu einer Verengung und dann zum Verschluss des Gallengangs, wodurch sich die Galle aufstaut. Die Folge ist eine Gelbsucht (Verschlussikterus). Der Tumor wächst früh entlang der Gallengänge in die Leber und in nahe gelegene Lymphknoten ein. Die Überlebensaussichten sind im Durchschnitt schlecht, die Hälfte aller Erkrankten stirbt innerhalb eines Jahres nach Diagnosestellung, meistens an Leberversagen oder bakteriellen Entzündungen der Gallengänge. In frühen Stadien kann der Tumor chirurgisch mit Aussicht auf Heilung entfernt werden. In fortgeschrittenen Stadien ist eine lebensverlängernde Chemotherapie möglich. Eine aufgestaute Galle kann abgeleitet werden, indem kleine Röhrchen (Stents) in die verengten Gallengänge gelegt werden. In der Forschung wird an verschiedenen Strategien gearbeitet, um die Therapie von Klatskintumoren zu verbessern, insbesondere an photodynamischer Therapie, molekular gezielten Therapien und Immuntherapien.
Begriff und Forschungsgeschichte
Benannt ist die Erkrankung nach dem US-Amerikaner Gerald Klatskin (1910–1986). Dieser wirkte als Gastroenterologe und Professor für Innere Medizin im Bundesstaat Connecticut. Dort machte ihn der Pathologe Raymond Yesner 1948 auf ein kleines Adenokarzinom aufmerksam, das im Leberhilus am Zusammenfluss des rechten und linken Lebergangs wuchs. Klatskin sammelte und dokumentierte insgesamt 13 Fälle, die zwischen 1947 und 1963 aufgetreten waren, und publizierte die Fallsammlung 1965. Er war damit nicht der Entdecker hilärer Gallengangskarzinome. Klatskin selbst nannte früher erschienene Fallbeschreibungen mit wenigen Patienten, die früheste von 1957 mit drei Patienten. Allerdings war Klatskins Veröffentlichung die ausführlichste und wurde zur Standard-Publikation in diesem Bereich. Ab den späten 1970er-Jahren setzte sich der Begriff „Klatskin-Tumor“ durch.[2] Der Begriff wird in der aktuellen Forschungsliteratur weitgehend als Synonym zu hilären/perihilären Gallengangskarzinomen verwendet.
Epidemiologie
Cholangiokarzinome sind vergleichsweise selten und machen rund 1 % aller Krebserkrankungen in Deutschland aus.[3] Ungefähr die Hälfte[4] bis zwei Drittel[5] davon treten als Klatskintumore auf. Die Erkrankung tritt mit zunehmendem Alter häufiger auf, in der Literatur wird der Erkrankungsgipfel zwischen 50 und 70 Jahren beschrieben. Patienten mit primär sklerosierender Cholangitis, einer Erkrankung, aus der häufiger ein Cholangiokarzinom entsteht, erkranken im Mittel etwa 20 Jahre früher.[5] In Deutschland ist ein großer Teil der Patienten bei der Erstdiagnose über 70 Jahre alt. Männer sind etwas häufiger betroffen als Frauen. Weltweit unterscheidet sich die Häufigkeit von Klatskintumoren nur gering, anders als bei anderen Entstehungsorten des Cholangiokarzinoms.[3]
Risikofaktoren
Bei den meisten Erkrankten kann kein vorbestehender Risikofaktor festgestellt werden, hier entsteht die Krankheit „spontan“. Die bekannten Risikofaktoren gehen mit einer chronischen Entzündung der Gallenwege einher, was die Ursache der folgenden Entartung normaler Zellen zu Krebszellen ist.[6]
Ein bedeutsamer Risikofaktor für die Entstehung eines Klatskintumors ist die Primär sklerosierende Cholangitis (PSC), eine seltene Gallenwegserkrankung. 10–20 % aller PSC-Patienten entwickeln mit der Zeit ein Cholangiokarzinom. Umgekehrt waren bis zu 30 % aller Cholangiokarzinom-Patienten vorher an Primär sklerosierender Cholangitis erkrankt. Der Einfluss von Alkohol- und Zigarettenkonsum ist ungeklärt. Ein ebenfalls relevanter Risikofaktor sind Gallensteine. Die Infektion mit Leberegeln führt eher zu Cholangiokarzinomen in der Leber, weniger zu Krebserkrankungen der außerhalb liegenden Gallenwege. Angeborene Zysten der Gallenwege, wie sie beim Caroli-Syndrom auftreten, gelten ebenso als Risikofaktoren für die Entstehung eines Cholangiokarzinoms, wobei der Mechanismus hier unklar ist. Mehrere monogene Erkrankungen erhöhen das Risiko für Klatskintumoren ebenfalls, darunter das hereditäre nichtpolypöse kolorektale Karzinom (HNPCC bzw. Lynch-Syndrom) und die Mukoviszidose (Cystische Fibrose).[5]
Thorotrast, ein 1929 eingeführtes Röntgenkontrastmittel, kann ebenfalls die Entstehung eines Klatskintumors begünstigen. Thorotrast wurde zwar schon 1950 vom Markt genommen, dennoch kann es noch Jahrzehnte nach Verabreichung nachgewiesen werden. Entsteht der Tumor in diesem Zusammenhang, dauert es von Verabreichung des Mittels bis zum Krankheitsausbruch mehr als 30 Jahre.[7]
Entstehung, Wachstum und Krankheitsverlauf
Klatskintumore entstehen durch maligne Entartung des auskleidenden Epithels der Gallengänge. Wahrscheinlich geschieht dies ähnlich wie bei Darmkrebs in einem mehrschrittigen Prozess mit Zwischenstufen – Dysplasien und Neoplasien.[3] Die Zeit vom Auftreten einer Dysplasie bis zur Entwicklung eines Karzinoms wird auf 15 Jahre geschätzt. Unterschieden wird hierbei der diffus infiltrierende Typ und ein polypöser Typ. Beide Wachstumsmuster können zur gleichen Zeit vorkommen. Der polypös wachsende Tumor infiltriert anfänglich die Wand sowie das angrenzende Bindegewebe.[7] Klatskintumoren breiten sich vor allem entlang der Gallenwege sowie durch die örtlichen Lymphgefäße aus. Typischerweise wachsen sie über diese natürlichen Strukturen in die Leber ein sowie in den nächstgelegenen Lymphknoten im Leberhilus und im Ligamentum hepatoduodenale. Es ist auch möglich, dass sich der Krebs entlang der Lymphknotenstationen des Magens entlang der kleinen Magenkurvatur ausbreitet. Eine Ausbreitung in weiter entfernte Organe wie Lunge, Brustfell, Hirn oder Knochen ist selten.[8] Wegen der ungünstigen Lage und der Aggressivität des Tumors bekommen die Patienten die Diagnose oft in einem nicht mehr kurativ angehbaren Stadium. In den allermeisten Fällen handelt es sich um einen Zufallsbefund. 50 % der Betroffenen haben zum Zeitpunkt der Diagnose bereits Lymphknotenmetastasen.[9] In Deutschland stirbt etwa die Hälfte der Patienten mit Cholangiokarzinomen außerhalb der Leber (in diese Kategorie fallen Klatskintumoren) innerhalb eines Jahres nach Diagnosestellung. Insgesamt leben nach 5 Jahren noch 15 bis 17 % der Erkrankten.[3] Patienten, die in einem frühen Stadium diagnostiziert werden und noch operiert werden können, haben bessere Aussichten. International werden 5-Jahres-Überlebensraten von 20 bis 40 % berichtet.[10] Die Erkrankten sterben meistens an wiederkehrenden bakteriellen Entzündungen der Gallenwege (Cholangitis) durch den Gallestau oder an Leberversagen durch die Durchsetzung des Organs mit Krebsmetastasen.[11]
Symptome

Klatskintumoren verursachen lange keine Beschwerden. Zu den unspezifischen Allgemeinsymptomen gehören ein allgemeines Schwächegefühl oder Leistungsabfall, Gewichtsverlust, Nachtschweiß und Fieber. Häufig ist auch ein Druckgefühl im rechten Oberbauch. Spezifische Symptome verursachen Klatskintumoren dann, wenn sie die Gallenwege verschließen (Obstruktion). Dann kann die von der Leber produzierte Gallenflüssigkeit nicht mehr abfließen, wodurch sie sich aufstaut. Durch den Stau sammeln sich im Körper die Stoffe an, die eigentlich mit der Galle ausgeschieden werden. Auffällig ist das Bilirubin, ein Abbauprodukt des roten Blutfarbstoffs Hämoglobin, das sich in der Haut ablagert und sie gelb färbt – ein Ikterus (Gelbsucht). Ein Ikterus durch Verschluss der Gallenwege heißt Verschlussikterus. Zum Ikterus gehört häufig ein Juckreiz, außerdem wird ein Teil des Bilirubins über die Nieren in den Urin ausgeschieden, wodurch dieser sich dunkel färbt. Eine weitere Folge der Abflussbehinderung ist ein heller, fettreicher Stuhlgang (Fettstuhl), weil das in der Nahrung enthaltene Fett ohne Gallensäuren im Darm nicht aufgenommen werden kann.[8]
Diagnostik und Stadienbestimmung
Labordiagnostik
Das Karzinom kann nicht allein anhand von Laborwerten diagnostiziert werden. Es gibt allerdings typische Laborbefunde. Die Obstruktion der Gallenwege führt häufig zu einem Anstieg der sogenannten Cholestaseparameter: Bilirubin, Gamma-GT und AP. Bilirubin ist der „Gallenfarbstoff“, Gamma-GT und AP zeigen eine Schädigung der Gallengänge an. Eine längere Gallenstauung kann auch das Lebergewebe schädigen. Diese Schädigung lässt sich an der Erhöhung der „Leberenzyme“ ALAT (GPT) und ASAT (GOT) ablesen. Meistens sind die Leberenzyme bei der Erstdiagnose noch unauffällig. Die Tumormarker CA 19-9 und CEA können erhöht sein und zur Verlaufsbeobachtung genutzt werden. CA 19-9 wird oft bei Patienten mit primärer biliärer Zirrhose als Screening-Instrument genutzt.[8] Die Bestimmung der Serumspiegel von Interleukin-6, Trypsinogen, Muzin-5AC, CYFRA21-1 und das Thrombozyten-Lymphozyten-Verhältnis können zur Diagnostik eines Cholangiokarzinoms beitragen.[12]
Bildgebung
Das zuerst durchgeführte bildgebende Verfahren ist in der Regel die Ultraschalluntersuchung des Bauches. Sie eignet sich vor allem zur Erkennung gutartiger Ursachen der Symptome (wie z. B. Gallensteine) und zur Darstellung erweiterter Gallenwege bei der Cholestase. Auch Tumoren bzw. Metastasen im Lebergewebe sind im Ultraschall häufig zu erkennen. Der Klatskintumor kann unter Umständen so erkannt werden. Generell eignet sich Ultraschall aber nicht zur sicheren Darstellung des Tumors und zur Ausbreitungsbestimmung. Die Untersuchung der Wahl dafür ist die Computertomographie (CT) mit Kontrastmittel von Brustkorb und Bauch. Hier kann die Lage und Ausbreitung des Tumors bestimmt werden und dazu, ob bereits Lymphknoten befallen sind und ob der Tumor benachbarte Blutgefäße wie die Pfortader ummauert oder in sie einwächst. Zur Planung der Operation können hier auch die Lebergefäße dargestellt und die Größe der Lebersegmente und das verbleibende Lebervolumen berechnet werden. Die Untersuchung ist ein wichtiger Teil der Stadienbestimmung. Ergänzend kann eine Magnetresonanztomographie (MRT) mit Kontrastmittel zur besseren Darstellung der Gallenwege und des Tumors durchgeführt werden. Die sonst bei Erkrankungen der Gallenwege häufig eingesetzte ERCP, eine invasive Methode zur Darstellung der Gallenwege mit der Möglichkeit zur Intervention, wird bei Verdacht auf Klatskintumoren zurückhaltend eingesetzt, da hier das Risiko für eine bakterielle Cholangitis deutlich erhöht ist. Alternativ bietet sich die nicht-invasive MRCP an. Die ERCP kommt vor allem bei unklaren Fällen zum Einsatz, um mit einer kleinen Bürste Zellen aus dem verdächtigen Gangabschnitt zu gewinnen (Biopsie). Diese können bei der Diagnose den Weg weisen. Die ERCP ermöglicht auch therapeutisch die Einlage von Stents zur Entlastung der Cholestase.[3][8][13]
Differentialdiagnosen
Aufgrund der sehr unspezifischen möglichen Symptome wie Gewichtsverlust, Schwäche, Schmerzen im rechten Oberbauch und Gelbsucht müssen Klatskintumoren von zahlreichen anderen Erkrankungen abgegrenzt werden, darunter sind verschiedene Krebserkrankungen, aber auch gutartige Ursachen. Insbesondere wenn die Konstellation aus Beschwerden und Laborbefunden auf eine Cholestase hinweist, erhalten Patienten eine Sonografie des Bauches. Hier kann der Zustand der Gallenwege beurteilt werden. Ein Verschlussikterus mit erweiterten Gallenwegen grenzt das Spektrum möglicher Ursachen deutlich ein: Häufig sind Gallensteine dafür verantwortlich, nach denen in der gleichen Untersuchung gesucht werden kann. Sind es keine Gallensteine, können auch gutartige Veränderungen (Strikturen) der Gallenwege die Befunde erklären. Andere Tumoren, die ähnliche Beschwerden wie Klatskintumoren verursachen können, sind andere Formen des Cholangiokarzinoms (wie distale Cholangiokarzinome), Geschwulste im Kopf der Bauchspeicheldrüse (Pankreastumor) und Tumoren der Vaterschen Papille, wo der Gallengang in den Dünndarm mündet. Auch Metastasen entfernter Tumoren können die Gallenwege komprimieren.[14]
Klassifikation und Stadien
Bismuth-Corlette-Klassifikation
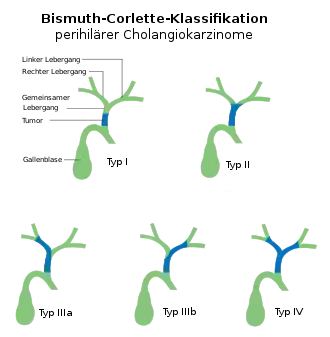
Die Bismuth-Corlette-Klassifikation dient der Abschätzung der Operabilität hilärer Gallengangskarzinome.[3] Klatskintumoren im engeren Sinne entsprechen den Typen II bis IV.
- Typ I: Karzinom betrifft Ductus hepaticus communis ohne Hepatikusgabel.
- Typ II: Karzinom beteiligt auch Hepatikusgabel.
- Typ III: Der Tumor reicht auf einer Seite (Typ IIIa rechts, Typ IIIb links) bis an die Segmentabgänge heran.
- Typ IV: Die sekundären Zusammenflüsse rechts und links sind betroffen. Eine kurative Resektion ist schwierig oder nicht möglich.[15]
Stadieneinteilung nach UICC
Die Stadieneinteilung folgt der UICC-Klassifikation, die 2016 in der 8. Auflage erschien. Zur Bestimmung des Stadiums wird zunächst der TNM-Status erhoben. Das steht für:
- T: örtliche Ausbreitung des Tumors
- N: Befall örtlicher (regionärer) Lymphknoten. Bei Klatskintumoren sind das Lymphknoten im Leberhilus sowie neben dem Gallenhauptgang im Ligamentum hepatoduodenale.
- M: Fernmetastasen. Bei Klatskintumoren werden auch Lymphknotenmetastasen jenseits des Ligamentum hepatoduodenale als Fernmetastasen gerechnet.
| Tis | Carcinoma in situ |
| T1 | Tumor auf Gallengang beschränkt mit Ausdehnung bis in die muskuläre Wandschicht oder fibröse Schicht. |
| T2a | Tumor infiltriert jenseits des Gallengangs in das benachbarte Weichgewebe |
| T2b | Tumor infiltriert das benachbarte Leberparenchym |
| T3 | Tumor infiltriert unilaterale Äste der V. portae oder A. hepatica |
| T4 | Tumor infiltriert den Hauptast der V. portae oder bilaterale Äste; oder die A. hepatica communis oder Äste 2. Ordnung bilateral; oder unilaterale Äste 2. Ordnung des Gallengangs mit Infiltration von kontralateralen Ästen der V. portae oder A. hepatica |
| N0 | Keine Metastasen in den regionären Lymphknoten |
| N1 | Metastasen in 1–3 regionären Lymphknoten |
| N2 | Metastasen in 4 oder mehr regionären Lymphknoten |
| M0 | Keine Fernmetastasen |
| M1 | Fernmetastasen, dazu zählen auch Lymphknotenmetastasen jenseits des Ligamentum hepatoduodenale |
Anhand des TNM-Status kann das Krankheitsstadium bestimmt werden. Die Stadieneinteilung macht eine Abschätzung der Prognose möglich und spielt eine Rolle für die Therapie.
| Stadium | T | N | M |
|---|---|---|---|
| 0 | is | 0 | 0 |
| I | 1 | 0 | 0 |
| II | 2a, 2b | 0 | 0 |
| IIIa | 3 | 0 | 0 |
| IIIb | 4 | 0 | 0 |
| IIIc | jedes T | 1 | 0 |
| IVa | jedes T | 2 | 0 |
| IVb | jedes T | jedes N | 1 |
Therapie
Grundsätze der chirurgischen Therapie
Für alle Cholangiokarzinome ist die einzige medizinische Therapie mit Aussicht auf Heilung die chirurgische Entfernung des Tumors. Allerdings ist bei weniger als der Hälfte der Patienten mit perihilären Gallengangskarzinomen eine Entfernung überhaupt möglich. Erschwerend kommt hinzu, dass die Bismuth-Corlette-Klassifikation und die UICC-Stadien die Resektabilität („Entfernbarkeit“) des Tumors nicht zuverlässig vorhersagen können. Ob ein Tumor tatsächlich chirurgisch zu entfernen ist, lässt sich häufig erst während der Operation feststellen. Es können vor allem solche Klatskintumoren entfernt werden, die noch lokal begrenzt sind. Auch Lymphknotenmetastasen sprechen nicht unbedingt gegen eine Resektion. Grob gesagt ist eine Resektion bis UICC-Stadium III noch möglich, ab Stadium IV hingegen nicht mehr.[3][17]
Folgende Kriterien sprechen folglich gegen eine Operation:
- Fernmetastasen
- Peritonealkarzinose
- Leberzirrhose
- Beidseitiger Befall der Segmentgallengänge
- Ausbreitung der Tumorzellen in ein anderes Gewebe[18]
Das Ausmaß der Resektion richtet sich nach der Bismuth-Corlette-Klassifikation. Das grundlegende Prinzip ist, den Krebs im Ganzen mit einem Saum aus gesundem Gewebe herauszuschneiden. Das heißt, es werden mindestens die extrahepatischen Gallenwege inklusive der Gallenblase sowie die örtlichen Lymphknoten entfernt. Häufig ist auch die Entfernung von Lebergewebe (meistens der kleine Lobus caudatus) bei Typ-II-Tumoren (nach Bismuth-Corlette) nötig. Bei Typ III muss auch der rechte bzw. linke Leberlappen entfernt werden (Hemihepatektomie). Für ausgewählte Patienten mit einem Typ-IV-Tumor der Bismuth-Corlette-Klassifikation, deren Tumor nicht mehr resektabel ist, kann eine Lebertransplantation in Frage kommen.[17] Trotz vollständiger Entfernung der Tumormasse erleiden viele Patienten im Verlauf eine Rückkehr der Krebserkrankung in Form örtlicher Rezidive oder Metastasen.[17]
Maßnahmen vor einer Operation
Bei cholestatischen Patienten müssen vor der Operation häufig Stents oder Drainagen in die Gallenwege eingelegt werden, um die gestaute Galle abzuleiten. Gründe dafür sind vor allem sehr hohe Bilirubinkonzentrationen im Blut, Cholangitis und eine nicht zeitnah durchführbare Operation.[3] Je nach Schweregrad der Cholestase dauert es nach biliärer Drainage etwa zwei bis vier Wochen, bis die Leber wieder ihre Funktionen normal ausführen kann.[18] Ist eine Teilresektion der Leber vorgesehen, kann zuvor eine Pfortaderembolisation der zu entfernenden Seite durchgeführt werden. Dabei wird ein Embolisat in die Pfortaderäste der zu resezierenden Lebersegmente eingebracht, das heißt, eine Substanz, die dafür sorgt, dass dort das Blut gerinnt. Dies hat einen hohen Blutfluss in die verbleibende Leber zur Folge, wodurch diese zum Wachstum (Hypertrophie) angeregt wird. Es dauert circa zwei bis drei Wochen, bis die zu verbleibenden Lebersegmente ausreichend an Volumen zunehmen. Gesundes Lebergewebe hypertrophiert weitaus besser als schon vorgeschädigtes Gewebe, ausgelöst zum Beispiel durch Fibrose. Die Behandlung kann dabei helfen, ausreichende Resektionsränder zu schaffen, und vermindert die Gefahr von Leberversagen nach der Operation.[3][17][19]
Begleitende medikamentöse Therapie
Nach der Operation kann eine adjuvante Chemotherapie mit Capecitabin angeboten werden. Die BILCAP-Studie, deren Ergebnisse 2019 im Fachjournal Lancet Oncology veröffentlicht wurden, zeigte einen Überlebensvorteil für operierte Cholangiokarzinom-Patienten, die nach der Operation eine 24 Wochen dauernde Therapie mit Capecitabin erhielten.[20] Eine Bestrahlung wird aktuell nicht regelhaft durchgeführt. Eine Strahlen- oder Chemotherapie vor der Operation (neoadjuvante Therapie) wird nicht regelhaft durchgeführt, allerdings kann ein zunächst nicht resektabler Tumor unter einer Chemotherapie so weit schrumpfen, dass er doch noch zu operieren ist.[3][21]
Palliative Therapie
Ist eine Operation mit Heilungsabsicht nicht mehr möglich, weil der Tumor entweder lokal nicht mehr resektabel ist oder schon in Stadium IV fortgeschritten ist, verbleiben mehrere Therapieoptionen der palliativen Therapie zur Lebensverlängerung, Symptomlinderung und Verbesserung der Lebensqualität.
Lässt der Gesundheitszustand es zu, ist die Standardtherapie („Erstlinientherapie“) für nicht resektable Klatskintumoren eine palliative Chemotherapie mit Gemcitabin und Cisplatin. Dieser Therapiestandard wurde durch eine im Jahr 2010 im New England Jounal of Medicine publizierte Studie definiert. Patienten, die die Kombination Gemcitabin/Cisplatin erhielten, hatten in dieser Studie ein medianes Überleben von 11,7 Monaten, verglichen zu 8,2 Monaten bei Patienten, die nur Gemcitabin erhielten.[22] Allerdings wurde am Studiendesign kritisiert, dass Cholangiozelluläre Karzinome verschiedenster Lokalisation eingeschlossen worden waren (allein 40 Prozent waren Gallenblasenkarzinome) und dass Subgruppenanalysen zeigten, dass der Überlebensvorteil nicht für alle Gruppen statistisch signifikant gesichert war. Die Übertragbarkeit dieser Daten auf Klatskintumoren ist daher unsicher.[23]
Für eine eventuelle Zweitlinientherapie gibt es keinen etablierten Standard. Häufig werden Fluorpyrimidin-basierte Therapieschemata verwendet.[3] Die Verengung oder der Verschluss der Gallenwege mit daraus folgendem Gallestau ist, wie beschrieben, ein häufiges Problem, da sie zu Gelbsucht mit Juckreiz und bakteriellen Infektionen führen kann. Hier können Stents aus Metall oder Plastik in die Engstellen gelegt werden, um so die Galle abfließen zu lassen. In diesem Rahmen hat ein weiteres lokales Therapieverfahren vermehrte Aufmerksamkeit bekommen: die photodynamische Therapie (PDT). Dabei wird ein Photosensibilisator in den Körper eingebracht, der sich in den Tumorzellen anreichert. Bestrahlung mit Licht in einer bestimmten Wellenlänge führt zur Freisetzung von Sauerstoffradikalen, die die Tumorzelle schädigen. In Kombination mit der photodynamischen Therapie bleiben eingelegte Stents länger offen.[24] Ein weiteres Feld, auf dem geforscht wird, ist die Anwendung von molekular gezielten Therapien und von Immuntherapien. Für molekular gezielte Therapien wird der Tumor genetisch untersucht, um herauszufinden, welche Genveränderung das Wachstum der Krebszellen antreibt. Für viele solcher Gene gibt es mittlerweile Medikamente (monoklonale Antikörper oder Tyrosinkinase-Inhibitoren), die gezielt die „Achillesferse“ angreifen und das Wachstum behindern. Solche Therapien sind bereits bei einigen Tumorerkrankungen etabliert, aber bei Cholangiokarzinomen bisher erst in den Anfängen (Stand 2018).[23]
Aktuell werden verschiedene Angriffspunkte erprobt (z. B. der EGF-Rezeptor oder BRAF). Ähnliches gilt für Immuntherapien, deren Ziel es ist, das Immunsystem die Tumorzellen bekämpfen zu lassen. Wirkstoffe in der Erprobung sind beispielsweise Nivolumab und Ipilimumab. Bislang stehen molekular gezielte Therapien und Immuntherapien für diese Krebsform nur im Rahmen wissenschaftlicher Studien zur Verfügung.[25]
Literatur
- B. Juntermanns, C. D. Fingas, G. C. Sotiropoulos, D. Jaradat, A. Dechêne, H. Reis, S. Kasper, A. Paul, G. M. Kaiser: Klatskin-Tumor: Langzeitüberleben nach Operation. In: Der Chirurg. Band 87, 2016, S. 514–519, doi:10.1007/s00104-016-0169-2
- Gerald Klatskin (1910–1986): A pioneer in hepato-biliary disorders and biopsy techniques. In: J Med Biogr. Band 28, Nr. 4, Nov 2020, S. 199–202. doi:10.1177/0967772018778028. PMID 29998747
- Helmut Witzigmann, Marcus Wiedmann, Christian Wittekind, Joachim Mössner, Johann Hauss: Therapiekonzepte und Ergebnisse bei Klatskin-Tumoren. In: Deutsches Ärzteblatt. Band 105, Nr. 9, 2008, S. 156–161. (aerzteblatt.de)
Weblinks
- Chirurgische Therapie des hilären Cholangiokarzinoms (PDF) Dissertation
- Klatskintumor – Das Wichtigste
- Onkopedia-Leitlinie, Stand Mai 2019
Einzelnachweise
- Alphabetisches Verzeichnis zur ICD-10-WHO Version 2019, Band 3. Deutsches Institut für Medizinische Dokumentation und Information (DIMDI), Köln, 2019, S. 448.
- Daryl Ramai, Karl Zakhia, Denzil Etienne, Armand Asarian, Madhavi Reddy: Gerald Klatskin (1910–1986): A pioneer in hepato-biliary disorders and biopsy techniques:. In: Journal of Medical Biography. 12. Juli 2018, doi:10.1177/0967772018778028 (sagepub.com [abgerufen am 8. Oktober 2020]).
- Marianne Sinn, Dirk Arnold, Markus Borner, Karel Caca, Thorsten Oliver Götze, Jens Ricke, Daniel Seehofer, Alexander Stein, Arndt Vogel, Henning Wege, Wilko Weichert, Thomas Winder: Maligne biliäre Tumoren. Karzinome der Gallengänge und Gallenblase. Onkopedia-Leitline, Stand Mai 2019, zuletzt abgerufen am 22. September 2020.
- Sumera Rizvi, Shahid A. Khan, Christopher L. Hallemeier, Robin K. Kelley, Gregory J. Gores: Cholangiocarcinoma — evolving concepts and therapeutic strategies. In: Nature Reviews Clinical Oncology. Band 15, Nr. 2, Februar 2018, ISSN 1759-4774, S. 95–111, doi:10.1038/nrclinonc.2017.157, PMID 28994423, PMC 5819599 (freier Volltext) – (nature.com [abgerufen am 22. September 2020]).
- Robert C Lowe, Christopher D Anderson: Epidemiology, pathogenesis, and classification of cholangiocarcinoma. In: uptodate.com. Wolters Kluwer, 5. September 2019, abgerufen am 22. September 2020 (englisch).
- Giordano Beretta, Gemma Gatta, Roberto Labianca, Stefania Mosconi, Michela Squadroni, Luca Tondulli: Cholangiocarcinoma – 2015. In: startoncology.net. Startoncology, 16. April 2013, abgerufen am 30. September 2020 (amerikanisches Englisch).
- Aus der Klinik für Hepatobiliäre Chirurgie und Transplantationschirurgie des Universitätsklinikums Hamburg Eppendorf, Chirurgische Therapie des hilären Cholangiokarzinoms (Klatskin-Tumor), Hamburg, 2015, S. 10.
- Robert C Lowe, Christopher D Anderson, Kris V Kowdley: Clinical manifestations and diagnosis of cholangiocarcinoma. In: uptodate.com. Wolters Kluwer, 23. Juni 2020, abgerufen am 22. September 2020 (englisch).
- Aus der Klinik für Hepatobiliäre Chirurgie und Transplantationschirurgie des Universitätsklinikums Hamburg Eppendorf, Chirurgische Therapie des hilären Cholangiokarzinoms (Klatskin-Tumor), Hamburg, 2015, S. 11.
- Víctor Molina, Jaime Sampson, Joana Ferrer, Santiago Sanchez-Cabus, David Calatayud: Tumor de Klatskin: Diagnóstico, evaluación preoperatoria y consideraciones quirúrgicas. In: Cirugía Española. Band 93, Nr. 9, 1. November 2015, ISSN 0009-739X, S. 552–560, doi:10.1016/j.ciresp.2015.07.003 (elsevier.es [abgerufen am 4. Oktober 2020]).
- Helmut Witzigmann, Marcus Wiedmann, Christian Wittekind, Joachim Mössner, Johann Hauss: Therapeutical Concepts and Results for Klatskin Tumors. In: Deutsches Aerzteblatt Online. 29. Februar 2008, ISSN 1866-0452, doi:10.3238/arztebl.2008.0156, PMID 19633782, PMC 2696740 (freier Volltext) – (aerzteblatt.de [abgerufen am 4. Oktober 2020]).
- Aus der Klinik für Hepatobiliäre Chirurgie und Transplantationschirurgie des Universitätsklinikums Hamburg Eppendorf, Chirurgische Therapie des hilären Cholangiokarzinoms (Klatskin-Tumor), Hamburg, 2015, S. 16.
- Aus der Klinik für Hepatobiliäre Chirurgie und Transplantationschirurgie des Universitätsklinikums Hamburg Eppendorf, Chirurgische Therapie des hilären Cholangiokarzinoms (Klatskin-Tumor), Hamburg, 2015, S. 17f.
- D. Moradpour, H. E. Blum: Ikterus. In: Edouard Battegay (Hrsg.): Differentialdiagnose Innerer Krankheiten. Vom Symptom zur Diagnose. 21. Auflage. Thieme, Stuttgart 2017, S. 424ff.
- Aus der Klinik für Hepatobiliäre Chirurgie und Transplantationschirurgie des Universitätsklinikums Hamburg Eppendorf, Chirurgische Therapie des hilären Cholangiokarzinoms (Klatskin-Tumor), Hamburg, 2015, S. 6 und S. 7.
- Marcia P. Gaspersz, Stefan Buettner, Jeroen L. A. van Vugt, Jeroen de Jonge, Wojciech G. Polak: Evaluation of the New American Joint Committee on Cancer Staging Manual 8th Edition for Perihilar Cholangiocarcinoma. In: Journal of Gastrointestinal Surgery. Band 24, Nr. 7, 1. Juli 2020, ISSN 1873-4626, S. 1612–1618, doi:10.1007/s11605-019-04127-x, PMID 30756314, PMC 7359130 (freier Volltext).
- Christopher D Anderson: Surgical resection of localized cholangiocarcinoma. In: UpToDate. Wolters Kluwer, 19. Oktober 2019, abgerufen am 7. Oktober 2020 (englisch).
- Aus der Klinik für Hepatobiliäre Chirurgie und Transplantationschirurgie des Universitätsklinikums Hamburg Eppendorf, Chirurgische Therapie des hilären Cholangiokarzinoms (Klatskin-Tumor), Hamburg, 2015, S. 20.
- Aus der Klinik für Hepatobiliäre Chirurgie und Transplantationschirurgie des Universitätsklinikums Hamburg Eppendorf, Chirurgische Therapie des hilären Cholangiokarzinoms (Klatskin-Tumor), Hamburg, 2015, S. 21.
- J. N. Primrose, R. P. Fox, D. H. Palmer, H. Z. Malik, R. Prasad, D. Mirza, A. Anthony, P. Corrie, S. Falk, M. Finch-Jones, H. Wasan, P. Ross, L. Wall, J. Wadsley, J. T. R. Evans, D. Stocken, R. Praseedom, Y. T. Ma, B. Davidson, J. P. Neoptolemos, T. Iveson, J. Raftery, S. Zhu, D. Cunningham, O. J. Garden, C. Stubbs, J. W. Valle, J. Bridgewater; BILCAP study group: Capecitabine compared with observation in resected biliary tract cancer (BILCAP): a randomised, controlled, multicentre, phase 3 study. In: Lancet Oncol. Band 20, Nr. 5, Mai 2019, S. 663–673, doi:10.1016/S1470-2045(18)30915-X (englisch).
- Christopher D Anderson, Keith E Stuart: Treatment of localized cholangiocarcinoma: Adjuvant and neoadjuvant therapy and prognosis. In: UpToDate. Wolters Kluwer, 9. Mai 2019, abgerufen am 7. Oktober 2020 (englisch).
- Juan Valle, Harpreet Wasan, Daniel H. Palmer, David Cunningham, Alan Anthoney: Cisplatin plus Gemcitabine versus Gemcitabine for Biliary Tract Cancer. In: New England Journal of Medicine. Band 362, Nr. 14, 8. April 2010, ISSN 0028-4793, S. 1273–1281, doi:10.1056/NEJMoa0908721 (nejm.org).
- S. Rizvi, S. A. Khan, C. L. Hallemeier, R. K. Kelley, G. J. Gores: Cholangiocarcinoma - evolving concepts and therapeutic strategies. In: Review Nat Rev Clin Oncol. Band 15, Nr. 2, Februar 2018, S. 95–111, doi:10.1038/nrclinonc.2017.157, PMID 28994423 (englisch).
- Christopher D Anderson, Keith E Stuart, Manisha Palta: Treatment options for locally advanced, unresectable, but nonmetastatic cholangiocarcinoma. In: UpToDate. Wolters Kluwer, 26. August 2020, abgerufen am 8. Oktober 2020 (englisch).
- Keith E Stuart: Systemic therapy for advanced cholangiocarcinoma. In: UpToDate. Wolters Kluwer, 23. September 2020, abgerufen am 8. Oktober 2020 (englisch).