Irinotecan
Irinotecan ist ein Arzneistoff, der zur Behandlung bestimmter Krebserkrankungen eingesetzt wird. Pharmakologisch ist Irinotecan ein Zytostatikum aus der Gruppe der Topoisomerase-Hemmer, chemisch stellt es ein halbsynthetisches Derivat des natürlich vorkommenden Pflanzeninhaltsstoffes Camptothecin dar. Camptothecin ist ein Alkaloid, das aus der Pflanze Camptotheca acuminata gewonnen wird.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
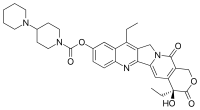 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Irinotecan | |||||||||||||||||||||
| Andere Namen |
(S)-4,11-Diethyl-3,4,12,14-tetrahydro-4-hydroxy-3,14-dioxo-1H-pyrano[3′,4′:6,7]-indolizino[1,2-b]chinolin-9-yl-[1,4′-bipiperidin]-1′-carboxylat | |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XX19 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Topoisomerase I-Hemmer | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wirkungsmechanismus
Irinotecan bewirkt einen „programmierten Zelltod“ (Apoptose). Es hemmt das Enzym DNA-Topoisomerase I, das die räumliche Anordnung der DNA reguliert und in vielen Tumoren gesteigert aktiv ist. Die krankhaft gesteigerte Zellteilung des entarteten Gewebes wird gebremst.
Irinotecan und sein aktiver Metabolit SN-38 lagern sich dem Komplex aus DNA-Topoisomerase I und DNA an und verhindern den Wiederverschluss des zuvor erfolgten DNA-Einzelstrangbruchs. Nach gegenwärtigem Wissensstand verursacht die Replikation von DNA durch die entsprechenden Enzyme wie DNA-Polymerasen bei Kontakt mit dem Komplex aus Irinotecan, DNA und DNA-Topoisomerase I einen Doppelstrangbruch der DNA und somit einen Abbruch der DNA-Replikation. Säugetierzellen besitzen keinen ausreichend wirksamen DNA-Reparaturmechanismus, um solche DNA-Doppelstrangbrüche zu reparieren.
Bemessen am Zellzyklus ist Irinotecan nur in der S-Phase des Zellzyklus (DNA-Synthese) wirksam. Ruhende Zellen (gesunde und krankhafte), welche keine DNA synthetisieren, sich also nicht in der S-Phase des Zellzyklus befinden, werden durch Irinotecan nicht beeinflusst.
Verwandte Substanzen mit gleichem Wirkungsmechanismus sind Topotecan und Camptothecin. Etoposid (VP16) und Teniposid (VM26) sind zwar auch Topoisomerase-Hemmer, sie hemmen aber die DNA-Topoisomerase II.
Metabolisierung
Irinotecan ist ein Prodrug. Es wird vor allem in der Leber durch eine Carboxyesterase vermittelte Spaltung der Carbamatgruppe zum Phenol in die aktive und lipophilere Form SN-38 überführt. SN-38 ist ein ca. 1000-fach stärkerer Hemmstoff der DNA-Topoisomerase I als Irinotecan selbst. Die Halbwertzeit von Irinotecan beträgt 14,2 (Spanne 6–12) Stunden. Die mittlere terminale Eliminationshalbwertszeit von SN-38 beträgt 10–20 Stunden. Irinotecan wird zu 50 % an Plasmaproteine gebunden, SN-38 zu 95 %. Die Zeit zum Erreichen der Spitzenkonzentration von Irinotecan im Plasma beträgt ein bis zwei Stunden.
Die Ausscheidung von Irinotecan erfolgt vorwiegend über eine Glucuronidierung des aktiven Metaboliten SN-38 zu SN-38-Glukuronid, welches um den Faktor 50–100 schwächer wirksam ist als unverändertes SN-38. Trotz Glukuronidierung erfolgt nur eine geringfügige Ausscheidung über den Urin von SN-38 (3 %). 11–20 % des Irinotecans werden unverändert im Urin ausgeschieden. Im Stuhlgang werden 63,7±6,8 % des Irinotecan und SN-38 ausgeschieden.
Sowohl Irinotecan als auch SN-38 liegen in einem pH-abhängigen Gleichgewicht zweier Zustandsformen vor: einer Lacton-Form und einer Hydroxy-Form. Ein sauerer pH bewirkt den verstärkten Übergang der Hydroxy-Form in eine Lacton-Form, ein basischer pH bewirkt das umgekehrte. Nur die Lacton-Form von Irinotecan und SN-38 haben eine Wirksamkeit gegen Zellen und sind somit aktiv. Die Hydroxy-Form hat keine Wirkung und ist somit inaktiv. Welchen Anteil SN-38 an der Anti-Tumor-Wirkung (antineoplastische Wirkung) von Irinotecan hat, ist gegenwärtig noch nicht zuverlässig geklärt.
Anwendungsgebiet(e)
Metastasierter Dickdarm-/Mastdarmkrebs
Primärbehandlung (first line)
Irinotecan wird bei der primären Behandlung (first line-Therapie) des metastasierten Kolonkarzinoms (Dickdarmkrebs mit Fernabsiedlungen; Stadium IV nach Dukes) in Kombination mit 5-Fluoruracil (5-FU) und Folinsäure eingesetzt. Die bessere Wirksamkeit der Kombination Irinotecan, 5-FU und Folinsäure gegenüber 5-FU und Folinsäure allein wurde in zwei randomisierten, kontrollierten, multinationalen klinischen Phase III-Studien nachgewiesen.
Sekundärbehandlung (second line)
Irinotecan wird bei der sekundären Behandlung (second line-Therapie) des metastasierten Kolonkarzinoms eingesetzt, welches auf eine primäre Behandlung mit 5-FU und Folinsäure nicht oder nur unzureichend angesprochen hat (Beispiel: Wachstum des Tumors oder der Metastasen unter Therapie mit 5-FU und Folinsäure oder fehlender Rückgang des Tumors oder der Metastasen unter Therapie mit 5-FU und Folinsäure). Der Wirksamkeitsnachweis von Irinotecan beruht auf drei offenen klinischen multizentrischen Studien mit Irinotecan als einziger Substanz getestet gegen 5-FU Infusionen oder beste Supportivtherapie (keine Chemotherapie).
Experimentelle Verwendung
Irinotecan wird erprobt in der der Therapie weiterer Tumorerkrankungen wie Zervixkarzinom (Gebärmutterhalskrebs), Ösophaguskarzinom (Speiseröhrenkrebs), Magenkarzinom (Magenkrebs), Lungenkarzinome (Lungenkrebs), Mesotheliom (Rippenfellkrebs), Pankreaskarzinom (Bauchspeicheldrüsenkrebs), Gallengangskarzinom; sowie bei Kindern und Jugendlichen zur Behandlung extrakranieller solider Tumoren (Ewing-Sarkom, Neuroblastom, Rhabdomyosarkom, PNET, Wilms-Tumor) oder bestimmter Hirntumoren (Ependymom, Medulloblastom, malignes Gliom, Glioblastom, PNET).
Verabreichung
Irinotecan wird langsam intravenös (über 90 Minuten) infundiert. Sofern die Kombinationsbehandlung angezeigt ist, erfolgen unmittelbar danach zunächst die Folinsäure-Infusion und dann die 5-FU-Infusion.
Zur Verhinderung oder Abmilderung von unerwünschten Wirkungen von Irinotecan kann die prophylaktische Gabe von Atropin (Milderung oder Verhinderung eines cholinergen Syndroms) oder von Antiemetika (gegen Übelkeit und Erbrechen) angezeigt sein.
Gegenanzeigen und besondere Vorsichtsmaßnahmen
Irinotecan sollte bei
- vorangegangener Bestrahlung im Gebiet von Bauch und Becken (Bestrahlung des Darmes),
- bestehender oder beabsichtigter Schwangerschaft und
- bestehendem schweren Leberschaden
- Morbus Meulengracht (Icterus intermittens juvenilis, familiäre Gelbsucht)
nur nach strikter Nutzen-Risiko-Abwägung eingesetzt werden.
Da Irinotecan in die Muttermilch übergeht, darf unter der Behandlung nicht gestillt werden. Irinotecan-haltige Arzneimittel sind für Kinder und Jugendliche nicht zugelassen.
Nebenwirkungen
Abhängig von Dosis und Infusionsgeschwindigkeit kann ein cholinerges Syndrom auftreten, das sich früh (innerhalb von 24 Stunden, sogenanntes Akutes cholinerges Syndrom) im Auftreten von Bradykardie (Herzfrequenzabfall), Gesichtsrötung (Flush), Nasenlaufen, Tränenlaufen, Schwitzen und Durchfall (Diarrhoe) äußert; oder spät (nach 24 Stunden und später) mit einer Diarrhoe (Durchfall) einhergeht. Weitere mögliche unerwünschte Wirkungen sind Myelosuppression (manifestiert sich in Neutropenie, Anämie und Thrombopenie), Alopezie, Leberschädigung (Transaminasenerhöhung, Hyperbilirubinämie, Gelbsucht bis zum Leberversagen), Nierenschädigung (Kreatininanstieg, bisweilen auch Nierenversagen, vor allem bei gleichzeitigem Flüssigkeitsverlust durch Durchfall), Hypersensitivität (Überempfindlichkeit, allergische Reaktion), Kolitis, Ileus (Darmentzündung und Darmverschluss).
Durchfall (Diarrhöe)
Charakteristisch sind durch Irinotecan verursachte Durchfälle.
„Frühe Durchfälle“ treten während oder kurz nach der Infusion von Irinotecan auf. Sie werden durch eine cholinerge Wirkung von Irinotecan verursacht, welche sich auf eine Hemmung der Acetylcholinesterase (AChE) zurückführen lassen. In den meisten Fällen ist dieser frühe Durchfall bedingt durch Irinotecan kurzandauernd und nur selten schwerwiegend. Parallel zum Durchfall treten oft als zusätzliche Symptome eines cholinergen Syndroms Schwitzen, Nasenlaufen (Schnupfen), gesteigerte Speichelproduktion, Tränenlaufen, Gesichtsrötung (Flush) und gesteigerte Darmtätigkeit auf. Die Gabe von Atropin kann diese Symptome und damit auch den Durchfall abmildern oder verhindern (prophylaktische Gabe). Der vermehrte Speichelfluss kann zusammen mit dem vermehrten Magenschleim zu Würgeeffekten und Erbrechen führen.
„Späte Durchfälle“ treten 24 Stunden nach Irinotecan-Infusion oder noch später auf. Diese Durchfälle sind zumeist schwerwiegender, dauern länger an und können ohne Gegenmaßnahmen auch zu lebensbedrohlichen Zuständen infolge massiven Flüssigkeits- und Salzverlust führen. Als Richtwert gilt für schweren Durchfall mehr als 10 Stuhlgänge am Tag oder Durchfall mit Blutbeimengung. Im Gegensatz zum „frühen Durchfall“ ist der „späte Durchfall“ durch zusätzliche Mechanismen verursacht: neben der cholinergen Wirkung durch Blockade der Acetylcholinesterase ist auch die toxische Wirkung des Medikaments auf die Schleimhaut des Darms ein Mitverursacher dieser Nebenwirkungen. Menschen über 65 Jahren weisen ein höheres Risiko zur Entwicklung von Durchfällen durch Irinotecan auf.
Wechselwirkungen
Die Wechselwirkungen zwischen Irinotecan und anderen Arzneistoffen oder Lebensmittelbestandteilen resultieren aus der hepatischen Verstoffwechselung von Irinotecan, vor allem über das Cytochrom CYP3A4. Substanzen, die ebenfalls über CYP3A4 verstoffwechselt werden, können den Abbau und somit Wirkung und Nebenwirkung von Irinotecan beeinflussen.
Eine Reihe von Wechselwirkungen von Irinotecan mit anderen Arzneistoffen und Lebensmittelbestandteilen sind gegenwärtig bekannt.
Verschiedene Antiepileptika wie zum Beispiel Carbamazepin, Phenobarbital, Phenytoin senken durch ihren Einfluss auf das Cytochrom-P450-System wahrscheinlich die Wirkungen des Irinotecan, und zwar durch Steigerung dessen Clearance. Um einen Wirkungsverlust von Irinotecan auszugleichen, ist entweder eine Dosiserhöhung von Irinotecan oder ein Absetzen der Antiepileptika erforderlich. Eine Dauertherapie mit Dexamethason kann ebenfalls die Wirkungen von Irinotecan vermindern, in dem es die Clearance von Irinotecan durch verschiedene Mechanismen steigert, so dass bei gleichzeitiger Gabe eine Dosisanpassung erforderlich werden kann. Auch Johanniskraut senkt die Wirkstärke von Irinotecan. Die Pflanzeninhaltsstoffe fördern die CYP3A4-vermittelte Umwandlung von Irinotecan zu inaktiven Metaboliten, so dass niedrigere Plasmaspiegel der wirksamen Substanz SN-38 resultieren.
Diuretika wie Furosemid, Torasemid usw. verstärken den als Nebenwirkung von Irinotecan auftretenden Durchfall. Die daraus resultierende mögliche Dehydratation (Wasserverlust) kann durch die Diuretika verstärkt werden.
Die gleichzeitige Anwendung von Irinotecan und Etoposid erhöht das Risiko einer Lebertoxizität (Leberschädigung). Die gemeinsame Anwendung von Irinotecan und Prochlorperazin erhöht das unerwünschte Auftreten einer Akathisie (Nicht-Sitzenkönnen).
Handelsnamen
Monopräparate
Arinotec (A), Axinotecan (D), Campto (D, A, CH), Camptosar (USA, CDN), zahlreiche Generika (D, A, CH)
Literatur
- RL Drengler et al.: Phase I and pharmacokinetic trial of oral irinotecan administered daily for 5 days every 3 weeks in patients with solid tumors. In: J. Clin. Oncol., 1999, 17(2), S. 685–696. PMID 10080615
- CC Earle et al.: Two schedules of second-line irinotecan for metastatic colon carcinoma. In: Cancer, 2004 Dec 1;101(11): 2533–2539. PMID 15503310
- I Grivicich et al.: The irinotecan/5-fluorouracil combination induces apoptosis and enhances manganese superoxide dismutase activity in HT-29 human colon carcinoma cells. In: Chemotherapy, 2005 May; 51(2–3), S. 93–102. PMID 15886469
- M Harel et al.: The 3D structure of the anticancer prodrug CPT-11 with Torpedo californica acetylcholinesterase rationalizes its inhibitory action on AChE and its hydrolysis by butyrylcholinesterase and carboxylesterase. In: Chem Biol Interact., 2005 Dec 15; 157–158, S. 153–157. PMID 16289500
- JL Hyatt et al.: Inhibition of acetylcholinesterase by the anticancer prodrug CPT-11. In: Chem Biol Interact. 2005 Dec 15; 157–158, S. 247–252. PMID 16257398
- Ji SH et al.: Phase II study of irinotecan, 5-fluorouracil and leucovorin as first-line therapy for advanced colorectal cancer. In: Japanese Journal of Clinical Oncology, 2005 Apr; 35(4), S. 214–217. PMID 15845571
- T Ohtsu et al.: Unexpected hepatotoxicities in patients with non-Hodgkin’s lymphoma treated with irinotecan (CPT-11) and etoposide. In: Japanese Journal of Clinical Oncology, 1998 Aug;28(8), S. 502–506. PMID 9769785
- ML Rothenberg et al.: Alternative dosing schedules for irinotecan. In: Oncology (New York), 1998;12(8 Suppl 6), S. 68–71. PMID 9726095
- GG. Chabot: Clinical Pharmacokinetics of irinotecan. In: Clin Pharmacokinet., 1997; 33(4), S. 245–259. PMID 9342501
- JG Slatter et al.: Pharmacokinetics, metabolism, and excretion of irinotecan (CPT-11) following I.V. infusion of [(14)C]CPT-11 in cancer patients. In: Drug Metab Dispos., 2000; 28(4), S. 423–433. PMID 10725311
- JG Slatter et al.: Bioactivation of the anticancer agent CPT-11 to SN-38 by human hepatic microsomal carboxylesterases and the in vitro assessment of potential drug interactions. In: Drug Metab Dispos., 1997 Oct; 25(10), S. 1157–1164. PMID 9321519
- N Tsavaris et al.: Two different schedules of irinotecan (CPT-11) in patients with advanced colorectal carcinoma relapsing after a 5-fluorouracil and leucovorin combination. A randomized study. In: Cancer Chemother Pharmacol., 2003 Dec; 52(6), S. 514–519. PMID 14504920
- K Yoshimatsu et al.: Second-line chemotherapy with low-dose CPT-11 and cisplatin for colorectal cancer resistant to 5-FU-based chemotherapy. In: Cancer Chemother Pharmacol., 2003 Dec; 52(6), S. 465–468. PMID 12920569
Weblinks
- Drug Prescription Information. (PDF; 342 kB) FDA; US-amerikanischer Beipackzettel zu Irinotecan (Camptosar®). Stand: 14. Mai 2010.
- Information der British Columbia Cancer Agency zu Irinotecan Umfassende, klinisch orientierte Monographie zur Irinotecan. Stand: 1. Februar 2006.
Einzelnachweise
- Eintrag zu Irinotecan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station NJ 2006, ISBN 978-0-911910-00-1, S. 885–886.
- Datenblatt Irinotecan hydrochloride bei Sigma-Aldrich, abgerufen am 6. April 2011 (PDF).