Natriumdithionit
Natriumdithionit ist das Natriumsalz der im freien Zustand instabilen Dithionigen Säure (H2S2O4). Natriumdithionit ist ein starkes Reduktionsmittel.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
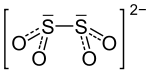 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumdithionit | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel |
| |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse |
| |||||||||||||||
| Aggregatzustand |
Feststoff | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Natriumdithionit wurde im Jahr 1869 erstmals vom französischen Chemiker Paul Schützenberger isoliert und beschrieben.[6][7]
Darstellung und Gewinnung
Zur Herstellung von Natriumdithionit gibt es verschiedene Verfahren. Über die Hälfte der Weltproduktion erfolgt mit dem Formiatverfahren. Neuanlagen werden fast ausschließlich nach diesem Verfahren betrieben. Hier wird Natriumformiat in methanolischer Lösung unter Druck mit Schwefeldioxid umgesetzt.[3]
Weitere Verfahren mit jeweils 10–20 % Anteil an der Weltproduktion entfallen auf das Natriumtetrahydroborat-Verfahren, Zinkstaubverfahren und Amalgamverfahren.[3] Beim Natriumborhydridverfahren wird Natriumborhydrid in stark basischer Lösung mit Schwefeldioxid umgesetzt.[3]
Das Zinkstaubverfahren basiert auf einer Reduktion von Schwefeldioxid durch Zink in einer wässrigen Suspension, wobei zunächst Zinkdithionit gebildet wird. Die anschließende Behandlung mit Natronlauge ergibt die Zielverbindung.[3]
Das Amalgamverfahren geht vom Natriumsulfit aus, welches in einer Elektrolysezelle mittels Natriumamalgam reduziert wird.[3]
Nach dem Formiat-Verfahren produziert in Deutschland die BASF, nach dem Zinkstaub-Verfahren die belgische Firma Prayon.
Die Weltproduktion betrug 2001 etwa 550.000 Tonnen im Jahr.[4] Damit zählt es zu den chemischen Substanzen, die in großen Mengen hergestellt werden („High Production Volume Chemical“, HPVC) und für die von der Organisation für wirtschaftliche Zusammenarbeit und Entwicklung (OECD) eine Datensammlung zu möglichen Gefahren („Screening Information Dataset“, SIDS) angefertigt wurde.[4]
Eigenschaften
Natriumdithionit tritt als kristallwasserfreies Anhydrat und als Dihydrat auf. Das Anhydrat ist ein weißes kristallines Pulver mit schwachem Geruch nach Schwefeldioxid.[3] Das Dihydrat bildet gelbliche Prismen.[3] Beide Kristallformen unterscheiden sich in der Dichte signifikant. Natriumdithionit ist gut wasserlöslich. Bis zum Umwandlungspunkt bei 72 °C ist das Dihydrat in Wasser etwas schwerer löslich.[3]
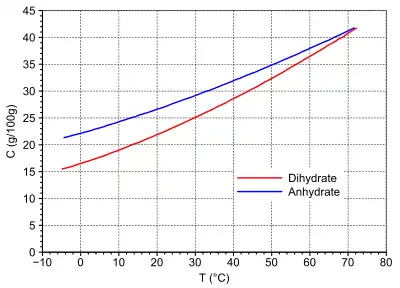
Wässrige Lösungen sind nur begrenzt stabil und disproportionieren unter Wasseraufnahme rasch zu Natriumhydrogensulfoxylat und Natriumhydrogensulfit,[3] wobei die Reaktion umso schneller verläuft, je wärmer das Wasser ist:
In Luftgegenwart erfolgt zudem eine Oxidation zu Natriumsulfit (Na2SO3) und Natriumsulfat (Na2SO4).
Das Dihydrat ist besonders bei kleiner Korngröße sehr empfindlich gegen Luftsauerstoff.[3] Die dabei auftretende Oxidationswärme kann zur Selbstentzündung führen.[3] Beim Erhitzen des Anhydrats in Luft wird ab 80 °C in einer exothermen Reaktion Natriumsulfat gebildet und dabei Schwefeldioxid freigesetzt.[3] Oberhalb von 150 °C entstehen unter Luftausschluss in einer heftigen Reaktion Natriumsulfit, Natriumthiosulfat, Schwefeldioxid und Spuren von Schwefel.[3]
Die S-S-Bindung im Dithionitdianion ist mit 238,9 pm ungewöhnlich lang und somit relativ schwach. Zu einem geringen Teil liegen in einem Gleichgewicht •SO2−-Radikalanionen vor, wobei das Gleichgewicht fast vollständig auf der Seite des Dithionitdianions liegt.[8]
Die Substanz reizt Augen, Haut und Schleimhäute.[2]
Verwendung
Wegen der reduzierenden Wirkung wird Natriumdithionit als Bleichmittel in Fleckensalzen, in der Färberei (Küpenfärberei), sowie zum Bleichen von Zucker, Sirup, holzhaltigem Papier und Holzschliff, aber auch zum Abscheiden von Silber aus Fixierbädern verwendet.[8] In der Galvanik wird Natriumdithionit bei der Abwasserbehandlung als Reduktionsmittel verwendet. Außerdem findet es Verwendung bei der Fischer-Hafner-Methode zur Synthese von Aren-Metall-Komplexen, wie z. B. Bis(benzol)chrom.[9]
Risikobewertung
Natriumdithionit wurde 2015 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Natriumdithionit waren die Besorgnisse bezüglich Verbraucherverwendung, Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie der möglichen Gefahren durch krebsauslösende und sensibilisierende Eigenschaften. Die Neubewertung läuft seit 2016 und wird von Österreich durchgeführt.[10]
Einzelnachweise
- Eintrag zu SODIUM HYDROSULFITE in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Oktober 2021.
- Eintrag zu Natriumdithionit in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Juni 2021. (JavaScript erforderlich)
- J.J. Barbera, A. Metzger, M. Wolf: Sulfites, Thiosulfates, and Dithionites in Ullmann's Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.a25_477
- OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Sodium dithionite, abgerufen am 4. November 2014.
- Eintrag zu Sodium dithionite im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- P. Schützenberger: Sur un nouvel acide de soufre in Compt. rend. 69 (1869) 196.
- Rolf Werner Soukup: Chemiegeschichtliche Daten anorganischer Substanzen, Version 2020, S. 101 pdf.
- Eintrag zu Natriumdithionit. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
- Riedel, Erwin., Alsfasser, Ralf.: Moderne anorganische Chemie : mit CD-ROM : [133 Tabellen]. 3. Auflage. Gruyter, Berlin [u. a.] 2007, ISBN 978-3-11-019060-1, S. 709.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): sodium dithionite, abgerufen am 26. März 2019.

