Dihydrofolatreduktase
Dihydrofolatreduktase (DHFR), auch Dihydrofolsäure-Reduktase, heißen Enzyme, die Folsäure zu Dihydrofolsäure (DHF) und DHF zu Tetrahydrofolsäure (THF) hydrieren. Diese Reaktionen aktivieren das Vitamin Folsäure und sind unentbehrlich für die Nukleotid-Biosynthese in allen Lebewesen. Beim Menschen kommt DHFR in allen Gewebetypen vor. Mutationen am DHFR-Gen können Dihydrofolat-Reduktase-Mangel und dieser eine megaloblastäre Anämie verursachen.[1]
| Dihydrofolat-Reduktase | ||
|---|---|---|
 | ||
|
Vorhandene Strukturdaten: s. UniProt | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 186 Aminosäuren | |
| Bezeichner | ||
| Gen-Name | DHFR | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.5.1.3, Oxidoreduktase | |
| Reaktionsart | Reduktion | |
| Substrat | 7,8-Dihydrofolat + NADPH + H+ | |
| Produkte | 5,6,7,8-Tetrahydrofolat + NADP+ | |
| Vorkommen | ||
| Homologie-Familie | DHFR | |
| Übergeordnetes Taxon | Lebewesen | |
Die DHFR in Protozoen und manchen Pflanzen ist ein Doppelenzym, das zusätzlich die Funktion der Thymidylatsynthase hat; aufgrund dieser strukturellen Eigenheit ist die protozoische DHFR Target bei der Entwicklung von Antibiotika, z. B. gegen den Malariaerreger Plasmodium falciparum oder Kryptosporidien.[2][3][4]
Katalysierte Reaktionen
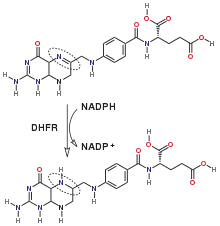
7,8-Dihydrofolsäure wird mit NADPH als Elektronendonor zu Tetrahydrofolsäure reduziert (s. Abb.). Außerdem kann Folsäure zu DHF reduziert werden; diese Reaktion läuft jedoch langsamer ab.[5][6]
Weitere Funktionen
Die Anwesenheit von DHFR in Endothelzellen ist ausschlaggebend für die Funktion von Tetrahydrobiopterin in der NO-Synthase.[7]
Regulation und Hemmung
DHFR ist ein ausgiebig untersuchtes Enzym, das als Target für die Chemotherapie und bei anderen Krankheiten gilt. Das Enzym kann durch Folsäure-Antagonisten wie Methotrexat, Aminopterin oder Trimethoprim kompetitiv gehemmt werden. Die Hemmung bewirkt einen Mangel an Tetrahydrofolsäure, wodurch die Thymin-Synthese (Thymidylat-Synthase benötigt THF) sowie die Purinsynthese (Aufbau des Puringrundkörpers) verhindert wird, woraufhin die Zelle abstirbt.[8]
Siehe auch
Weblinks
- reactome.org: Folate is reduced to dihydrofolate (DHF)
- reactome.org: DHF is reduced to tetrahydrofolate (THF)
- Proteopedia: Dihydrofolate reductase (engl.)
Einzelnachweise
- UniProt P00374
- Prosite-Eintrag
- Ochong E, Bell DJ, Johnson DJ, et al: Plasmodium falciparum strains harboring dihydrofolate reductase with the I164L mutation are absent in Malawi and Zambia even under antifolate drug pressure. In: Antimicrob. Agents Chemother.. 52, Nr. 11, November 2008, S. 3883–3888. doi:10.1128/AAC.00431-08. PMID 18725445.
- Bolstad DB, Bolstad ES, Frey KM, Wright DL, Anderson AC: Structure-based approach to the development of potent and selective inhibitors of dihydrofolate reductase from cryptosporidium. In: J. Med. Chem.. 51, Nr. 21, November 2008, S. 6839–52. doi:10.1021/jm8009124. PMID 18834108.
- EC 1.5.1.3
- Steven W Bailey, June E Ayling: The extremely slow and variable activity of dihydrofolate reductase in human liver and its implications for high folic acid intake. In: Proceedings of the National Academy of Sciences. 106, Nr. 36, 2009, S. 15424–15429.
- Chalupsky K, Cai H: Endothelial dihydrofolate reductase: critical for nitric oxide bioavailability and role in angiotensin II uncoupling of endothelial nitric oxide synthase. In: Proc. Natl. Acad. Sci. U.S.A.. 102, Nr. 25, Juni 2005, S. 9056–61. doi:10.1073/pnas.0409594102. PMID 15941833. PMC 1157015 (freier Volltext).
- Abali EE, Skacel NE, Celikkaya H, Hsieh YC: Regulation of human dihydrofolate reductase activity and expression. In: Vitam. Horm.. 79, 2008, S. 267–292. doi:10.1016/S0083-6729(08)00409-3. PMID 18804698.