Dimethylcarbamoylchlorid
Dimethylcarbamoylchlorid (DMCC) ist ein Reagens zur Übertragung der Dimethylcarbonyl-Funktion auf alkoholische oder phenolische Hydroxygruppen unter Bildung von Dimethyl-carbamaten, die pharmakologische und pestizide Aktivitäten besitzen. Wegen seiner hohen Giftigkeit und seiner im Tierversuch sowie vermutlich auch beim Menschen krebserregenden Eigenschaften[11] darf Dimethylcarbamoylchlorid nur unter strikten Sicherheitsvorkehrungen verwendet werden.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
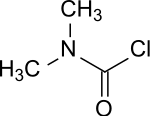 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dimethylcarbamoylchlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H6ClNO | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 107,54 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt |
−33 °C[3] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser. Löslich in inerten Lösungsmitteln, wie Benzol,[7] Xylol,[8] Chloroform, Aceton, Ethylacetat, 1,4-Dioxan, Pyridin[7] und Kohlenstoffdisulfid[9] | ||||||||||||||||||
| Brechungsindex |
1,4540 (20 °C, 589 nm)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
Bereits 1879 wurde die Darstellung von Dimethylcarbamoylchlorid (hier als „Dimethylharnstoffchlorid“ bezeichnet) aus Phosgen und Dimethylamin (DMA) berichtet.[9]
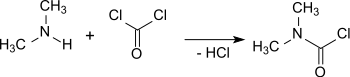
Bei der Reaktion von Phosgen mit gasförmigem Dimethylamin in einem Durchflussreaktor entsteht bei 275 °C Dimethylcarbamoyl-chlorid in hoher Ausbeute (90 %).[12] Zur Unterdrückung der Bildung von Harnstoffen wird mit einem Phosgenüberschuss (COCl2 : DMA = 3 : 1) gearbeitet.
Die Reaktion kann auch im Labormaßstab mit Diphosgen bzw. Triphosgen und wässriger Dimethylaminlösung im Zweiphasen-system Benzol + Xylol/Wasser in einem Rührreaktor mit Natriumhydroxid als Säurefänger durchgeführt werden, allerdings wegen der Hydrolysempfindlichkeit des DMCC mit erheblich niedrigen Ausbeuten (56 %).[13]
Bei der Umsetzung von Phosgen mit Trimethylamin entsteht ebenfalls Dimethylcarbamoylchlorid und Methylchlorid[14]

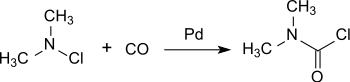
Ein neueres Verfahren geht aus von Dimethylaminchlorid aus, das an einem Palladium-Katalysator unter Druck mit Kohlenmonoxid bei Raumtemperatur praktisch quantitativ zu DMCC umgesetzt wird.[15]
Auch bei der Vilsmeier-Haack-Reaktion kann in geringen Mengen (0–20 ppm) Dicarbamoylchlorid aus Dimethylformamid (DMF) entstehen,[16] ebenso wie beim Einsatz von DMF als Katalysator bei der Umsetzung von Carbonsäuren mit Thionylchlorid zu den entsprechenden Carbonsäurechloriden.[17]
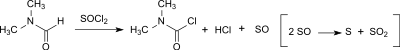
Die Neigung zur Bildung von DMCC hängt vom Chlorierungs-reagens ab (Thionylchlorid > Oxalylchlorid > Phosphoroxychlorid) und ist bei Anwesenheit einer Base höher. Allerdings hydrolysiert DMCC so schnell – mit einer Halbwertszeit von ca. 6 Minuten bei 0 °C – zu Dimethylamin, Salzsäure und Kohlendioxid, dass nach wässriger Aufarbeitung weniger als 3 ppm DMCC im Vilsmeier-Produkt gefunden wird.[18]
Eigenschaften
Dimethylcarbamoylchlorid ist eine klare, farblose, korrosive und brennbare Flüssigkeit mit stechendem Geruch und tränenreizender Wirkung, die sich in Wasser schnell zersetzt.[6] Wegen seiner in der Handhabung unangenehmen sowie giftigen, mutagenen und im Tierversuch erwiesen cancerogenen Eigenschaften[19][20] sollte DMCC mit äußerster Vorsicht gehandhabt werden.
Dimethylcarbamoylchlorid verhält sich wie ein Säurechlorid, dessen Chloratom gegen andere Nukleophile ausgetauscht werden kann. So reagiert es mit Alkoholen, Phenolen und Oximen zu den entsprechenden N,N-Dimethylcarbamaten, mit Thiolen zu Thiolourethanen, mit Aminen und Hydroxylamin zu substituierten Harnstoffen und mit Imidazolen und Triazolen zu Carbamoylazolen.[21]

DMCC ist weniger reaktiv und gegenüber Substraten mit mehreren nukleophilen Zentren weniger selektiv als herkömmliche Säurechloride.
Ungesättigte konjugierte Aldehyde, wie Crotonaldehyd reagieren mit Dimethylcarbamoylchlorid unter Bildung von Dienylcarbamaten,
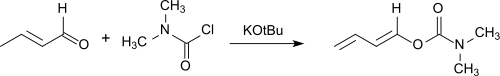
die als Diene in Diels-Alder-Reaktionen eingesetzt werden können.[22]
Bei der Reaktion von Dimethylcarbamoylchlorid mit Alkalicarboxylaten entstehen die entsprechenden Dimethylamide. Mit wasserfreiem Natriumcarbonat[23] bzw. mit überschüssigem Dimethylamin reagiert DMCC zu Tetramethylharnstoff.[24]
Bei der Reaktion von DMCC mit DMF entsteht Tetramethylformamidiniumchlorid,[25] ein wesentliches Zwischenprodukt in der Darstellung von Tris(dimethylamino)methan, einem Reagens zur Einführung von Enaminfunktionen in Verbindung mit aktivierten Methylengruppen[26] und zur Darstellung von Amidinen.[27]
methan.svg.png.webp)
Dimethylcarbamoylchlorid ist ein Edukt für die Insektizid-Stoffklasse der Dimethylcarbamate,[28] die als Hemmstoffe der Acetylcholinesterase wirken, darunter Dimetilan,[29]

und die verwandten Verbindungen Isolan, Pirimicarb und Triazamat.
Pharmazeutische Anwendungen als Acetylcholinesterasehemmer finden die quartären Ammoniumverbindungen Neostigmin[30], das aus 3-Dimethylaminophenol und Dimethylcarbamoylchlorid und anschließender Quaternisierung mit Methylbromid bzw. Dimethylsulfat erhalten wird[31]
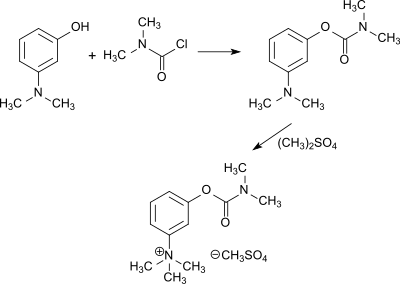
und Pyridostigmin, das aus 3-Hydroxypyridin und DMCC und anschließender Umsetzung mit Methylbromid zugänglich ist.[8]
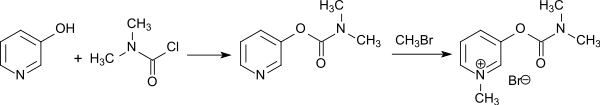
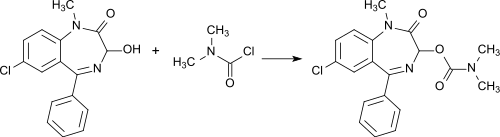
Auch bei der Synthese des Benzodiazepins Camazepam findet Dimethylcarbamoylchlorid Verwendung.[7]
Einzelnachweise
- Datenblatt Diemthylcarbamoylchlorid bei Sigma-Aldrich, abgerufen am 20. September 2016 (PDF).
- Datenblatt Dimethylcarbamoylchlorid bei AlfaAesar, abgerufen am 20. September 2016 (PDF) (JavaScript erforderlich).
- Eintrag zu Dimethylcarbamoylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, Boca Raton, FL, U.S.A. 2015, ISBN 978-1-4822-6097-7, S. 3–206.
- Eintrag zu Dimethylcarbamoyl Chloride bei TCI Europe, abgerufen am 20. September 2016.
- C.B. Kreutzberger, R.A. Olofson: Dimethylcarbamoyl Chloride. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rd319.
- Patent DOS2448015: Verfahren zur Herstellung des 3-N,N-Dimethylcarbamoyl-oxy-1-methyl-5-phenyl-7-chlor-1,3-dihydro-2H-1,4-benzodiazepin-2-on. Angemeldet am 22. Dezember 1975, veröffentlicht am 16. September 1976, Anmelder: Siphar S.A..
- Patent US2572579: Disubstituted carbamic acid esters of 3-hydroxy-1-alkyl-pyridinium salts. Angemeldet am 18. Mai 1948, veröffentlicht am 23. Oktober 1951, Anmelder: Hoffmann-La Roche Inc., Erfinder: R. Urban.
- W. Michler, C. Escherich: Ueber mehrfach substituirte Harnstoffe. In: Ber. Dtsch. Chem. Ges. Band 12, Nr. 1, 1879, S. 1162–1164, doi:10.1002/cber.187901201303.
- Eintrag zu dimethylcarbamoyl chloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 16. Dezember 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- R.P. Pohanish: Sittig’s Handbook of Toxic and Hazardous Chemicals and Carcinogens, 6th Edition. Elsevier, Amsterdam 2011, ISBN 978-1-4377-7869-4, S. 1045–1047.
- R.J. Slocombe, E.A. Hardy, J.H. Saunders, R.L. Jenkins: Phosgene derivatives. The preparation of isocyanates, carbamyl chlorides and cyanuric acid. In: J. Am. Chem. Soc. Band 72, Nr. 5, 1950, S. 1888–1891, doi:10.1002/ja01161a009.
- G. Karimipour, S. Kowkabi, A. Naghiha: New aminoporphyrins bearing urea derivative substituents: synthesis, characterization, antibacterial and antifungal activity. In: Braz. Arch. Biol. Technol. Band 58, Nr. 3, 2015, doi:10.1590/S1516-891320500024 (scielo.br).
- H. Babad, A.G. Zeiler: Chemistry of Phosgene. In: Chem. Rev. Band 73, Nr. 1, 1973, S. 75–91, doi:10.1021/cr60281a005.
- T. Saegusa, T. Tsuda, Y. Isegawa: Carbamoyl chloride formation from chloramine and carbon monoxide. In: J. Org. Chem. Band 36, Nr. 6, 1971, S. 858–860, doi:10.1021/jo00805a033.
- M. Stare, K. Laniewski, A. Westermark, M. Sjögren, W. Tian: Investigation on the formation and hydrolysis of N,N-dimethylcarbamoyl chloride (DMCC) in Vilsmeier reactions using /GC/MS as the analytical detection method. In: Org. Process Res. Dev. Band 13, Nr. 5, 2009, S. 857–862, doi:10.1021/op900018f.
- D. Levin: Potential toxicological concerns associated with carboxylic acid chlorination and other reactions. In: Org. Process Res. Dev. Band 1, Nr. 2, 1997, S. 182, doi:10.1021/op970206t.
- A. Queen: Kinetics of the hydrolysis of acyl chlorides in pure water. In: Canad. J. Chem. Band 45, Nr. 14, 1967, S. 1619–1629, doi:10.1139/v67-264.
- P. Jäger, C.N. Rentzea, H. Kieczka: Carbamates and Carbamoyl Chloride, in Ullmann’s Fine Chemicals. Wiley-VCH, Weinheim 2014, ISBN 978-3-527-33477-3, S. 57–58.
- Dimethylcarbamoyl Chloride, CAS No. 79-44-7. In: Report on Carcinogens, Thirteenth Edition. National Toxicology Program, Department of Health and Human Services, abgerufen am 25. September 2016.
- C.B. Kreutzberger, R.A. Olofson: Dimethylcarbamoyl Chloride. John Wiley&Sons, Ltd., 1. Februar 2007, abgerufen am 27. September 2016.
- P.F. De Cusati, R.A. Olofson: A simple synthesis of 1-(1,3-butadienyl)carbonates and carbamates. In: Tetrahedron Lett. Band 31, Nr. 10, 1990, S. 1405–1408, doi:10.1016/S0040-4039(00)88817-6.
- J.K. Lawson, Jr., J.A.T. Croom: Dimethylamides from alkali carboxylates and dimethylcarbamoyl chloride. In: J. Org. Chem. Band 28, Nr. 1, 1963, S. 232–235, doi:10.1021/jo1036a513.
- Patent US3597478: Preparation of tetramethylurea. Angemeldet am 14. September 1967, veröffentlicht am 3. August 1971, Anmelder: Nipak Inc., Erfinder: M.L. Weakly.
- Z. Arnold: The preparation of tetramethylformamidinium salts and their vinylogues. In: Coll. Czech. Chem. Commun. Band 24, 1959, S. 760–765, doi:10.1135/cccc19590760.
- H. Meerwein, W. Florian, N. Schön, G. Stopp: Über Säureamidacetale, Harnstoffacetale und Lactamacetale. In: Justus Liebigs Ann. Chem. Band 641, Nr. 1, 1961, S. 1–39, doi:10.1002/jlac.19616410102.
- H. Bredereck, F. Effenberger, Th. Brendle: Synthese und Reaktionen von Trisdimethylaminomethan. In: Angew. Chem. Band 78, Nr. 2, 1966, S. 147–148, doi:10.1002/ange.19660780212.
- Compendium of Pesticide Common Names. Alan Wood, abgerufen am 27. September 2016.
- Patent US3452043: Production of 1-N,N-dimethylcarbamoyl-5-methyl-3-N,N-dimethyl-carbamoyl-oxy-pyrazole. Angemeldet am 8. März 1967, veröffentlicht am 24. Juni 1969, Anmelder: J.R. Geigy A.G., Erfinder: T. Grauer, H. Urwyler.
- J.A. Aeschlimann, M. Reinert: Pharmacological action of some analogues of physostigmine. In: J. Pharmacol. Exp. Ther. Band 43, Nr. 3, 1931, S. 413–444.
- Patent US1905990: Disubstituted carbamic acid esters of phenols containing a basic constituent. Angemeldet am 8. April 1931, veröffentlicht am 25. April 1933, Anmelder: Hoffmann-La Roche Inc., Erfinder: J.A. Aeschlimann.

