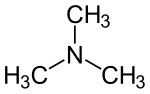
Trimethylamin
Trimethylamin ist ein farbloses brennbares Gas mit schon in starker Verdünnung intensivem fischartigem Geruch; in höheren Konzentrationen erinnert er stärker an den des chemisch nahe verwandten Ammoniaks. Es ist stark hygroskopisch, löst sich gut in Wasser und bildet darin eine mittelstarke Base. Es kommt als 40-prozentige wässrige Lösung, 33-prozentige Lösung in Ethanol und als druckverflüssigtes Gas in den Handel.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Trimethylamin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H9N | |||||||||||||||
| Kurzbeschreibung |
farbloses, widerwärtig fisch- oder tranartig riechendes Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 59,11 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
2,9 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Dipolmoment | ||||||||||||||||
| Brechungsindex |
1,3631 (0 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−23,6 kJ/mol[7] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
Zur großtechnischen Synthese von Trimethylamin setzt man Methanol mit Ammoniak bei Temperaturen von 350–450 °C und Drücken von 15–25 bar in Gegenwart von Aluminiumoxid (-silicat oder -phosphat) in Rohrreaktoren stufenweise um. Im ersten Schritt reagiert Methanol mit Ammoniak zu Methylamin. Dieses reagiert im Anschluss mit einem weiteren Äquivalent Methanol und bildet so Dimethylamin. Dieses sekundäre Amin kann daraufhin ein letztes Mal methyliert werden, um so Trimethylamin herzustellen.[8][9]
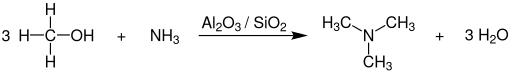
Als Nebenprodukte werden neben Wasser auch noch Methylamin und Dimethylamin gebildet, die durch mehrstufige Druck- sowie Extraktivdestillation abgetrennt werden müssen. Alternativ können diese erneut zur ersten Reaktionsstufe zurückgeführt werden, um die Gesamtausbeute an Trimethylamin deutlich zu erhöhen. Das Gewichtsverhältnis von Mono-, Di- und Trimethylamin bei dieser Reaktion beträgt durchschnittlich ca. 20:20:60.[8]
Die Produktionskapazität für Methylamine betrug 1996 weltweit ungefähr 830.000 Jahrestonnen.[9]
Mit reaktiveren Methylierungsmitteln wie Methyliodid oder Dimethylsulfat kann Ammoniak bei niedrigen Temperaturen methyliert werden. Allerdings erhält man auch hiermit Gemische der möglichen Methylierungsstufen einschließlich des quartären Tetramethylammoniumions.
Eigenschaften
Physikalische Eigenschaften
Bei Raumtemperatur ist Trimethylamin ein farbloses Gas. Es lässt sich durch Abkühlen oder Druckerhöhung verflüssigen. Trimethylamin ist gut löslich in Wasser und aliphatischen Alkoholen wie z. B. Methanol. Es hat einen unangenehmen, fisch- bzw. tran- bis ammoniakartigen Geruch, der schon bei Konzentrationen von 0,0005 bis 4,2 mg/m³ wahrnehmbar ist.
Chemische Eigenschaften
Trimethylamin löst sich sehr leicht in Wasser, die Lösung reagiert als Base. Das Molekül dissoziiert in wässriger Lösung nach:
Trimethylamin ist, wie viele Amine, eine mittelstarke Base. Mit Säuren bildet es ionisch aufgebaute Trimethyl-Ammonium-Salze, aus denen das Trimethylamin mit stärkeren Basen wieder freigesetzt werden kann.
Der höhere pKs-Wert von 9,81 – d. h. die stärkere Basizität – im Vergleich zum Ammoniak (9,25) erklärt sich aus dem +I-Effekt der drei Methylgruppen. Die dennoch schwächere Basizität im Vergleich zu den beiden Aminen mit weniger Methylgruppen – Methyl- und Dimethylamin mit pKs 10,66 bzw. 10,73 – lässt sich aus der sterischen Behinderung des freien Elektronenpaares am Stickstoffatom, das für die Basizität verantwortlich ist, erklären.
Sicherheitstechnische Kenngrößen
Trimethylamin bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −7 °C.[2][10] Der Explosionsbereich liegt zwischen 2,0 Vol.‑% (49 g/m3) als untere Explosionsgrenze (UEG) und 11,6 Vol.‑% (285 g/m3) als obere Explosionsgrenze (OEG).[2][10] Die Grenzspaltweite wurde mit 1,05 mm bestimmt.[2][10] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA. Die Zündtemperatur beträgt 190 °C.[10][2] Der Stoff fällt somit in die Temperaturklasse T4.
Verwendung
Hauptfolgeprodukt von Trimethylamin ist Cholinchlorid, das durch Umsetzung von Ethylenoxid mit einer wässrigen Trimethylaminhydrochlorid-Salzlösung oder durch Umsetzung von Trimethylamin mit 2-Chlorethanol (Ethylenchlorhydrin) hergestellt werden kann. Außerdem findet Trimethylamin Anwendung bei der Herstellung von Wachstumsregulatoren, Ionentauscherharzen und als Katalysator in der organischen Synthese.
Vorkommen in der Natur
Als Metabolit des Cholin-Stoffwechsels lässt sich Trimethylamin in vielen Organismen nachweisen. Höhere Konzentrationen entstehen beim mikrobiellen Abbau von Trimethylamin-N-oxid, das vor allem in Seefischen reichlich vorhanden ist[1], beispielsweise durch Bakterien der Gattungen Pseudomonas und Shewanella. Intensiver Trimethylamin-Geruch ("Heringslake") ist deshalb ein sicheres Indiz für mangelnde Frische. Trimethylamin entsteht weiterhin im Vaginalsekret und zersetztem männlichen Ejakulat. Unter den Ständerpilzen sind Brandpilze wie der Steinbrand (Tilletia caries) in der Lage, Trimethylamin zu produzieren und bei Befall von Weizen die Getreidekörner zu verderben. Schließlich produzieren einige Pflanzen Trimethylamin, beispielsweise Stinkender Gänsefuß (Chenopodium vulvaria) und Wald-Bingelkraut (Mercurialis perennis). Auch in den Blüten von Esskastanie, Weißdorn, Birne, Eberesche und weiteren verwandten Rosengewächsen und in Berberitzen findet sich das Amin. Bei den letztgenannten dient es vermutlich der Anlockung von Käfern als Bestäuber-Insekten (Cantharophilie). Schließlich ist Trimethylamin in Bucheckern enthalten. Abgeleitet vom Gattungsnamen der Rotbuche (Fagus) wird der Stoff deshalb auch als Fagin bezeichnet. Durch Röstung der Früchte wird die Giftwirkung abgebaut.
Bildung im menschlichen Darm
Trimethylamin wird auch im menschlichen Darm produziert. Hier entsteht es als Stoffwechselprodukt nach der Aufnahme von Phosphatidylcholin, Cholin und Carnitin, die sich besonders in Eiern und Fleisch finden. Verantwortlich sind hierfür diverse Darmbakterien, die vermehrt bei Menschen vorkommen, welche regelmäßig Fleisch konsumieren. Bei Vegetariern und Veganern ist die Anzahl der Trimethylamin-produzierenden Bakterien und Enzyme hingegen verringert.[11]
Trimethylamin wird gut resorbiert und in der Leber durch Flavin-haltige Monooxygenasen (FMO3) zu Trimethylamin-N-oxid (TMAO) verstoffwechselt. Der TMAO-Spiegel ist beim Menschen mit einem erhöhten Risiko für Herz-Kreislauf-Erkrankungen, besonders Herzinfarkt und Schlaganfall assoziiert. TMAO hat pro-arteriosklerotische Eigenschaften und steigert die Konzentration Makrophagen-spezifischen Cholesterins und die Bildung von Schaumzellen in der Gefäßwand. Darüber hinaus steigert TMAO die Plättchen-Aktivität.
Studien zeigen, dass die verminderte TMAO-Produktion bei Vegetariern und Veganern auch ihr Risiko für Herz-Kreislauf-Erkrankungen senkt.[12]
Bei Gabe von Antibiotika sank der TMAO-Blutspiegel. Die TMA-Bildung kann durch 3,3-Dimethyl-1-butanol gehemmt werden.[13]
Wirkung auf den menschlichen Körper
Trimethylamin gilt als schwach giftig. Es wirkt reizend auf Augen und Atmungsorgane. Bei Geruchswahrnehmung kann schon eine gesundheitsgefährdende Konzentration vorliegen. Beim Verschlucken können die Wirkungen von Erbrechen mit Bauchschmerzen bis zu Verätzungen führen. Verätzungen können bis hin zur Zerstörung von Haut, Augen, Atem- und Verdauungswegen führen.
Siehe auch
- Trimethylaminurie („Fischgeruch“-Syndrom)
Weblinks
Einzelnachweise
- Eintrag zu Trimethylamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Mai 2014.
- Eintrag zu Trimethylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dipole Moments, S. 9-58.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-504.
- Eintrag zu Trimethylamine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-50-3 bzw. Trimethylamin), abgerufen am 17. September 2019.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- Marco Bosch, Roderich Röttger, Jan Eberhardt, Thomas Krug, Theodor Weber, Karl-Heinz Ross, Manfred Julius: Formkörper enthaltend ein Alumosilikat und Aluminiumoxid und Verfahren zur kontinuierlichen Herstellung von Methylaminen. In: Google Patents. BASF SE, 14. November 2012, abgerufen am 2. Mai 2019.
- Hans-Jürgen Arpe: Industrielle Organische Chemie - Bedeutende Vor- und Zwischenprodukte. 6. Auflage. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 55.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- Aleksandra Tomova, Igor Bukovsky, Emilie Rembert, Willy Yonas, Jihad Alwarith: The Effects of Vegetarian and Vegan Diets on Gut Microbiota. In: Frontiers in Nutrition. Band 6, 2019, ISSN 2296-861X, doi:10.3389/fnut.2019.00047 (frontiersin.org [abgerufen am 29. März 2021]).
- Aleksandra Tomova, Igor Bukovsky, Emilie Rembert, Willy Yonas, Jihad Alwarith: The Effects of Vegetarian and Vegan Diets on Gut Microbiota. In: Frontiers in Nutrition. Band 6, 2019, ISSN 2296-861X, doi:10.3389/fnut.2019.00047 (frontiersin.org [abgerufen am 29. März 2021]).
- Herbert Tilg: A Gut Feeling about Thrombosis. In: New England Journal of Medicine. Band 374, Nr. 25, 23. Juni 2016, S. 2494–2496, doi:10.1056/NEJMcibr1604458.



