Tris(dimethylamino)methan
Tris(dimethylamino)methan (TDAM) ist der einfachste Vertreter von Tris(dialkylamino)methanen der allgemeinen Formel (R2N)3CH, in dem drei der vier Wasserstoffatome des Methans durch Dimethylaminogruppen (-N(CH3)2) ersetzt sind.[4] Tris(dimethylamino)methan kann sowohl als Amin, als auch als Orthoamid aufgefasst werden.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
methan_Struktur.svg.png.webp) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tris(dimethylamino)methan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H19N3 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 145,25 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Siedepunkt |
42–43 °C bei 16 hPa[1] | ||||||||||||||||||
| Löslichkeit |
mischbar mit unpolaren, aprotischen, wasserfreien Lösungsmitteln[3] | ||||||||||||||||||
| Brechungsindex |
1,4360 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
TDAM ist eine starke Base und kann als Formylierungsmittel, als Reagenz für die Aminomethylenierung und als Quelle für das basische Carben Bis(dimethylamino)carben der Formel R2N-C:-NR2 eingesetzt werden.[3]
Vorkommen und Darstellung
Tris(dimethylamino)methan entsteht bei der Reaktion von N,N,N′,N′-Tetramethylformamidiniumchlorid[4][5][6] oder Bis(dimethylamino)acetonitril[7] mit Lithiumdimethylamid oder Natriumdimethylamid mit Ausbeuten zwischen 55 und 84 %.[3]

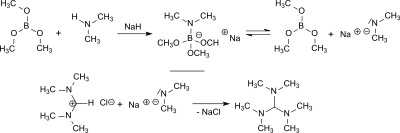
Aus Dimethylamin und Natriumhydrid entsteht in Gegenwart von Borsäuretrimethylester in situ Natriumdimethylamid, das mit N,N,N′,N′-Tetramethylformamidiniumchlorid in 84%iger Ausbeute und mit Bis(dimethylamino)acetonitril in 77%iger Ausbeute TDAM bildet.[8]
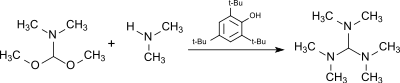
Die Umsetzung von Dimethylformamid-dimethylacetal (aus DMF-Dimethylsulfat-Komplex und Natriummethanolat[9]) mit Dimethylamin in Gegenwart des sauren, gegen Alkylierungsmittel weitgehend stabilen Katalysators 2,4,6-Tri-tert-butylphenol erzeugt Tris(dimethylamino)methan.[10]
TDAM wird in guter Ausbeute (83 %) bei der Reaktion von DMF mit Tetrakis(dimethylamino)titan gebildet.[11]
titan.svg.png.webp)
Aus N,N,N′,N′,N′′,N′′-Hexamethylguanidiniumchlorid (über das aus Tetramethylharnstoff und Phosgen entstehende N,N,N′,N′-Tetramethyl-chloroformamidinium-chlorid und Dimethylamin einfach erhältlich[12]) entsteht unter Einwirkung des Reduktionsmittels Natrium-bis(2-methoxyethoxy)-aluminiumhydrid (Red-Al) Tris(dimethylamino)methan in 53%iger Ausbeute.[13]
Natriumhydrid und Borsäuretrimethylester reduzieren N,N,N′,N′,N′′,N′′-Hexamethylguanidiniumchlorid in 80%iger Ausbeute zu TDAM um.[8]
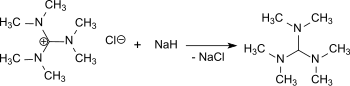
Eigenschaften
Tris(dimethylamino)methan ist eine klare, farblose oder schwach gelb gefärbte Flüssigkeit mit stark aminartigem Geruch. Die Verbindung ist mit vielen nicht-polaren aprotischen und wasserfreien Lösungsmitteln beliebig mischbar. Mit protischen Lösungsmitteln, wie Wasser und Alkoholen, aber auch mit schwach CH-aziden Substanzen, wie Aceton oder Acetonitril reagiert TDAM beim Erhitzen.[3]
Bei Erhitzen auf Temperaturen von 150–190 °C erfolgt Zersetzung unter Bildung von Tetrakis(dimethylamino)ethen,[14]
ethen.svg.png.webp)
einem starken Elektronendonator.[15]
Anwendungen
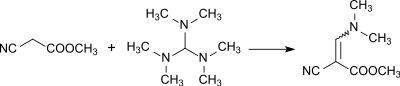
Tris(dimethylamino)methan dissoziiert in N,N,N′,N′-Tetramethylformamidinium-Kationen und Dimethylamid-Anionen, die von CH- und NH-aciden Verbindungen Protonen abstrahieren. Die so gebildeten Anionen addieren an die Formamidiniumkationen unter Bildung von Addukten, die wiederum Dimethylamin eliminieren und im Sinne einer Aminomethylenierung zu Dimethylaminomethylen (= CH-N(CH3)2-Verbindungen) bzw. zu Amidinen reagieren.[16]
Reaktion zu Dimethylaminomethylen:
Reaktion zu Amidinen:

Die Aminomethylenierung liefert Zwischenprodukte für die Synthese von Heterocyclen, wie z. B. Pyrimidine, Pyrazole, 1,4-Dihydropyridine und Indole.
Durch längeres Erhitzen von TDAM mit Selen in Xylol ist N,N,N′,N′-Tetramethylselenoharnstoff zugänglich, wobei Bis(dimethylamino)carben als Zwischenstufe vermutet wird.[17]

Einzelnachweise
- Datenblatt Tris(dimethylamino)methane bei Sigma-Aldrich, abgerufen am 4. Dezember 2016 (PDF).
- Eintrag zu Tris(dimethylamino)methane bei TCI Europe, abgerufen am 10. Dezember 2016.
- W. Kantlehner: Tris(dimethylamino)methane. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rt403.
- H. Bredereck, F. Effenberger, T. Brendle: Synthese und Reaktionen von Trisdimethylaminomethan. In: Angew. Chem. Band 78, Nr. 2, 1966, S. 147–148, doi:10.1002/ange.19660780212.
- Patent DE1217391: Verfahren zur Herstellung von Tris-dimethylaminomethan. Angemeldet am 29. September 1964, veröffentlicht am 8. Dezember 1966, Anmelder: H. Bredereck, Erfinder: H. Bredereck, F. Effenberger, T. Brendle.
- H. Bredereck, F. Effenberger, T. Brendle, H. Muffler: Orthoamide, V. Synthese von Tris-dialkylamino-methanen. In: Chem. Ber. Band 101, Nr. 5, 1968, S. 1885–1888, doi:10.1002/cber.19681010541.
- W. Kantlehner, T. Maier, P. Speh: Tris-[dialkylamino]-methane und Tetraalkylformamidinium-thiocyanate aus Bis-[dialkylamino]-acetonitrilen. In: Synthesis. Band 5, 1979, S. 342–343, doi:10.1055/s-1979-28671.
- W. Kantlehner, R. Stieglitz, M. Hauber, E. Haug, C. Regele: Orthoamide. LII Beiträge zur Synthese von Orthocarbonsäureamiden. In: J. prakt. Chem. Band 342, Nr. 3, 2000, S. 256–268, doi:10.1002/(SICI)1521-3897(200003)342:3<256::AID-PRAC256>3.0.CO;2-G.
- H. Bredereck, F. Effenberger, G. Simchen: Reaktionsfähige Säureamid-Dimethylsulfat-Komplexe. In: Angew. Chem. Band 73, Nr. 14, 1961, S. 493, doi:10.1002/ange.19610731407.
- Patent DE2214497: Verfahren zur Herstellung eines aminosubstituierten Methanderivates. Angemeldet am 24. März 1972, veröffentlicht am 5. Oktober 1972, Anmelder: F. Hoffmann-La Roche & Co. AG, Erfinder: W. Leimgruber, A.E. Wick.
- H. Weingarten, W.A. White: A novel amination reaction of carboxylic acid derivatives with tetrakis(dimethylamino)titanium. In: J. Am. Chem. Soc. Band 88, Nr. 4, 1966, S. 850–850, doi:10.1021/ja00956a049.
- W. Kantlehner, E. Haug, W.W. Mergen, P. Speh, T. Maier, J.J. Kapassakalidis, H.J. Bräuner, H. Hagen: Ein Herstellungsverfahren für N,N,N′,N′,N′′,N′′-Hexaalkylguanidinium-chloride. In: Synthesis. Band 11, 1983, S. 904–905, doi:10.1055/s-1983-30558.
- W. Kantlehner, P. Speh, H.J. Bräuner: Eine einfache Synthese für Tris[dialkylamino]methane. In: Synthesis. Band 11, 1983, S. 905, doi:10.1055/s-1983-30559.
- H. Bredereck, F. Effenberger, H.J. Bredereck: Eine neue Synthese von Tetra-(dimethylamino)-äthylen. In: Angew. Chem. Band 78, Nr. 21, 1966, S. 984, doi:10.1002/ange.19660782113.
- N. Wiberg, J.W. Buchler: Tetrakis(dimethylamino)-äthylen: ein starker Elektronendonator. In: Angew. Chem. Band 74, Nr. 14, 1962, S. 490–491, doi:10.1002/ange.19620741410.
- H. Bredereck, F. Effenberger, T. Brendle: Synthese und Reaktionen von Trisdimethylaminomethan. In: Angew. Chem. Band 78, Nr. 2, 1966, S. 147–148, doi:10.1002/ange.19660780212.
- W. Kantlehner, M. Hauber, M. Vettel: Orthoamide.IL. Umsetzungen von Orthoamid-Derivaten mit Schwefel und Selen, Synthesen von 1,3-Thiazol- und 1,3-Selenazolderivaten. In: J. prakt. Chem. Band 338, Nr. 1, 1996, S. 403–413, doi:10.1002/prac.19963380180.

