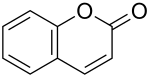
Cumarin
Cumarin oder Kumarin ist ein natürlich vorkommender, aromatischer sekundärer Pflanzenstoff aus der Gruppe der Benzopyrone mit eigentümlichem, angenehm würzigem Geruch. Wird es in größeren Mengen eingenommen, ist es gesundheitsschädlich. Verbindungen, die das Strukturgerüst des Cumarins enthalten, werden auch unter der Sammelbezeichnung Cumarine geführt; die Derivate des 4-Hydroxycumarins besitzen als 4-Hydroxycumarine Bedeutung als blutgerinnungshemmende Arzneistoffe und Schädlingsbekämpfungsmittel. Der Name leitet sich vom ins Spanische übernommenen Tupí-Wort cumarú ‚Tonkabohnenbaum‘ ab.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Cumarin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C9H6O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, brennend schmeckende Prismen, mit süßem, würzig, heuartigem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 146,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
0,94 g·cm−3 (20 °C)[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
298–302 °C[3] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen
Cumarin kommt nicht nur in verschiedenen Ruchgräsern und Schmetterlingsblütlern wie dem Gelben Steinklee (Melilotus officinalis), im Waldmeister (Galium odoratum) und der Steinweichsel (Prunus mahaleb) vor. Beispielsweise auch Datteln sowie die Tonkabohne (Dipteryx odorata) und die Zimt-Sorten Cassiazimt (Cinnamomum cassia), indonesischem Zimt (Cinnamomum burmannii) und vietnamesischem Zimt (Cinnamomum loureiroi) enthalten Cumarin.[5]


 Waldmeister kurz vor der Blüte
Waldmeister kurz vor der Blüte Tonkabohne als Gewürz
Tonkabohne als Gewürz
Cumarin und nah verwandte Stoffe sind die wesentlichen Komponenten des typischen Geruchs von Waldmeister und dem beim Trocknen von Gras entstehenden Heugeruch. In der Pflanze ist Cumarin häufig glycosidisch gebunden und wird erst bei Verletzung der Pflanze beziehungsweise beim Welken durch Abspaltung des Zuckers freigesetzt. Kommen das Glycosid und die zugehörige Glycosidase zusammen, zum Beispiel durch Zerstörung von Pflanzenzellen oder bei Verwesung, wird das Glycosid hydrolytisch abgespalten und das Aglykon, hier das Cumarin, frei und in diesem Fall zum Geruchsstoff.
Geschichte
Cumarin wurde erstmals im Jahre 1813 von A. Vogel aus München, der es zunächst für Benzoesäure hielt, und vom Franzosen Jean-Baptiste-Gaston Guibourt 1820, der es als eigenständige Substanz erkannte, aus Tonkabohnen isoliert. 1846 ermittelte H. Bleibtreu die richtige Zusammensetzung und die narkotische Wirkung. 1868 gelang die erste synthetische Herstellung durch William Henry Perkin, worauf es 1876 erstmals vermarktet wurde. Ein Durchbruch auf dem Parfümmarkt und der Verwendung künstlicher Duftstoffe war das 1881 herausgekommene Parfüm Fougère Royale (deutsch: königlicher Farn) von House of Houbigant, das auf Cumarin basierte und sehr erfolgreich war.[6] Seit 1954 ist Cumarin als Aromastoff in den USA verboten, da in Tierexperimenten toxische Wirkungen festgestellt wurden.[7]
Rechtliche Grundlagen
In Deutschland wurde die Zugabe von Cumarin als Aroma durch die Umsetzung der Richtlinie 88/388/EWG, in der deutschen Aromenverordnung zum 22. Dezember 1981 verboten, später wurde der Grenzwert für Cumarin als Lebensmittelzusatzstoff gemäß Anlage 4 zu § 2 Abs. 3 der überarbeiteten Aromenverordnung (in der Fassung von 1991) bei aktuell 2 mg pro Kilogramm zubereiteter Speise festgelegt. Das Verbot von Cumarin wurde durch die Aromenverordnung 1991 für die Verwendung als Aromastoff in Zubereitungen, die nicht der Ernährung dienen, wie z. B. in Parfums oder Kerzen, aufgehoben. Aktuell wird die erlaubte Menge an Cumarin in Lebensmitteln innerhalb der EU einheitlich durch den Anhang III der Verordnung (EG) Nr. 1334/2008 (Aromenverordnung) geregelt. Die Höchstwerte sind für
- traditionelle und/oder saisonale Backwaren, bei denen Zimt in der Kennzeichnung angegeben ist: 50 mg pro kg
- Frühstücksgetreideerzeugnisse einschließlich Müsli: 20 mg pro kg
- Feine Backwaren außer traditionelle und/oder saisonale Backwaren, bei denen Zimt in der Kennzeichnung angegeben ist: 15 mg pro kg
- Dessertspeisen: 5 mg pro kg
Den Zusatz von Cumarin zu Tabakprodukten verbietet die deutsche Tabakverordnung, in der Schweizer Tabakverordnung darf der Gesamtgehalt 0,1 Massenprozent nicht übersteigen. Im Winter 2006/2007 machte Cumarin in Deutschland Schlagzeilen, als durch den in Weihnachtsgebäck verwendeten Zimt eine gegenüber dem gesetzlichen Höchstwert vielfach erhöhte Menge des Aromas gefunden wurde.
Synthese
Ausgangsstoff für Cumarin in der Pflanze ist die Zimtsäure, aus der es durch Hydroxylierung, Glycosidierung und Cyclisierung gebildet wird. Der Stoff seinerseits ist Grundkörper zahlreicher Naturstoffe, unter anderem des Aesculins, der Furocumarine und des Umbelliferons.
Synthetisch wird Cumarin nach Perkin (Perkinsche Synthese) aus Salicylaldehyd und Essigsäureanhydrid hergestellt:[2]
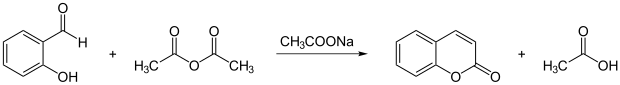
Ein alternatives Herstellungsverfahren ist der Raschig-Prozess aus o-Kresol.[2]
Analytik
Die zuverlässige qualitative und quantitative Bestimmung von Cumarin gelingt nach angemessener Probenvorbereitung durch Kopplung der HPLC bzw. Gaschromatographie mit der Massenspektrometrie.[8][9][10]
Verwendung
Cumarin dient vor allem als Duftstoff in der Parfümerie.[11] Daneben wird es (in Form von welken Waldmeisterblättern) auch in der Küche, beispielsweise zum Aromatisieren von Maibowle verwendet.
Die Tonkabohne enthält größere Mengen an Cumarin, das daher oft daraus gewonnen wird. Wegen der Eigenschaft von Cumarin, den Geschmack der echten Vanille vorzutäuschen, wird es seit Anfang des 20. Jahrhunderts fälschlich als mexikanische Vanille bezeichnet und als Ersatz für die Gewürzvanille (Vanilla planifolia) verwendet. Die Verwendung von Cumarin als Aromastoff ist jedoch in einigen Gebieten (zum Beispiel USA, Europäische Union) gesetzlich eingeschränkt.[12] In der Europäischen Union ist Cumarin nach der Verordnung (EG) Nr. 1334/2008, der sogenannten Aromenverordnung, ein Stoff, der Lebensmitteln nicht als solcher zugesetzt werden darf.[13] Wenn Cumarin von Natur aus in Aromen oder Lebensmittelzutaten mit Aromaeigenschaften vorkommt, dürfen bestimmte Höchstmengen im Lebensmittel nicht überschritten werden; die zulässigen Höchstmengen liegen dann je nach Art des Lebensmittels zwischen 5 mg/kg bei Dessertspeisen und 50 mg/kg bei traditionellen und/oder saisonalen Backwaren, sofern hier Zimt als Zutat in der Kennzeichnung angegeben ist.[14]
Cumarin wird über die Haut gut aufgenommen. In Kosmetika darf es in Europa unbegrenzt eingesetzt werden, muss jedoch ab einer bestimmten Menge deklariert werden.
Des Weiteren wird Cumarin als Substrat bei der Markerreaktion für CYP2A6 im in vitro-Metabolismus verwendet. Dabei wird es zu 7-Hydroxycumarin (Umbelliferon) verstoffwechselt.
Cumarine finden ebenso als photolabile Schutzgruppe Anwendung.
In Farbstofflasern finden Cumarin-Farbstoffe als Lasermedium Verwendung.
Derivate
Die blutgerinnungshemmenden Cumarin-Derivate Phenprocoumon, Warfarin und Ethylbiscoumacetat werden in der Medizin bei entsprechend risikobehafteten Personen eingesetzt, um beispielsweise ischämische Schlaganfälle zu verhindern. Außerdem werden sie als Rodentizide vor allem zur Bekämpfung von Ratten eingesetzt, da sie in entsprechend hoher Dosierung zu tödlichen inneren Blutungen führen. In der Naturheilkunde werden Extrakte aus Eschenrinde verwendet, deren Wirkung möglicherweise dem Cumarinderivat Fraxin zugeschrieben werden kann.[15]
Stark fluoreszierende Cumarin-Derivate finden darüber hinaus Anwendung als effektive Farbstoffe in Farbstofflasern und optischen Aufhellern. Als Farbstofflaser emittieren sie im blauen bis in den grünen Spektralbereich des Lichtspektrums.
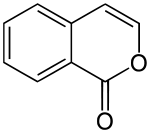
Das Isocumarin ist ein Stellungisomer des Cumarins, bei dem die Carbonylgruppe und das Sauerstoffatom vertauscht sind.[16] Einige Dihydro-Isocumarin-Derivate, wie z. B. das Phyllodulcin, das in den Blättern der Gartenhortensie vorkommt, haben einen süßen Geschmack. Die Süßkraft von Phyllodulcin im Vergleich zu Saccharose beträgt 250.[17]
Als Ersatzstoff in der Industrie werden Dihydrocumarin und 6-Methylcumarin verwendet.[18]
Physiologie und Toxikologie
Die Kinetik ist stark artspezifisch. Der Hauptstoffwechselweg beim Menschen ist die Hydroxylierung an Position 7 zum ungiftigen Umbelliferon, katalysiert durch das Enzym CYP2A6. Bei Ratten dominiert hingegen der Stoffwechsel via 3,4-Epoxidierung.[19][20][21] In wässriger, glutathionfreier Umgebung lagert sich das Epoxid (unter Ringöffnung und Decarboxylierung) rasch zum lebergiftigen o-Hydroxyphenylacetaldehyd (o-HPA) um.[22] Dessen Oxidation zur o-Hydroxyphenylessigsäure stellt einen Entgiftungsschritt dar. Die beiden letzten Metaboliten sind in geringen Mengen auch im Menschen nachweisbar.[19]
In größeren Mengen aufgenommen verursacht Cumarin heftige Kopfschmerzen, Erbrechen, Schwindel und Schlafsucht. Noch höhere Dosen können zu zentraler Lähmung, Atemstillstand und Koma führen. Daneben werden im Tierversuch Leber- und Nierenschädigungen beobachtet. Für Menschen besteht allerdings durch cumarinhaltige Nahrungsmittel und Kosmetika nur in Ausnahmefällen ein hepatotoxisches Risiko.[23] Die letale Dosis (LD50) liegt peroral bei der Ratte bei 293 mg/kg und beim Meerschweinchen bei 202 mg/kg Körpergewicht. Aus Tierversuchen leitet sich der Verdacht ab, dass Cumarin in sehr hohen Mengen krebserregend sei. Mehrere Studien an menschlichen Zelllinien deuten hingegen nicht auf derartige Wirkungen im menschlichen Organismus hin.[24][25][26]
Als TDI (tolerable daily intake, tolerierte Tagesdosis) geht aus Studien des Bundesinstituts für Risikobewertung (BfR) von Anfang 2006 eine Menge von 0,1 Milligramm pro Kilogramm Körpergewicht pro Tag hervor. Diesen TDI-Wert hat das BfR auf Basis neuer Daten zur Aufnahme und Bioverfügbarkeit von Cumarin im September 2012 bestätigt. Gleichzeitig weist das BfR darauf hin, dass Überschreitungen des TDI-Wertes nur möglich sind, wenn große Mengen an Zimtgewürzen verzehrt werden. In der Vorweihnachtszeit ist das möglich, wenn Cassiazimt zum Backen benutzt wird.[27] Bei Kleinkindern mit einem Körpergewicht von 15 kg wäre laut BfR der TDI-Wert bei einem Verzehr von 6 Zimtsternen oder 100 g Lebkuchen ausgeschöpft.[28] Handelsübliches Zimtgebäck verschiedener Hersteller enthielt bei einer Untersuchung 2006 22–77 mg/kg Cumarin. Auch Zimtkapseln für Diabetiker sind in dieser Hinsicht problematisch.[29] Einen eindeutigen Beleg für die angebliche Gefährlichkeit von Cumarin beim normalen Gebrauch von cumarinhaltigen Gewürzen gibt es allerdings nicht. In allen Studien trat eine gesundheitschädigende Wirkung erst nach extremen Überdosierungen bei Versuchen an Ratten auf.
Für die bekannte Maibowle aus Waldmeister sollen höchstens 3 g Kraut je Liter Bowle verwendet werden. In dieser geringen Menge ist das enthaltene Cumarin für erwachsene Menschen nicht gesundheitsschädlich.
Während Cumarin selbst keine gerinnungshemmenden Eigenschaften besitzt, kann es bei einer unsachgemäßen Silo-Lagerung von Grasschnitt zu einem Pilzbefall cumarinhaltiger Gräser kommen, wodurch Cumarin-Derivate (Bis-Hydroxycumarine) gebildet werden, die diese Wirkung zeigen. Solches kontaminiertes Futter kann zum Tod der damit gefütterten Tiere führen, da Bis-Hydroxycumarine – als Antagonisten des Vitamin K – die Synthese der in der Leber gebildeten Blutgerinnungsfaktoren (II, VII, IX, X) durch Enzymhemmung beeinträchtigen. In der Trocknung, der Gewinnung von Heu, hingegen wandeln sich die Cumarin-Glycoside in reines Cumarin um und sind unbedenklich. So dienen Heublumen, die Feinanteile des Heus, als traditionelles Heilmittel.[30]
Insektenschutz
Cumarin, etwa in Form von Duftendem Mariengras, wirkt moskitoabweisend.[31] Bei Steinklee, einigen Gräsern und Waldmeister gelten aus der Vakuole freigesetzte Cumarine als Fraßschutz.
Weblinks
- Herstellung von Maibowle und chemischer Hintergrund
- BfR: Fragen und Antworten zu Cumarin in Zimt und anderen Lebensmitteln; (09/2012).
- BfR: Neue Erkenntnisse zu Cumarin im Zimt (PDF; 86 kB); vom 27. September 2012.
Einzelnachweise
- Eintrag zu COUMARIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. Februar 2020.
- Eintrag zu Cumarin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- Eintrag zu Cumarin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Datenblatt Cumarin (PDF) bei Merck, abgerufen am 23. März 2011.
- Yan-Hong Wang, Bharathi Avula u. a.: Cassia Cinnamon as a Source of Coumarin in Cinnamon-Flavored Food and Food Supplements in the United States. In: J. Agric. Food Chem. 61(18), 2013, S. 4470–4476, doi:10.1021/jf4005862.
- D. Lowe, Das Chemiebuch, Librero 2017, S. 176
- BfR: Verbraucher, die viel Zimt verzehren, sind derzeit zu hoch mit Cumarin belastet. Stellungnahme des Bundesinstituts für Risikobewertung vom 16. Juni 2006 (PDF; 136 kB).
- Z. Ren, B. Nie, T. Liu et al.: Simultaneous Determination of Coumarin and Its Derivatives in Tobacco Products by Liquid Chromatography-Tandem Mass Spectrometry. In: Molecules. 21(11), 2016, pii: E1511, PMID 27834935.
- G. Zhao, C. Peng, W. Du, S. Wang: Pharmacokinetic study of eight coumarins of Radix Angelicae Dahuricae in rats by gas chromatography-mass spectrometry. In: Fitoterapia. 89, 2013, 250–6, PMID 23774663.
- B. Li, X. Zhang, J. Wang et al.: Simultaneous characterisation of fifty coumarins from the roots of Angelica dahurica by off-line two-dimensional high-performance liquid chromatography coupled with electrospray ionisation tandem mass spectrometry. In: Phytochem Anal. 25(3), 2014, 229–40, PMID 24481589.
- Juliane Daphi-Weber, Heike Raddatz, Rainer Müller: Untersuchung von Riechstoffen – Kontrollierte Düfte, S. 94–95, in Band V der Reihe HighChem hautnah – Aktuelles aus der Lebensmittelchemie (Herausgegeben von der Gesellschaft Deutscher Chemiker) 2010, ISBN 978-3-936028-64-5.
- Europäische Behörde für Lebensmittelsicherheit (EFSA): Opinion of the Scientific Panel on food additives, flavourings, processing aids and materials in contact with food (AFC) related to Coumarin; PDF.
- Art. 6 Abs. 1 der Verordnung (EG) Nr. 1334/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über Aromen und bestimmte Lebensmittelzutaten mit Aromaeigenschaften zur Verwendung in und auf Lebensmitteln (konsolidierte Fassung 2019) mit Anhang III, Teil A. Ein Verstoß, also auch das fahrlässige Zusetzen stellt in Deutschland nach § 58 Abs. 2a Ziff. 1 LFGB eine Straftat dar.
- Art. 6 Abs. 2 mit Anhang III Teil B Verordnung (EG) Nr. 1334/2008 des Europäischen Parlaments und des Rates vom 16. Dezember 2008 (Aromenverordnung).
- Takaaki Yasuda, Mai Fukui, Takahiro Nakazawa, Ayumi Hoshikawa, Keisuke Ohsawa: Metabolic Fate of Fraxin Administered Orally to Rats. In: J. Nat. Prod. 2006, 69(5), S. 755–757 (doi:10.1021/np0580412).
- Eintrag zu Isocumarine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. Februar 2018.
- H.-D. Belitz et al.: Lehrbuch der Lebensmittelchemie. 5. Aufl., Springer, Berlin u. a. 2001, ISBN 978-3-540-41096-6, S. 431–432.
- Dolf De Rovira, Sr.: Dictionary of Flavors. Third Edition, Wiley, 2017, ISBN 978-1-118-85641-3, S. 80.
- S. L. Born, D. Caudill, B. J. Smith, L. D. Lehman-McKeeman: In vitro kinetics of coumarin 3,4-epoxidation: application to species differences in toxicity and carcinogenicity. In: Toxicol. Sci.. 58, Nr. 1, 2000, S. 23–31. PMID 11053537.
- Born SL, Caudill D, Fliter KL, Purdon MP: Identification of the cytochromes P450 that catalyze coumarin 3,4-epoxidation and 3-hydroxylation. In: Drug Metab. Dispos.. 30, Nr. 5, 2002, S. 483–487. PMID 11950775.
- L. B. von Weymarn, S. E. Murphy: CYP2A13-catalysed coumarin metabolism: comparison with CYP2A5 and CYP2A6. In: Xenobiotica. 33, Nr. 1, 2003, S. 73–81. PMID 12519695.
- S. L. Born, J. K. Hu, L. D. Lehman-McKeeman: o-hydroxyphenylacetaldehyde is a hepatotoxic metabolite of coumarin. In: Drug Metab. Dispos.. 28, Nr. 2, 2000, S. 218–223. PMID 10640521.
- Rudolf Hänsel, Otto Sticher: Pharmakognosie – Phytopharmazie, Springer, Heidelberg 2009, ISBN 978-3-642-00962-4, S. 1081.eingeschränkte Vorschau in der Google-Buchsuche
- Weber, US. et al. (1998): Antitumor-activities of coumarin. In: Res. Commun. Mol. Pathol. Pharmacol. 99 (2), S. 193–206; PMID 9583093.
- C. M. Elinos-Báez et al. (2005): Effects of coumarin and 7OH-coumarin on bcl-2 and Bax expression in two human lung cancer cell lines in vitro. In: Cell Biol. Int. 29 (8), S. 703–708. PMID 15964220; doi:10.1016/j.cellbi.2005.04.003.
- Simon Mills, Kerry Bone: Principles and Practices of Phytotherapy. Churchill Livingstone, Edinburgh 1999, 2000, ISBN 978-0-443-06016-8.
- K. Abraham, F. Wöhrlin u. a.: Toxicology and risk assessment of coumarin: focus on human data. In: Molecular nutrition & food research. Band 54, Nummer 2, Februar 2010, S. 228–239, doi:10.1002/mnfr.200900281. PMID 20024932. (Review).
- Cassia-Zimt mit hohen Cumaringehalten nur maßvoll verzehren – BfR.
- Gesundheitsrisiko nicht auszuschließen. Pharmazeutische Zeitung 44/2006.
- Vergl. Foin Coupé (Heugeruch). In: Fred Winter: Riechstoffe und Parfumierungstechnik: Genesis, Charakteristik und Chemie der Riechstoffe unter Besonderer Berücksichtigung Ihrer Praktischen Verwendung zur Herstellung Komplexer Riechstoff-Gemische. Springer-Verlag, 2013, ISBN 978-3-7091-5731-2, S. 319 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Sweet-smelling secrets of mosquito-repellent grass In: BBC News. 19. August 2015.
