Caged-Verbindungen
caged-Verbindungen (engl. cage Käfig) sind chemische Verbindungen, die bei Bestrahlung mit Licht bestimmter Wellenlängen eine andere Substanz freisetzen. Die deutsche Übersetzung Käfigverbindung für diese Stoffe ist im wissenschaftlichen Sprachgebrauch nicht üblich.
Das Hauptanwendungsgebiet der caged-Verbindungen ist die biochemische und zellbiologische Forschung.[1][2] Biologisch aktive Verbindungen werden mit einer photolabilen Schutzgruppe ("cage") ausgestattet und verlieren somit temporär ihre biologische Funktion. Mittels Lichteinstrahlung wird die photolabile Schutzgruppe irreversibel abgespalten und die zuvor inaktive Verbindung weist wieder eine biologische Aktivität auf.[3]
Caged-Verbindungen werden dazu verwendet, Effektoren zu einer bestimmten Zeit an einem bestimmten Ort freizusetzen, wenn deren direkte Applikation schwierig (z. B. im Inneren einer Zelle) oder zu langsam ist, um die gewünschte Konzentration am Wirkort zu erreichen. Die inaktive caged-Verbindung kann sich dagegen auch durch langsame Diffusion am Ziel anreichern und bei anschließender Belichtung eine genügende Menge Effektor in kurzer Zeit freisetzen. Durch die Verwendung von intensiven Blitzlampen oder Lasern ist es möglich, einen biochemischen Prozess, z. B. eine enzymatisch katalysierte Reaktion oder eine Signalübertragung, sehr schnell zu starten (Piko- bis Millisekunden).
Als erste biochemische Arbeit mit caged-Verbindungen wird oft eine Publikation über caged-ATP von J. H. Kaplan et al. aus dem Jahr 1978 genannt[4], aber schon kurz vorher hatten J. Engels et al. die Synthese und Anwendung von durch Licht freisetzbaren cAMP beschrieben.[5]
Anwendungsbereich von caged-Verbindungen
Heute werden caged-Verbindungen für viele verschiedene Zwecke verwendet.[1]
Mit ihnen kann man u. a.
- Substrate für Enzyme freisetzen und die anschließende Reaktion des Enzyms zeitaufgelöst verfolgen[6],
- Signalmoleküle in einer Zelle freisetzen und beobachten, wie diese auf das Signal reagiert,
- die Expression von spezifischen Genen an- oder abschalten.[7]
Anforderungen an caged-Verbindungen
Caged-Verbindungen sind photolysierbare Verbindungen, d. h. sie gehen bei der Bestrahlung mit Licht eine chemische Reaktion ein. Damit sich eine photolysierbare Verbindung als caged-Verbindung eignet, muss sie mehrere Bedingungen erfüllen:[8]
- Stabilität. Die unbelichtete Substanz sollte stabil sein. Wenn eine caged-Verbindung bei der Lagerung oder in Lösung auch ohne Belichtung langsam zerfällt, so wird oft die eigentlich inaktive caged-Verbindung mit dem aktiven Effektormolekül verunreinigt. Das kann die Interpretation von experimentellen Ergebnissen stark verfälschen.
- Biochemische Inaktivität. Die biochemische Funktion des Effektormoleküls muss durch die Verknüpfung mit der photolysierbaren Gruppe möglichst vollständig unterdrückt werden.
- Geeignete Photolyseeigenschaften. Drei Parameter sind hier wesentlich:
- Geschwindigkeit. Die photolytische Freisetzung des Effektors aus der caged-Verbindung sollte viel schneller ablaufen als der Prozess, der durch das Effektormolekül im untersuchten System ausgelöst wird. Nur dann kann auch eine Aussage über die Geschwindigkeit des Folgeprozesses gewonnen werden.
- Spezifität. Nach Belichtung sollte möglichst nur eine photochemische Reaktion der caged-Verbindung ablaufen, so dass keine Nebenprodukte entstehen, die nicht die gewünschte oder sogar keine Wirkung zeigen.
- Effizienz. Die Spaltung der caged-Verbindung sollte mit so wenig Licht wie möglich ablaufen. Die Effizienz der Photolyse hängt von zwei Faktoren ab. Zum einen sollen möglichst viele der Photonen, die in die Probe eingestrahlt werden, auch von der caged-Verbindung absorbiert werden. Dazu muss der Extinktionskoeffizient ε der caged-Verbindung für die verwendete Lichtwellenlänge hoch sein. Zum anderen sollte jedes absorbierte Photon auch tatsächlich eine photolytische Spaltung bewirken, d. h. die photochemische Quantenausbeute Φ muss ebenfalls hoch sein. Eine effiziente photolysierbare caged-Verbindung ist daher durch ein möglichst großes Produkt εΦ gekennzeichnet.
- Lichtabsorption bei Wellenlängen größer als 300 nm. Viele Biomoleküle, darunter Proteine und Nukleinsäuren, absorbieren UV-Licht bei Wellenlängen um 260–280 nm. Wenn die caged-Verbindung ebenfalls in diesem Bereich angeregt werden muss, so filtern andere Probenkomponenten bereits einen Teil der für die Photolyse benötigten Strahlung und können dadurch selbst Photoschäden erleiden. Aus diesen Gründen ist eine Lichtabsorption im längerwelligen Spektralbereich wünschenswert.
- Geringe Reaktivität und Toxizität der Reaktionsprodukte. Bei der photolytischen Spaltung entsteht nicht nur das gewünschte Effektormolekül, sondern auch eine Verbindung, die sich von der photolysierbaren Gruppe selbst ableitet. Dieses sollte möglichst keine weiteren Reaktionen eingehen und ungiftig sein.
- Gute Löslichkeit der caged-Verbindung und der Reaktionsprodukte.
Struktur
Obwohl caged-Verbindungen keine einheitliche chemische Stoffklasse bilden, gibt es zwischen ihnen strukturelle Ähnlichkeiten. Meist bestehen sie aus zwei Molekülteilen: dem freizusetzenden Zielmolekül, auch Effektormolekül genannt, und einer photolysierbaren, d. h. durch Licht abspaltbaren Gruppe, dem "cage". Diese photolysierbaren Gruppen sind verwandt und z. T. identisch mit den photolysierbaren Schutzgruppen, die in der organischen Synthese verwendet werden.[9] Die chemische Bindung zwischen den beiden Molekülteilen wird durch einen photochemischen Prozess bei der Bestrahlung mit Licht geeigneter Wellenlänge aufgebrochen.
Ein Beispiel ist caged-ATP (Adenosin-5'-triphosphat-P3-(1-(2-nitrophenyl)ethyl)-ester): das Nukleotid Adenosintriphosphat ist mit der photolabilen Nitrophenyl-Ethyl- (NPE-) Gruppe modifiziert (Abb. 1). Dieses caged-ATP kann nun mit der sarcoplasmatischen Calcium-ATPase – einem Muskelenzym, das ATP als Substrat benötigt – gemischt werden, ohne dass es mit diesem reagiert, denn die angehängte NPE-Gruppe verhindert, dass das Enzym das modifizierte ATP erkennt. Durch die Bestrahlung mit UV-Licht wird die NPE-Gruppe abgespalten, und das freigesetzte ATP kann nun mit dem Enzym reagieren. Wie sich das Enzym bei der Reaktion mit dem ATP verändert, kann dann z. B. infrarotspektroskopisch untersucht werden.[10]

Heute gibt es eine große Vielfalt von caged-Verbindungen, sowohl die freigesetzten Effektormoleküle als auch die verwendeten photolysierbaren Gruppen betreffend.
Effektormoleküle
Die Einteilung der Effektormoleküle kann danach erfolgen, welche chemische Funktionalität zur Anknüpfung der photolabilen Gruppe verwendet wird. Angehörige einer Stoffklasse können häufig durch ähnliche Syntheseverfahren mit ähnlichen photolysierbaren Gruppen versehen werden. Gängige Stoffklassen sind: Carbonsäuren, Phosphorsäureester, Alkohole, Amine, Carbamate, Thiole, Ketone, Aldehyde.
Auch eine Einteilung nach der Funktion des freigesetzten Effektormoleküls ist möglich.[1] Einige Verbindungen können dabei in mehrere der folgenden Stoffklassen eingeordnet werden:
- Nukleotide, z. B. Adenosintriphosphat (ATP)
- second messenger, z. B. cAMP, Inositoltriphosphat, Stickstoffmonoxid, Calciumionen
- Neurotransmitter, z. B. Glutaminsäure, γ-Aminobuttersäure
- Peptide und Proteine
- Oligo- und Polynukleotide, DNA und RNA
- Fluoreszenzfarbstoffe, z. B. Fluorescein
- caged-"Protonen" (oder Hydroxidionen), d. h. die caged-Verbindung bewirkt bei Photolyse eine Verschiebung des pH-Wertes der Lösung
- caged-"Elektronen", d. h. die caged-Verbindung setzt bei Lichtanregung ein Elektron frei und wirkt damit als Reduktionsmittel
Photolysierbare Gruppen
Eine Reihe von photolysierbaren Gruppen haben sich für die Herstellung von caged-Verbindungen als günstig erwiesen.[8] Diese sind in der Abb. 2 dargestellt. An der mit E markierten Position sitzt der Molekülteil, der als Effektor abgespalten wird.
- 2-Nitrobenzyl-Derivate (a): Vorteile der Stoffklasse sind die gute synthetische Zugänglichkeit und die gut verstandene Photochemie.[8][11] Nachteile sind eine z. T. schlechte Wasserlöslichkeit, ein Absorptionsmaximum im kurzwelligen UV-Bereich des Spektrums, eine langsame Photolyse und reaktive Nebenprodukte (2-Nitroso-Benzophenone). Trotz der Nachteile sind die meisten der kommerziell erhältlichen caged-Verbindungen 2-Nitrobenzyl-Verbindungen.
- Cumarinyl-Derivate (b): Vorteile sind eine starke Absorption im längerwelligen UV-Bereich, z. T. sogar im sichtbaren Teil des Lichtspektrums, eine meist sehr schnelle Photolyse und ein ungiftiges Nebenprodukt. Nachteilig ist eine oft niedrige photochemische Quantenausbeute, die aber z. T. durch den hohen Extinktionskoeffizienten ausgeglichen wird.
- p-Hydroxyphenacyl-Derivate (c): Vorteile sind die gute synthetische Zugänglichkeit, die gute photochemische Quantenausbeute und die schnelle Photolyse. Nachteilig ist, dass diese Verbindungen Licht nur unterhalb von 320 nm nennenswert absorbieren, ähnlich wie Proteine und Nukleinsäuren.
- Benzoin-Derivate (d): Vorteile der Benzoinderivate sind hohe Quantenausbeuten, schnelle Photolyse und ein inertes Benzofuran-Nebenprodukt. Nachteilig ist die starke Fluoreszenz von letzterem, die bestimmte optische Detektionsmethoden stören kann. Weiterhin kann die Chiralität des Benzoins problematisch sein, weil die beiden Isomere der entstehenden caged-Verbindung unterschiedliche Eigenschaften haben können, z. B. bei der Bindung an Enzyme.
- 1-Acyl-7-Nitroindolin-Derivate (e): Zu dieser Verbindungsklasse gibt es nur wenige Beispiele. Ein Vorteil der Klasse ist die schnelle Photolyse, nachteilig eine niedrige Quantenausbeute.
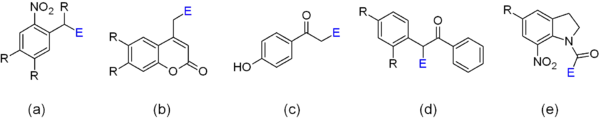
Um die Eigenschaften einer caged-Verbindung zu verbessern, können die aufgezählten photolysierbaren Gruppen strukturell modifiziert werden. Verschiedene Substituenten an den mit R gekennzeichneten Stellen können z. B. das Absorptionsmaximum der Verbindung in einen günstigeren Bereich des Lichtspektrums verschieben oder die Wasserlöslichkeit verbessern. Auch der Effektor, der mit der photolysierbaren Gruppe verknüpft werden soll, hat einen nicht immer leicht vorhersehbaren Einfluss auf die Eigenschaften der entstehenden caged-Verbindung.
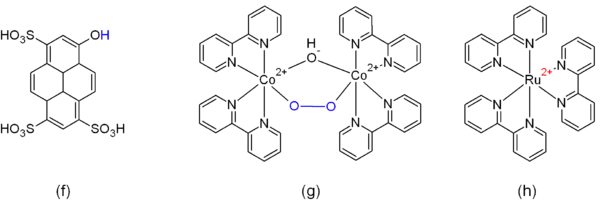
Neben den genannten Verbindungsklassen gibt es noch eine Reihe von speziellen caged-Verbindungen, die sich darin nicht einordnen lassen (Abb. 3). Dazu gehören u. a.:
- reversible Photosäuren, z. B. 8-Hydroxypyren-1,3,6-trisulfonsäure (f).[12] Diese geben bei Belichtung ein Proton in die Lösung ab und nehmen nach dem Abklingen der Anregung wieder ein Proton auf. Damit bewirken sie eine vorübergehende pH-Verschiebung in der Lösung.
- Komplexverbindungen des Cobalts (g) dienen als caged-Sauerstoff.[13]
- Komplexverbindungen des Rutheniums finden als caged-Elektronen (h)[14] oder caged-Stickstoffmonoxid Verwendung.
Mechanismen der Photoentschützung
Die vom Licht ausgelöste Reaktion der caged-Verbindung kann grob in drei Schritte gegliedert werden.
Zunächst absorbiert die caged-Verbindung ein Photon und geht damit in den elektronisch angeregten Zustand über.
Danach findet der eigentliche photochemische Prozess des angeregten Zustands statt. Die dabei ablaufenden Reaktionsmechanismen sind sehr vielfältig und unterscheiden sich nicht nur zwischen den einzelnen Stoffklassen, sondern mitunter sogar innerhalb einer Stoffklasse bei verschiedenen Effektor-Molekülen oder im Extremfall für ein und dieselbe Verbindung, wenn sie in verschiedenen Lösungsmitteln vorliegt.[8] Gemeinsam ist ihnen, dass am Ende wieder der elektronische Grundzustand der Produkte vorliegt. Im einfachsten Fall hat dabei die Abspaltung des Effektormoleküls bereits stattgefunden. Die primären photochemischen Prozesse sind oft sehr schnell und schon nach Piko- bis Mikrosekunden abgeschlossen.
Teilweise schließen sich nun noch Folgereaktionen an, wenn nämlich die durch Photolyse entstandenen Produkte selber chemisch nicht stabil sind. Dieser Effekt ist z. B. für die Herstellung von caged-Aminen durchaus erwünscht. Mit den Aminen selbst lassen sich nur schlecht caged-Verbindungen herstellen, daher verwendet man dazu die entsprechenden Carbamate. Wenn nach Belichtung aus der caged-Verbindung das Carbamat freigesetzt wurde, zerfällt dieses spontan weiter in CO2 und das gewünschte Amin. Der Zerfall des Carbamates ist langsamer als seine Freisetzung aus der caged-Verbindung und begrenzt damit die Bildungsgeschwindigkeit des Amins.
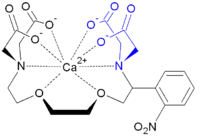
Auch für das oft verwendete caged-Calcium (Abb. 4) wird eine solche Sekundärreaktion ausgenutzt. In der caged-Verbindung selbst ist das Calciumion als Chelatkomplex gebunden. Die Belichtung setzt das Ion nicht direkt frei, sondern führt primär nur zur Spaltung einer Bindung im Chelatliganden. Der "defekte" Ligand kann das Calcium nicht mehr fest genug binden: er zerfällt in zwei Teile und setzt das Ion in die Lösung frei.
Literatur
- G. Marriott (Hrsg.), Caged compounds, Methods in Enzymology 291, 1998, ISBN 978-0121821920
- C. Brieke et al. (2012) Lichtgesteuerte Werkzeuge. Angew. Chem. 124, 8572-8604 doi:10.1002/ange.201202134
- C. Brieke et al. (2012) Light-Controlled Tools. Angew. Chem. Int. Ed. 51, 8446-8476 doi:10.1002/anie.201202134
Einzelnachweise
- G. C. R. Ellis-Davies (2007) Caged compounds: photorelease technology for control of cellular chemistry and physiology. Nat. Methods 4, 619–628, doi:10.1038/NMETH1072.
- S. R. Adams, R. Y. Tsien (1993) Controlling cell chemistry with caged compounds. Annu. Rev. Physiol. 55, 755–784, doi:10.1146/annurev.ph.55.030193.003543.
- A. Deiters (2009) Light activation as a method of regulating and studying gene expression. Curr. Opin. Chem. Biol. 13, 678–686, doi:10.1016/cbpa.2009.09.026.
- J. H. Kaplan, B. Forbush III, J. F. Hoffman (1978) Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: Utilization by the Na:K pump of human red blood cell ghosts. Biochemistry 17, 1929–1935, doi:10.1021/bi00603a020.
- J. Engels, Ernst-Jürgen Schlaeger (1977) Synthesis, structure, and reactivity of adenosine cyclic 3',5'-phosphate benzyl triesters. J Med Chem 20, 907–911, doi:10.1021/jm00217a008.
- C. Zscherp, A. Barth (2001) Reaction-induced infrared difference spectroscopy for the study of protein reaction mechanisms. Biochemistry 40, 1875–1883, doi:10.1021/bi002567y.
- L. Kröck, A. Heckel (2005) Lichtinduzierte Transkription mit vorübergehend fehlgepaarten Oligonucleotiden. Angew Chemie 117, 475–477, doi:10.1002/ange.200461779.
- A. P. Pellicioli, J. Wirz (2002) Photoremovable protecting groups: reaction mechanisms and applications. Photochem. Photobiol. Sci. 1, 441–458, doi:10.1039/b200777k.
- T.W. Green, P.G.M. Wuts. Protective Groups in Organic Synthesis. Wiley-Interscience, New York, 2006, ISBN 978-0471697541.
- A. Barth, W. Mäntele, W. Kreutz (1991) Infrared spectroscopic signals arising from ligand binding and conformational changes in the catalytic cycle of sarcoplasmic reticulum calcium ATPase. Biochim Biophys Acta 1057, 115–123, doi:10.1016/S0005-2728(05)80091-X.
- J. A. McCray, D. R. Trentham (1989) Properties and uses of photoreactive caged compounds. Annu. Rev. Biophys. Biophys. Chem. 18, 239–270, doi:10.1146/annurev.bb.18.060189.001323.
- D.B. Spry, M.D. Fayer (2008) Charge redistribution and photoacidity: Neutral versus cationic photoacids. J. Chem. Phys 128, 084508-1–084508-9, doi:10.1063/1.2825297.
- R. MacArthur, A. Sucheta, F.F. Chong, O. Einarsdottir (1995) Photodissociation of a (μ-peroxo)(μ-hydroxo)bis[bis(bipyridyl)-cobalt(III)] complex: a tool to study fast biological reactions involving O2. Proc. Natl. Acad. Sci. USA 92, 8105–8109, Abstract.
- R. Nakano, H. Sato, T. Shimizu (1996) Tris(2,2'-bipyridyl) ruthenium(II)-mediated photoinduced electron transfer of engineered cytochrome P450 1A2. J. Photochem. Photobiol. B 32, 171–176, doi:10.1016/1011-1344(95)07230-6.