Retinol
Retinol, auch Vitamin A1 oder Axerophthol, ist ein fettlösliches, essenzielles Vitamin. Chemisch gesehen gehört Retinol zu den Diterpenoiden und ist ein einwertiger primärer Alkohol. Der enthaltene Ring aus sechs Kohlenstoffatomen wird β-Jononring genannt, und das Molekül weist zudem eine Reihe konjugierter Doppelbindungen auf, die für seine Beteiligung am Sehvorgang entscheidend sind.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
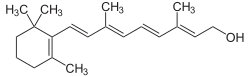 | ||||||||||
| Allgemeines | ||||||||||
| Trivialname | Vitamin A1 | |||||||||
| Andere Namen | ||||||||||
| Summenformel | C20H30O | |||||||||
| CAS-Nummer | 68-26-8 | |||||||||
| ATC-Code | ||||||||||
| Kurzbeschreibung | gelber Feststoff | |||||||||
| Vorkommen | z. B. in Fisch, Leber, Eigelb, Milch | |||||||||
| Physiologie | ||||||||||
| Funktion | Bestandteil des Sehpigments, Wachstumsfaktor, beteiligt bei Testosteronbildung | |||||||||
| Täglicher Bedarf | 0,8–1,0 mg | |||||||||
| Folgen bei Mangel | u. a. Haarausfall, Sehstörungen (z. B. Nachtblindheit), Atrophie von Schleimhäuten und Speicheldrüsen | |||||||||
| Überdosis | 7,5 mg | |||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 286,46 g·mol−1 | |||||||||
| Aggregatzustand | fest | |||||||||
| Schmelzpunkt |
61–63 °C[2] | |||||||||
| Siedepunkt |
120–125 °C (0,67 Pa)[2] | |||||||||
| Löslichkeit |
| |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Oftmals wird, auch in vielen Lehrbüchern, Retinol vereinfachend mit Vitamin A gleichgesetzt. Man versteht jedoch unter Vitamin A vielmehr eine Stoffgruppe von β-Jononderivaten, die dasselbe biologische Wirkungsspektrum wie all-trans-Retinol aufweisen, ausschließlich der Provitamine A.[4]
Geschichte
Retinol wurde 1913 von Elmer McCollum und Marguerite Davis (1887–1967) entdeckt.[5] Sie beschrieben es als ein fettlösliches Vitamin und dessen Bedeutung als antixerophthalmatischen Faktor. Erst 20 Jahre später erfolgte die Reindarstellung des Retinols aus Lebertran durch Paul Karrer.
Die erste Totalsynthese von Retinol gelang 1947 den holländischen Chemikern Jozef Ferdinand Arens (1914–2001) und David Adriaan van Dorp (1915–1995) durch schrittweise Reduktion von Tretinoin. Nach ihnen wurde diese Synthese Arens-van Dorp-Synthese genannt.[6]
Retinylester
Retinylester sind Konjugate des Retinols mit Fettsäuren. Überwiegend werden die gesättigten Fettsäuren Palmitinsäure und Stearinsäure, in geringeren Mengen auch die ungesättigten Fettsäuren Ölsäure, Linolsäure und Linolensäure zur Konjugation genutzt.[7]
Vorkommen und Bedarf
Tiere und Menschen sind zur De-novo-Synthese von Vitamin A unfähig. Die Bedarfsdeckung erfolgt über die Nahrung. Während Fleischfresser Vitamin A überwiegend in Form von Retinylestern oder Retinol aufnehmen, verwenden Pflanzenfresser Carotinoide als Quelle. Natürliche Hauptnahrungsquellen für Retinylester und Retinol sind Leber, Fischleberöle (Lebertran), Eigelb sowie Milch und Milchprodukte, wobei Leber die mit Abstand größten Mengen enthält.[7]
Der Mensch kann zur Vitamin-A-Bedarfsdeckung sowohl Retinol und Retinylester als auch Provitamin A nutzen. Da das Provitamin nicht gleichermaßen verwertbar ist (Resorption, Umwandlung), ist sein Bedarf höher.
Von der Deutschen Gesellschaft für Ernährung (DGE) der tägliche Bedarf für Erwachsene (18 bis 65 Jahre) mit 0,85 mg (Männer) bzw. 0,70 mg (Frauen) Retinolaktivitätsäquivalent angegeben.[8] 0,1 mg Retinolaktivitätsäquivalent (retinol activity equivalent, RAE) entspricht 0,1 mg Retinol, 1,2 mg β-Carotin oder 2,4 mg andere Provitamin-A-Carotinoide. Schwangeren wird 0,8 mg und Stillenden 1,3 mg empfohlen.[8]
Der Verzehr größerer Mengen von Vitamin A in Form von Retinsäure, wie es bereits nach einer Lebermahlzeit oder einer überdosierten Supplementierung der Fall sein kann, birgt das Risiko für lebertoxische und teratogene Wirkungen.[9] Das Bundesinstitut für Risikobewertung (BfR) hat die tolerierbare obere Einnahmemenge (UL) für Retinol und Retinylester (ohne Vitamin A-aktive Carotinoide) für Erwachsene, Stillende und Schwangere auf 3 mg pro Tag beschränkt, bei Kindern oder postmenopausalen Frauen ist diese noch geringer.[9]
Butterersatzerzeugnisse wie z. B. Margarine oder Mischfetterzeugnisse müssen in Deutschland verpflichtend mit Vitamin A angereichert werden (1 mg pro 100 Gramm Lebensmittel).[9] Bei allen anderen Lebensmitteln soll eine Anreicherung von präformierten Vitamin A aufgrund der geringen Sicherheitsbreite nicht erfolgen. Gemäß BfR soll der Zusatz von präformiertem Vitamin A zu Nahrungsergänzungsmitteln (NEM) entweder ganz entfallen. Alternativ wird eine Höchstmenge von 0,2 mg proTagesverzehrempfehlung eines NEM angegeben.
Die Katze benötigt ebenfalls Retinol oder Vitamin A1, nimmt jedoch eine Sonderstellung ein, da sie im Gegensatz zu fast allen anderen Tieren β-Carotin nicht in Retinol umwandeln und sich daher natürlicherweise nur durch den Verzehr von Leber ausreichend mit Vitamin A versorgen kann.[10] Trockenfuttermittel werden daher häufig mit Lutein aus Tagetesblütenextrakt angereichert, welches von der Katze in Retinol umgewandelt werden kann.
Aufnahme, Speicherung und Mobilisierung
Retinylester stellen die Hauptform des in der Nahrung vorkommenden Vitamin A dar, können jedoch nicht direkt aus der Nahrung aufgenommen werden. Zunächst müssen sie im Darmlumen zu Retinol hydrolysiert werden. Nach der Aufnahme des Retinols in die Enterozyten erfolgt dessen Wiederveresterung mit langkettigen Fettsäuren.[11]
In Säugetieren befinden sich circa 50 bis 80 Prozent des gesamten Vitamin A, bestehend aus Retinylestern und Retinol, in der Leber. Die Ito-Zellen der Leber speichern davon circa 90 bis 95 Prozent. Fast das gesamte Vitamin A (98 %) in den Ito-Zellen liegt in der Esterform vor und ist in Fetttröpfchen verpackt.[12] Eine Hydrolyse ist somit auch Voraussetzung für die Freisetzung von Vitamin A aus der Leber. Diese erfolgt unter Wirkung eines Enzyms (Retinylester-Hydrolase).[13]
Stoffwechsel
Der Vitamin-A-Stoffwechsel wird im Wesentlichen durch sogenannte RBPs (Retinol-Bindeproteine) gesteuert. Nur mit deren Hilfe wird Vitamin A für den Körper nutzbar, wodurch ein Mangel an diesen Proteinen zu ähnlichen Symptomen führen kann wie ein Vitamin-A-Mangel (Hypovitaminose) selbst.
Kann überschüssiges Retinol nicht durch RBPs gebunden werden, so treten Vergiftungserscheinungen auf. Sie spielen daher auch bei einer Hypervitaminose A eine entscheidende Rolle. Da sie einen sogenannten Zinkfinger besitzen, ist das Spurenelement Zink wichtig für den gesamten Vitamin-A-Haushalt – sowohl bei Unter- als auch Überversorgung.
Reaktionen
Die Biosynthese Vitamin-A-aktiver Verbindungen geht von einem Retinylester (meist Vitamin-A-Palmitat) aus:
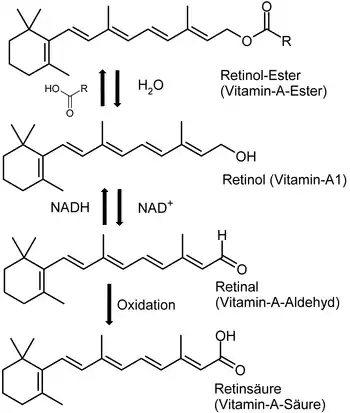
Retinol ist die Stammkomponente der Retinoide. Die Oxidation des Alkohols führt zum Retinal, das zu Retinsäure (Tretinoin) weiter oxidiert werden kann.[14]
Synthese
Ein Schlüsselschritt bei der großtechnischen Herstellung von Vitamin A ist die Wittig-Reaktion. Für diese weithin anwendbare Reaktion erhielt Georg Wittig im Jahre 1979 den Nobelpreis für Chemie.
Im ersten Teil der Synthese wird von Dehydrolinalool aus ein C15-Salz hergestellt. Dieses reagiert durch die Wittig-Reaktion mit einem C5-Acetat, das aus Dimethoxyaceton hergestellt wird, zum Retinylacetat. Dieses kann über mehrere weitere Schritte in das Retinol umgewandelt werden.
Weblinks
- Höchstmengenvorschläge für Vitamin A in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: Bundesinstitut für Risikobewertung. 2021, abgerufen am 6. Januar 2022.
- Höchstmengenvorschläge für Beta-Carotin in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: Bundesinstitut für Risikobewertung. 2021, abgerufen am 6. Januar 2022.
Einzelnachweise
- Eintrag zu RETINOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. September 2021.
- Eintrag zu Retinol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. April 2020. (JavaScript erforderlich)
- Datenblatt Retinol synthetic, ≥95% (HPLC), crystalline bei Sigma-Aldrich, abgerufen am 24. November 2014 (PDF).
- Hanck, Kuenzle, Rehm: Vitamin A. Blackwell Wissensch., Berlin, 1991 ISBN 978-3-8263-2879-4.
- McCollum & Davis (1913): The necessity of certain lipids during growth. In: J. Biol. Chem. Bd. 15, S. 167–175.
- Jozef Ferdinand Arens, David Adriaan van Dorp: Synthesis of Vitamin A Aldehyde. In: Nature. 1947, 160, S. 189, doi:10.1038/160189a0.
- Thomas Arnhold: 1.4.1 Vitamin-A-Quellen In: Untersuchungen zum Metabolismus von Vitamin A / Retinoiden im Hinblick auf eine Risikoabschätzung ihrer teratogenen Wirkung beim Menschen; S. 6–7; Dissertation; Braunschweig, 7. März 2000. Volltext
- Vitamin A. In: Deutsche Gesellschaft für Ernährung. 2020, abgerufen am 6. November 2021.
- Höchstmengenvorschläge für Vitamin A in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: BfR. Abgerufen am 6. November 2021.
- James G Morris: "Idiosyncratic nutrient requirements of cats appear to be diet-induced evolutionary adaptations". Nutrition Research Reviews (2002), 15:153-168 Cambridge University Press
- Thomas Arnhold: 1.4.2 Absorption und Metabolismus im Intestinaltrakt In: Untersuchungen zum Metabolismus von Vitamin A / Retinoiden im Hinblick auf eine Risikoabschätzung ihrer teratogenen Wirkung beim Menschen; S. 7–8; Dissertation; Braunschweig, 7. März 2000. Volltext
- Rune Blomhoff: Vitamin A in Health and Disease, CRC Press 1994; S. 9. ISBN 9780824791209.
- Thomas Arnhold: 1.4.4 Mobilisierung aus der Leber und Aufnahme in extrahepatische Zellen In: Untersuchungen zum Metabolismus von Vitamin A / Retinoiden im Hinblick auf eine Risikoabschätzung ihrer teratogenen Wirkung beim Menschen; S. 7–8; Dissertation; Braunschweig, 7. März 2000. Volltext
- Thomas Arnhold: 1.2.3 Struktur natürlicher und synthetischer Retinoide In: Untersuchungen zum Metabolismus von Vitamin A / Retinoiden im Hinblick auf eine Risikoabschätzung ihrer teratogenen Wirkung beim Menschen; S. 3; Dissertation; Braunschweig, 7. März 2000. Volltext