Argininosuccinat-Lyase
Die Argininosuccinat-Lyase (ASL) ist das Enzym, das die Spaltung von Argininosuccinat in Arginin und Fumarat katalysiert. Diese Reaktion findet in allen Lebewesen als letzter Schritt der Arginin-Biosynthese statt, zählt aber auch in Wirbeltieren als Teilschritt des Harnstoffzyklus. Mutationen im ASL-Gen können ASL-Mangel verursachen, einem Harnstoffzyklusdefekt mit Ausscheidung von Argininobernsteinsäure im Urin.[2][3]
| Argininosuccinat-Lyase | ||
|---|---|---|
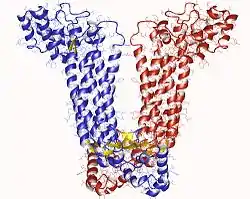 | ||
| Argininosuccinat lyase dimer, Human nach PDB 1AOS | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 48,7 bis 51,7 Kilodalton / 438 bis 464 Aminosäuren (je nach Isoform) | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Isoformen | 3 | |
| Bezeichner | ||
| Gen-Name | ASL | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 4.3.2.1, Lyase | |
| Reaktionsart | Spaltung einer C-N-Bindung | |
| Substrat | Argininosuccinat | |
| Produkte | Fumarat + Arginin | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen[1] | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 435 | 109900 |
| Ensembl | ENSG00000126522 | ENSMUSG00000025533 |
| UniProt | P04424 | Q91YI0 |
| Refseq (mRNA) | NM_000048 | NM_133768 |
| Refseq (Protein) | NP_000039 | NP_598529 |
| Genlocus | Chr 7: 66.08 – 66.09 Mb | Chr 5: 130.01 – 130.02 Mb |
| PubMed-Suche | 435 | 109900 |
ASL eignet sich aufgrund seiner spezifischen Expression als Laborwert für Lebererkrankungen.[4]
Katalysierte Reaktion
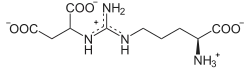 ⇔
⇔ ![]() +
+ 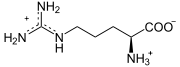
Argininosuccinat zerfällt in Fumarat und Arginin.
Weblinks
Wikibooks: Harnstoffzyklus – Lern- und Lehrmaterialien
- reactome: argininosuccinate ↔ fumarate + arginine
Einzelnachweise
- Homologe bei OMA
- UniProt P04424
- Trevisson E, Salviati L, Baldoin MC, et al.: Argininosuccinate lyase deficiency: mutational spectrum in Italian patients and identification of a novel ASL pseudogene. In: Hum. Mutat.. 28, Nr. 7, Juli 2007, S. 694–702. doi:10.1002/humu.20498. PMID 17326097.
- Feng JF, Chen TM, Wen YA, Wang J, Tu ZG: Study of serum argininosuccinate lyase determination for diagnosis of liver diseases. In: J. Clin. Lab. Anal.. 22, Nr. 3, 2008, S. 220–7. doi:10.1002/jcla.20245. PMID 18484660.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.