Uran(VI)-fluorid
Uran(VI)-fluorid (UF6), meistens Uranhexafluorid genannt, ist eine chemische Verbindung aus den Elementen Uran und Fluor. Es ist ein farbloser, kristalliner Feststoff, der leicht flüchtig, radioaktiv und äußerst giftig ist. Es ist eine sehr aggressive Substanz, die nahezu jeden Stoff und auch jedes biologische Gewebe angreift. Uranhexafluorid ist beständig in trockener Luft, reagiert jedoch sehr heftig mit Wasser. In den meisten Fällen wird es aus Uran(IV)-fluorid (UF4) durch Umsetzung mit elementarem Fluor (F2) gewonnen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
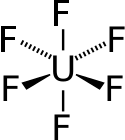 | ||||||||||||||||
| Kristallsystem | ||||||||||||||||
| Raumgruppe |
Pnma (Nr. 62) | |||||||||||||||
| Gitterparameter |
a = 990,0 pm | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Uran(VI)-fluorid | |||||||||||||||
| Andere Namen |
Uranhexafluorid | |||||||||||||||
| Summenformel | UF6 | |||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 351,99 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
5,09 g·cm−3 (20,7 °C)[2] | |||||||||||||||
| Sublimationspunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
heftige Zersetzung mit Wasser[1] | |||||||||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||||||||

Radioaktiv | ||||||||||||||||
| ||||||||||||||||
| MAK |
1 mg·m−3[1] | |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Bei Normaldruck und einer Temperatur von 56,5 °C geht Uranhexafluorid durch Sublimation direkt vom festen in den gasförmigen Zustand über. Es ist die einzige Uranverbindung, die sich leicht in die Gasphase überführen lässt. Uran(VI)-fluorid hat eine besondere technische Bedeutung bei der Uran-Anreicherung erhalten. Durch Gasdiffusionsverfahren oder Gasultrazentrifugen erfolgt eine graduelle Trennung des für nukleare Anwendungen wichtigen und seltenen Uranisotops 235U vom weitaus häufigeren Uranisotop 238U.
Geschichte
Die Erstsynthese von Uranhexafluorid wurde von Otto Ruff und Alfred Heinzelmann an der Technischen Hochschule Danzig durchgeführt und am 15. Januar 1909 zur Veröffentlichung eingereicht. Diese Synthese lief in einem Platinrohr bei −20 °C unter Feuchtigkeitsausschluss durch die Umsetzung von Uran(V)-chlorid mit Fluor:[6]
Im Zuge der abgeschlossenen Dissertation Alfred Heinzelmanns mit Veröffentlichungsdatum zum 27. Juni 1911[7] reichten am 25. Juni 1911 Ruff und Heinzelmann einen ersten Überblick über das Uranhexafluorid bei der Zeitschrift für anorganische Chemie ein.[8] Neben der oben vorgestellten Synthese wurden zwei weitere Varianten vorgestellt und einige Eigenschaften und Reaktionen beschrieben.
Die Reaktion von Uran(V)-chlorid mit Fluorwasserstoff (HF) ist zur Darstellung von reinem UF6 nicht geeignet, da es sich nur schlecht von HF trennen lässt.[8]
Lässt man Uranmetall oder Urandicarbid (UC2) mit Fluor (in Gegenwart geringer Mengen von Chlor als Katalysator) zur Reaktion kommen, so ist eine vollständige Umwandlung zu UF6 zu beobachten.[8]
Schon 1880 beschrieb Alfred Ditte die Umsetzung eines grünen Uranoxids (U3O4[9]) mit einem Überschuss an konzentrierter Flusssäure, wobei zum Teil eine gelbe Flüssigkeit entstand, die beim Erhitzen verdampfte und sich in Form gelber transparenter Kristalle niederschlug mit der Formel U2Fl2,4HFl[9]. Er beschrieb ferner ein „Oxyfluorure“ (U2OFl2[9]), das sehr flüchtig ist; beim Kontakt mit Luftsauerstoff zersetzte sich der „weiße Schnee“ zu einem schwarzen Stoff.[10] Diese Ergebnisse wurden 1884 in größerem Zusammenhang erneut publiziert.[11] Diese Angaben stellten sich später als Irrtum heraus.[12][13]
Lange Zeit blieb Uranhexafluorid lediglich für Laborstudien interessant. Erst mit der Entdeckung der Kernspaltung im Jahre 1938 erlangte diese Verbindung größere Bedeutung, da sie die einzige deutlich flüchtige und gleichzeitig stabile Verbindung des Urans ist.[14] Aristid von Grosse fasste 1941 die bisher bekannten Eigenschaften zusammen und beschrieb zudem das chemische Verhalten gegenüber anorganischen und organischen Stoffen sowie in Glasgefäßen in Gegenwart von Verunreinigungen.[15] Dampfdruck und Tripelpunkt wurden von Bernard Weinstock und Ray Crist gemessen. Die Arbeiten wurden am 9. Februar 1942 abgeschlossen. Das 1943 erstellte Manuskript wurde 1947 freigegeben und 1948 veröffentlicht.[16] Isidor Kirshenbaum fasste 1943 die physikalischen Eigenschaften zusammen.[17]
Darstellung
Uranhexafluorid kann grundsätzlich aus Uranmetall sowie praktisch allen Uranverbindungen durch Umsetzung mit elementarem Fluor sowie Chlor- und Bromfluoriden dargestellt werden.[18]
Man kann die Bildungsmethoden unterteilen in:
- Darstellung aus Uran(VI)-verbindungen ohne Änderung der Oxidationsstufe, z. B. Umhalogenierung von Uran(VI)-chlorid (UCl6), Fluorierung von Uranylfluorid (UO2F2) sowie die thermische Zersetzung von UOF4, UO2F2 oder von Fluorouranaten(VI).
- Darstellung aus Uran oder Uranverbindungen mit niedrigeren Oxidationsstufen, z. B. die oxidierende Fluorierung von Uranmetall, von Uran(V)-chlorid (UCl5), der verschiedenen Uranoxide, Urancarbide und Uranfluoride.[19]
- Verwendung anderer Fluorierungsmittel wie Interhalogenverbindungen und Edelgasfluoride.
Standardmethode
Die gängige Methode zur Darstellung von Uranhexafluorid ist die Umsetzung von Uran(IV)-fluorid (UF4) mit elementarem Fluor (F2). Bei Temperaturen über 250 °C findet die Reaktion statt und wird meist bei 300 °C durchgeführt; die Reaktion ist endotherm:[20]
Setzt man Fluor mit etwa 50 % Überschuss ein, so verläuft die Reaktion vollständig. Dieser Prozess wird auch technisch genutzt. Das Fluor wird aus dem Anodenprozess der Elektrolyse einer Kaliumfluorid-Fluorwasserstoff-Mischung gewonnen.
In gleicher Weise entstehen Neptuniumhexafluorid (NpF6) bei 500 °C aus Neptuniumtetrafluorid (NpF4) und F2 sowie Plutoniumhexafluorid (PuF6) bei 750 °C aus Plutoniumtetrafluorid (PuF4) und F2.[21]
Mit anderen Fluorverbindungen
Mit Chlortrifluorid (ClF3), Bromtrifluorid (BrF3) und Brompentafluorid (BrF5) reagieren sämtliche Uranoxide zu UF6. Die Reaktivität der Halogenfluoride ist dabei höher als die von elementarem Fluor. UO2 setzt sich mit BrF3 schon bei etwa 50 °C um, die Reaktion mit Fluor läuft dagegen erst bei etwa 400 °C ab.[22] Die Halogenfluoride setzen sich heftig mit Uranmetall um; die Reaktion mit BrF3-Dampf kann zur Explosion führen.[23]
Auch mit Edelgasfluoriden wie z. B. Xenondifluorid (XeF2) wird UF4 bei höherer Temperatur unter Druck oder in flüssigem HF zu UF6 umgesetzt.[22]
Stickstofftrifluorid (NF3) fluoriert Uranmetall, UO2, UF4, UO3, U3O8 und UO2F2 · 2 H2O bei Temperaturen zwischen 100 und 550 °C zu UF6. NF3 wird daher als potenzieller Ersatz bisheriger Fluorierungsmittel im bestehenden nuklearen Brennstoffkreislauf sowie in der Wiederaufarbeitung der flüchtigen Actinoidenverbindungen angesehen.[24] Beim gegenwärtigen „Standardverfahren“ der Wiederaufarbeitung, dem PUREX-Verfahren werden die so genannten minoren Actinoide nicht vom restlichen Abfall getrennt. Die Verwendung fluorbasierter Methoden könnte sowohl UF6 als auch rückgewinnbare Fluoride anderer Actinoide erzeugen und damit die Radioaktivität im restlichen Abfall stark verringern.
Eigenschaften
Physikalische Eigenschaften
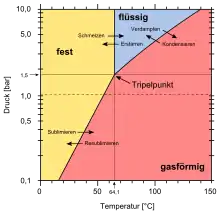
Uranhexafluorid bildet farblose Kristalle, die unter Normaldruck (1.013,25 hPa) bei 56,54 °C sublimieren,[25] das heißt direkt vom festen in den gasförmigen Zustand übergehen.

Es kann unbegrenzt bei Raumtemperatur in Quarz- oder Pyrex-Ampullen aufbewahrt werden, wenn sichergestellt ist, dass keine Spuren von Feuchtigkeit vorhanden sind, das Glas selbst von allen Gaseinschlüssen frei ist und eventuell vorhandener Fluorwasserstoff (HF) restlos entfernt wurde.[21]
| Parameter für die Antoine-Gleichung[25] lg P = A−B/(T+C); bei 64–116 °C | ||
| A | B | C |
|---|---|---|
| 6,99464 | 1126,288 | 221,963 |
| lg P = A−B/(T+C); bei > 116 °C | ||
| A | B | C |
| 7,69069 | 1683,165 | 302,148 |
Der Tripelpunkt, an dem die drei Phasen fest, flüssig und gasförmig im Gleichgewicht stehen, liegt bei einer Temperatur von 64,05 °C und einem Druck von 1133±7 mmHg (ca. 1510 hPa).[26][16][27] Erst oberhalb dieses Drucks ist auch eine flüssige Phase möglich.
Der kritische Punkt, ab dem Flüssigkeit und Gas nicht mehr voneinander unterschieden werden können, liegt bei einer Temperatur (Tc) von 230,2 °C, einem Druck (pc) von 45,5 atm (46,1 bar), einem molaren Volumen (Vm, c) von 256,0 cm3·mol−1 und einer Dichte (ρc) von 1,375 g·cm−3.[25][28] Der Dampfdruck bei 25 °C beträgt 153 mbar (153 hPa).[1]
Die Flüchtigkeit von UF6 ist ähnlich der von Neptuniumhexafluorid (NpF6) und Plutoniumhexafluorid (PuF6); sie gehören zusammen zu den drei bisher bekannten Hexafluoriden der Actinoidenelemente.
Die Bildungsentropie (S0m) beträgt für festes UF6: −430,4 ± 1,5 J·K−1·mol−1, für gasförmiges UF6: −280,4 ± 1,5 J·K−1·mol−1.[5] Die Sublimationsenthalpie (ΔHs) am Sublimationspunkt (56,54 °C) beträgt 48,23 kJ·mol−1; die Verdampfungsenthalpie (ΔHv) am Tripelpunkt (64,05 °C) beträgt 28,76 kJ·mol−1.[16][17][29][30]
Uranhexafluorid ist paramagnetisch; die molare magnetische Suszeptibilität χmol beträgt 43 · 10−6 cm3·mol−1.[31][32][33]
Kristall- und Molekülstruktur
Uranhexafluorid ist eine kovalente Verbindung und kein Salz. Das UF6-Molekül ist oktaedrisch (Oh); im gasförmigen Zustand beträgt die U–F-Bindungslänge 199,6 pm.[34]
 Bindungslänge und -winkel beim gasförmigen Uranhexafluorid[34]
Bindungslänge und -winkel beim gasförmigen Uranhexafluorid[34]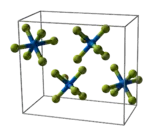 Elementarzelle des Uranhexafluorids[35]
Elementarzelle des Uranhexafluorids[35]
Uranhexafluorid kristallisiert im orthorhombischen Kristallsystem bei 293 K (20 °C) in der Raumgruppe Pnma (Nr. 62) mit den Gitterparametern a = 990,0 pm, b = 896,2 pm und c = 520,7 pm mit vier Formeleinheiten pro Elementarzelle.[36] Im Kristall zeigen die Moleküle eine leichte Abweichung von der regulären oktaedrischen Koordination.[35][36] Bei 293 K (20 °C) betragen die gemessenen Abweichungen aus den Librationsbewegungen der Fluor-Atome +1,5 pm für die U–F- und +2,0 pm für die F–F-Abstände. Die korrigierten Abstände betragen für U–F 199,2–200,4 pm, für F–F 280,4–282,6 pm und der F–U–F-Winkel 89,42(17)–90,20(11)°.[36]
Beim Abkühlen auf 193 K (−80 °C) verringern sich die Gitterparameter auf a = 984,3 pm, b = 892,0 pm und c = 517,3 pm.[37] Die hexagonale Kugelpackung neigt zu größerer Regelmäßigkeit, die F–F-Abstände außerhalb eines UF6-Oktaeders verkürzen sich. Die Oktaeder der Moleküle sind fast regelmäßig mit einem mittleren U–F-Abstand von 198 pm, einer mittleren F–F-Kantenlänge von 280 pm, und einem F–U–F-Winkel von 90,0° bei 193 K.[37]
Bei weiterer Abkühlung auf 77 K (−196 °C) verringern sich die Metall-Fluor-Bindungslängen nicht wesentlich, aber die Atomkoordinaten nähern sich weiter an die idealen Koordinaten der hexagonalen Kugelpackung der Fluoratome an.[38]
Spektroskopische Eigenschaften
Uranhexafluorid besitzt sechs Grundschwingungen. ν1 und ν2 sind Streckschwingungen, ν5 und ν6 sind Biegeschwingungen. Die Normalkoordinate von ν3 besteht überwiegend aus einer Streckung, die von ν4 überwiegend aus einer Biegung. Davon sind ν1, ν2 und ν5 Raman-aktiv,[39] ν3 und ν4 IR-aktiv, ν6 ist IR- und Raman-inaktiv.[40][41][42][43][44]
Grundschwingung ν1 ν2 ν3 ν4 ν5 ν6 Termsymbol A1g Eg F1u F1u F2g F2u Wellenzahl (cm−1)[45] 667 ± 1 534 ± 1 626 ± 1 186 ± 1 200 ± 1 143 ± 2 IR-aktiv − − + + − − Raman-aktiv + + − − + −
Chemische Eigenschaften
Uranhexafluorid ist beständig in trockener Luft. Es reagiert hingegen sehr heftig mit Wasser (schon durch Luftfeuchtigkeit), wobei das wasserlösliche Uranylfluorid (UO2F2) und Fluorwasserstoff (HF) entstehen.[46] HF bildet im überschüssigen Wasser stark ätzende Flusssäure.
UF6 ist ein kräftiges Fluorierungs- und Oxidationsmittel. Mit den meisten Metallen und Legierungen (z. B. Eisen, Aluminium-Magnesium-Legierungen, Edelstähle) reagiert es unter Bildung von Metallfluoriden, bei Raumtemperatur sehr langsam, bei erhöhten Temperaturen etwas schneller. Da die gebildeten Fluoride schwerflüchtig sind, bilden sie auf den betreffenden Oberflächen Ablagerungen, die die Weiterreaktion verhindern können. Vor allem Nickel ist chemisch sehr widerstandsfähig.[47] Synthetische Hochpolymere, wie z. B. Teflon und einige Copolymere, weisen ebenfalls eine gute Beständigkeit gegenüber UF6 auf.[47] Organische Verbindungen reagieren dagegen bereits bei Raumtemperatur durch Fluorierung mit UF6; dabei bilden sich HF und UF4 unter Abscheidung von Kohlenstoff. Sauerstoffhaltige organische Verbindungen wie z. B. Ethanol oder Diethylether reagieren schnell unter Abscheidung von Uranylfluorid und Bildung von HF.[48]
Verwendung

Uranhexafluorid dient zur Trennung der Uranisotope nach dem Gasdiffusionsverfahren oder mittels Gasultrazentrifugen. Es ist hierzu ideal geeignet, da es sich im Gegensatz zu den meisten anderen Uranverbindungen leicht in die Gasphase überführen lässt und da Fluor ein Reinelement ist: Es kommt nur ein Fluorisotop (19F) in der Natur vor; alle natürlichen Fluoratome haben exakt die gleiche Atommasse. Daher sind die Massenunterschiede der Uranhexafluoridmoleküle, die bei der Isotopentrennung ausgenutzt werden – wie erwünscht – nur auf die Massenunterschiede der Uranisotope 238U und 235U zurückzuführen. Uranhexafluorid ist damit ein Bestandteil des nuklearen Brennstoffkreislaufs. Zur weiteren Verwendung in Druck- und Siedewasserreaktoren wird angereichertes Uranhexafluorid zu Brennelementefabriken transportiert, um dort erst zu Urandioxid und schließlich zu Brennelementen weiterverarbeitet zu werden.
Für die Wiederaufarbeitung abgebrannter Brennelemente wurde zur Abtrennung des Urans (95 % der Gesamtmasse) vorgeschlagen, das Material fein zu zerkleinern und mit elementarem Fluor zu behandeln („direkte Fluorierung“). Die dabei entstehenden flüchtigen Fluoride (hauptsächlich UF6 und geringe Mengen NpF6) lassen sich leicht von den nichtflüchtigen Fluoriden, z. B. Plutonium(IV)-fluorid (PuF4), Americium(III)-fluorid (AmF3), Curium(III)-fluorid (CmF3) sowie den Fluoriden der meisten Spaltprodukte, abtrennen.[49] Neptuniumhexafluorid (NpF6) und Plutoniumhexafluorid (PuF6) sind gegenüber UV-Licht empfindlich und zersetzen sich zu den Tetrafluoriden und Fluor.[21] Sie lassen sich daher photochemisch aus einem Gemisch mit UF6 entfernen.[50][51]
Transport und Lagerung

Da die Stätten der Produktion, der Isotopentrennung - genauer: -an- und -abreicherung - und der Weiterverarbeitung an unterschiedlichen Orten liegen, sind Transport und Lagerung von Uranhexafluorid erforderlich.[52] Gebräuchlich sind vor allem zylindrische Stahltanks der Typen 48 F oder 48 Y(d). Sie sind zulässig für einen Anreicherungsgrad bis 4,5 % U235 und haben einen Außendurchmesser von 48 Zoll (ca. 122 cm),[53] eine Wandstärke von 16 mm[54] einen Inhalt von rund 4000 Liter, eine Eigenmasse von rund 2,36 t und erlauben eine Füllmenge von bis zu 12,5 Tonnen UF6 mit einem Anreicherungsgrad von bis zu 4,5 % U235.[55] Für den Transport des angereicherten Uranhexafluorids werden kleinere Behälter des Typs 30 B benutzt. Sie haben einen Durchmesser von 30 Zoll (ca. 76 cm) mit einem Inhalt von 2,277 Tonnen.[53] Die Gefahrgutverordnung Straße, Eisenbahn und Binnenschifffahrt (GGVSEB) enthält dazu eine Regelung zur Zulassung der Bauart von Verpackungen für nicht spaltbares oder spaltbares freigestelltes Uranhexafluorid.[56]
Für beliebig hoch - theoretisch bis 100 % - angereichertes UF6 sind nach US DOE nur viel kleinere "Cylinders" mit Durchmessern von 1,5-5 Zoll aus den hitzebeständigeren Metallen Nickel oder Monel zulässig. Notwendig sind die kleineren Gefäße, um durch Abstandhalter und eventuell Abschirmen Kritikalität vermeiden zu können, die notwendig ist, um das Anlaufen einer Kernspaltungskettenreaktion zu verhindern.
Die Transporte sind von der IAEO geregelt.[57] Sie sind jedoch umstritten[58] und führten unter anderem zu mehreren Anfragen im Deutschen Bundestag[59][60][61][62][63] und im Landtag von Baden-Württemberg.[64] In der öffentlichen Diskussion stehen diese Transporte insbesondere, nachdem am 1. Mai 2013 auf dem Uranhexafluorid befördernden Frachter Atlantic Cartier im Hamburger Hafen ein Feuer ausgebrochen war und es erhebliche Schwierigkeiten gab, dieses zu löschen.[65]

In den Vereinigten Staaten lagerten im Jahr 2000 mindestens 46.422 Fässer mit Uranhexafluorid an mindestens drei Orten: Auf dem Gelände der K-25 genannten ehemaligen Urananreicherungsanlage bei Oak Ridge im Bundesstaat Tennessee lagerten 4.683 Fässer, 28.351 in der Urananreicherungsanlage in Paducah in Kentucky und 13.388 in der Urananreicherungsanlage in Portsmouth in Ohio.[66]

Es gab in den Vereinigten Staaten mehrere Unfälle mit Uranhexafluorid. Einer ereignete sich im Jahr 1986 an einer Anlage der Sequoyah Fuels Corporation in der Nähe von Gore im Bundesstaat Oklahoma. Als man einen überfüllten Tank erwärmte, um ausgetretenes Material zu entfernen, platzte der Tank auf.[67]
Physiologische Wirkungen und Sicherheitshinweise
Uranhexafluorid wirkt hauptsächlich auf drei verschiedene Weisen auf den menschlichen Körper:[68]
- Es ist eine sehr aggressive Substanz, die jedes Gewebe angreift. Beim Kontakt des Gases mit Körperflüssigkeiten bildet sich Flusssäure, die auf der Haut und den Schleimhäuten der Atemwege Verätzungen hervorruft. Die Exposition des Menschen gegenüber dem Gas wirkt sich zunächst auf die Augen und Atemwege aus und verursacht Reizungen, Verlust des Sehvermögens, Husten und übermäßige Bildung von Speichel und Auswurf. Nach längerer Exposition führt dies zu Pneumonitis und Lungenödemen und kann zum Tod führen.
- Es ist – wie alle sechswertigen Uranverbindungen – sehr giftig beim Einatmen und Verschlucken. Außerdem besteht die Gefahr der Anreicherung im menschlichen Körper, was vor allem die Leber und die Nieren betrifft.
- Wie alle Uranverbindungen ist es radioaktiv. Die Aktivität ist von der Isotopenzusammensetzung des Urans abhängig. 238U hat eine Halbwertszeit von 4,468 Milliarden Jahren[69] und ist wie die anderen natürlichen Isotope (234U und 235U) ein α-Strahler. Die spezifische Aktivität von 238U beträgt 12,35 Bq/mg.[70] 235U hat eine Halbwertszeit von 704 Millionen Jahren.[69] Es ist spaltbar und hat in natürlichem Uranvorkommen einen Anteil von etwa 0,7 %. Angereichertes Uranhexafluorid ist aufgrund der niedrigeren Halbwertszeit deutlich aktiver. Hierbei ist vor allem der Effekt des 234U relevant, welches in natürlichem Uran etwas weniger als die Hälfte der Aktivität bei nur 55 ppm Anteil ausmacht. Je nach Anreicherung kann es einen erheblichen Anteil der Aktivität ausmachen.
Für die Arbeiter in der Anlage in Paducah liegen Studien zur Mortalität im Rahmen einer retrospektiven Untersuchung zur gesundheitlichen Belastung und zu Suizidrisiken vor.[71][72]
Literatur
- Alfred Heinzelmann: Das Uranhexafluorid, ein Beitrag zur Kenntnis des sechswertigen Urans (Dissertation, Danzig, 27. Juni 1911), 55 S. (Digitalisat). – Hinweis in: Verzeichnis der bis Ende 1912 an den Technischen Hochschulen des Deutschen Reiches erschienenen Schriften, S. 60 (eingeschränkte Vorschau in der Google-Buchsuche).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil A, S. 121–123.
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 71–163.
- R. DeWitt: Uranium hexafluoride: A survey of the physico-chemical properties, Technical report, GAT-280; Goodyear Atomic Corp., Portsmouth, Ohio; 12. August 1960, 164 S. (doi:10.2172/4025868).
- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt, Stephen F. Wolf: Uranium; in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 253–698 (doi:10.1007/1-4020-3598-5_5), hier S. 530–531, 557–564.
Einzelnachweise
- Eintrag zu Uranhexafluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Februar 2020. (JavaScript erforderlich)
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 90.
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag uranium compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 10. Februar 2020. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.
- Gerald K. Johnson: The Enthalpy of Formation of Uranium Hexafluoride; in: The Journal of Chemical Thermodynamics, 1979, 11 (5), S. 483–490 (doi:10.1016/0021-9614(79)90126-5).
- Otto Ruff: Über einige neue Fluoride; in: Chem. Ber., 1909, 42 (1), S. 492–497, hier S. 495–497 (doi:10.1002/cber.19090420175).
- Alfred Heinzelmann: Das Uranhexafluorid, ein Beitrag zur Kenntnis des sechswertigen Urans (Dissertation, Danzig, 27. Juni 1911), 55 S. (Digitalisat).
- Otto Ruff, Alfred Heinzelmann: Über das Uranhexafluorid; in: Zeitschrift für anorganische Chemie, 1911, 72 (1), S. 63–84 (doi:10.1002/zaac.19110720106).
- Originalschreibweise (!).
- A. Ditte: Sur les composés fluorés de l'uranium; in: Compt. Rend., 1880, 91, S. 115–118 (Digitalisat auf Gallica).
- Alfred Ditte: Recherches sur l'uranium; in: Ann. Chim. Phys., 1884, 6 (1), S. 338–358 (Digitalisat auf Gallica).
- Arthur Smithells: On some fluorine compounds of uranium; in: J. Chem. Soc., Trans., 1883, 43, S. 125–135 (doi:10.1039/CT8834300125).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil A, S. 121–123.
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 71.
- Aristid v. Grosse: Chemical Properties of Uranium Hexafluoride, UF6; Technical Report, A-83; Columbia University, New York, NY; 25. Juni 1941 (doi:10.2172/962915).
- B. Weinstock, R. H. Crist: The Vapor Pressure of Uranium Hexafluoride; in: J. Chem. Phys., 1948, 16, S. 436–441 (doi:10.1063/1.1746915; Maschinoskript (12. April 1943)).
- I. Kirshenbaum: The Physical Properties of Uranium Hexafluoride; Technical Report, 2M-503; 2R-464; A-753; SAM Labs; 1. Juli 1943 (doi:10.2172/4416966).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 72–85.
- Patent US2535572A: Preparation of UF6. Angemeldet am 9. April 1948, veröffentlicht am 26. Dezember 1950, Erfinder: Raymond M. Hainer.
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 80.
- John G. Malm, Bernard Weinstock, E. Eugene Weaver: The Preparation and Properties of NpF6; a Comparison with PuF6; in: J. Phys. Chem., 1958, 62 (12), S. 1506–1508 (doi:10.1021/j150570a009).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 78–80.
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 76.
- Bruce McNamara, Randall Scheelea, Anne Kozeliskya, Matthew Edwards: Thermal Reactions of Uranium Metal, UO2, U3O8, UF4, and UO2F2 with NF3 to produce UF6; in: Journal of Nuclear Materials, 2009, 394 (2–3), S. 166–173 (doi:10.1016/j.jnucmat.2009.09.004).
- George D. Oliver, H. T. Milton, J. W. Grisard: The Vapor Pressure and Critical Constants of Uranium Hexafluoride; in: J. Am. Chem. Soc., 1953, 75 (12), S. 2827–2829 (doi:10.1021/ja01108a011).
- Ferdinand G. Brickwedde, Harold J. Hoge, Russell B. Scott: The Low Temperature Heat Capacities, Enthalpies, and Entropies of UF4 and UF6; in: J. Chem. Phys., 1948, 16, S. 429–436 (doi:10.1063/1.1746914).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 95.
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 97.
- Joseph F. Masi: The Heats of Vaporization of Uranium Hexafluoride; in: J. Chem. Phys., 1949, 17, S. 755–758 (doi:10.1063/1.1747395).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 100–101.
- Paul Henkel, Wilhelm Klemm: Magnetochemische Untersuchungen. XII. Das Magnetische Verhalten einiger flüchtiger Fluoride; in: Zeitschrift für anorganische Chemie, 1935, 222, S. 70–72 (doi:10.1002/zaac.19352220110).
- Woldemar Tilk, Wilhelm Klemm: Magnetochemische Untersuchungen. XXXI. Über den Paramagnetismus von Verbindungen des sechswertigen Chroms, Molybdäns, Wolframs und Urans; in: Zeitschrift für anorganische Chemie, 1939, 240, S. 355–368 (doi:10.1002/zaac.19392400408).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 119.
- Masao Kimura, Werner Schomaker, Darwin W. Smith, Bernard Weinstock: Electron-Diffraction Investigation of the Hexafluorides of Tungsten, Osmium, Iridium, Uranium, Neptunium, and Plutonium; in: J. Chem. Phys., 1968, 48 (8), S. 4001–4012 (doi:10.1063/1.1669727).
- J. C. Taylor, P. W. Wilson, J. W. Kelly: The Structures of Fluorides. I. Deviations from Ideal Symmetry in the Structure of Crystalline UF6: A Neutron Diffraction Analysis; in: Acta Cryst., 1973, B29, S. 7–12 (doi:10.1107/S0567740873001895).
- John H. Levy, John C. Taylor, Paul W. Wilson: Structure of Fluorides. Part XII. Single-crystal Neutron Diffraction Study of Uranium Hexafluoride at 293 K; in: J. Chem. Soc., Dalton Trans., 1976, S. 219–224 (doi:10.1039/DT9760000219).
- J. C. Taylor, P. W. Wilson: The Structures of Fluorides X. Neutron Powder Diffraction Profile Studies of UF6 at 193°K and 293°K; in: Journal of Solid State Chemistry, 1975, 14 (4), S. 378–382 (doi:10.1016/0022-4596(75)90059-6).
- J. H. Levy, J. C. Taylor, A. B. Waugh: Neutron Powder Structural Studies of UF6, MoF6 and WF6 at 77 K; in: Journal of Fluorine Chemistry, 1983, 23 (1), S. 29–36 (doi:10.1016/S0022-1139(00)81276-2).
- Howard H. Claassen, Gordon L. Goodman, John H. Holloway, Henry Selig: Raman Spectra of MoF6, TcF6, ReF6, UF6, SF6, SeF6, and TeF6 in the Vapor State; in: J. Chem. Phys., 1970, 53 (1), S. 341–348 (doi:10.1063/1.1673786).
- B. Weinstock, E. E. Weaver, J. G. Malm: Vapour-Pressures of NpF6 and PuF6; Thermodynamic Calculations with UF6, NpF6 and PuF6; in: Journal of Inorganic and Nuclear Chemistry, 1959, 11 (2), S. 104–114 (doi:10.1016/0022-1902(59)80054-3).
- Ezra Bar-Ziv, Mira Freiberg, Shmuel Weiss: The Infrared Spectrum of UF6; in: Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 1972, 28 (11), S. 2025–2028 (doi:10.1016/0584-8539(72)80176-4).
- Robin S. McDowell, Larned B. Asprey, Robert T. Paine: Vibrational Spectrum and Force Field of Uranium Hexafluoride; in: J. Chem. Phys., 1974, 61 (9), S. 3571–3580 (doi:10.1063/1.1682537).
- E. R. Bernstein, G. R. Meredith: Vibrational Spectra of Transition Metal Hexafluoride Crystals: III. Exciton Band Structures of MoF6, WF6 and UF6; in: Chemical Physics, 1977, 24 (3), S. 311–325 (doi:10.1016/0301-0104(77)85091-X).
- K. C. Kim, R. N. Mulford: Vibrational Properties of Actinide (U, Np, Pu, Am) Hexafluoride Molecules; in: Journal of Molecular Structure: THEOCHEM, 1990, 207 (3–4), S. 293–299 (doi:10.1016/0166-1280(90)85031-H).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 126.
- R. W. Kessie: Plutonium and Uranium Hexafluoride Hydrolysis Kinetics; in: Ind. Eng. Chem. Proc. Des. Dev., 1967, 6 (1), S. 105–111 (doi:10.1021/i260021a018).
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 146–148.
- Gmelins Handbuch der anorganischen Chemie, System Nr. 55, Uran, Teil C 8, S. 160.
- Jan Uhlíř, Martin Marečeka: Fluoride Volatility Method for Reprocessing of LWR and FR Fuels; in: Journal of Fluorine Chemistry, 2009, 130 (1), S. 89–93 (doi:10.1016/j.jfluchem.2008.07.002).
- James V. Beitz, Clayton W. Williams: Photochemical Removal of NpF6 and PuF6 from UF6 Gas Streams, international symposium to commemorate the 50th anniversary of discovery of transuranium elements, Washington, DC (USA), 26.–31. August 1990 (Abstract; PDF); abgerufen am 10. Februar 2020.
- Patent EP0733023B1: Reinigung von Uranhexafluorid. Angemeldet am 6. Dezember 1994, veröffentlicht am 14. April 1999, Anmelder: British Nuclear Fuels Plc, Erfinder: Andrew Philip Jeapes et al.
- Wirtschaftsverband Kernbrennstoff-Kreislauf und Kerntechnik e. V.: Uranhexafluorid-Transporte (Memento vom 14. Juli 2014 im Internet Archive)
- DUF6 Guide: UF6 Cylinder Data Summary (US Department of Energy); abgerufen am 10. Februar 2020. - Korrektur; Typ 2S hat 2,5" Durchmesser.
- Julia Beißwenger: Zwischenlager durch Urananreicherung, dradio.de, Deutschlandfunk, Forschung Aktuell, 28. Juli 2011; abgerufen am 10. Februar 2020.
- Bundesamt für Strahlenschutz: Genehmigungen gemäß § 3 Absatz 1. StrlSchV oder § 6 AtG für die Zwischenlagerung von abgereichertem bzw. natürlichem und angereichertem Uran in Form von Uranhexafluorid (UF6); Genehmigungsvoraussetzungen und Auflagen; abgerufen am 10. Februar 2020.
- Bundesministerium für Justiz: Verordnung über die innerstaatliche und grenzüberschreitende Beförderung gefährlicher Güter auf der Straße, mit Eisenbahnen und auf Binnengewässern (Gefahrgutverordnung Straße, Eisenbahn und Binnenschifffahrt – GGVSEB); § 8 Zuständigkeiten der Bundesanstalt für Materialforschung und -prüfung; Satz 2 (Stand 22. Januar 2013); abgerufen am 10. Februar 2020.
- IAEA-TECDOC-608: Interim guidance on the safe transport of uranium hexafluoride; Juli 1991 (PDF; 2,7 MB); abgerufen am 10. Februar 2020.
- Gerhard Piper: Internationaler Uranhexafluorid-Tourismus durch Deutschland; Telepolis, 30. Juni 2007; abgerufen am 10. Februar 2020.
- Deutscher Bundestag, Drucksache 14/435: Transporte von Uranhexafluorid; 23. März 1999 (PDF; 213 kB); abgerufen am 10. Februar 2020.
- Deutscher Bundestag, Drucksache 14/6692: Transporte und Lagerung von Uranhexafluorid in der Bundesrepublik Deutschland; 16. Juli 2001 (PDF; 375 kB); abgerufen am 10. Februar 2020.
- Deutscher Bundestag, Drucksache 16/5174: Transporte und Lagerung von Uranhexafluorid; 27. April 2007 (PDF; 114 kB); abgerufen am 10. Februar 2020.
- Deutscher Bundestag, Drucksache 17/253: Uranhexafluorid – Sichere Lagerung und sachgemäßer Umgang zur Vermeidung von Umweltrisiken; 16. Dezember 2009 (PDF; 1,7 MB); abgerufen am 10. Februar 2020.
- Deutscher Bundestag, Drucksache 18/1726: Transporte und Lagerung von Uranhexafluorid und Uranoxid im Zusammenhang mit der Urananreicherung in Gronau; 11. Juni 2014 (PDF; 347 kB); abgerufen am 10. Februar 2020.
- Landtag von Baden-Württemberg, Drucksache 14/4880: Sicherheit von Uranhexafluorid-Transporten durch Baden-Württemberg; 21. Juli 2009 (PDF; 39 kB); abgerufen am 10. Februar 2020.
- Zeit online: Brennender Frachter hatte radioaktives Material geladen, 17. Mai 2013; abgerufen am 10. Februar 2020.
- Mary Byrd Davis: What’s Ahead for the Nation’s Depleted Uranium Hexafluoride? (Memento vom 10. März 2013 im Internet Archive), 5. November 2000; Yggdrasil Institute (a project of Earth Island Institute); abgerufen am 10. Februar 2020.
- Assessment of the Public Health Impact From the Accidental Release of UF6 at the Sequoyah Fuels Corporation Facility at Gore, Oklahoma (PDF; 5,6 MB); Docket No. 40-8027. License No. SUB-1010. Manuscript Completed: March 1986; Date Published: March 1986. Ad Hoc Interagency Public Health Assessment Task Force, U.S. Nuclear Regulatory Commission; Washington, D.C. 20555.
- Stephen A. McGuire: Chemical Toxicity of Uranium Hexafluoride Compared to Acute Effects of Radiation, NUREG-1391, U.S. Nuclear Regulatory Commission, 1991 (PDF); abgerufen am 10. Februar 2020.
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. Band A 729, 2003, S. 3–128. doi:10.1016/j.nuclphysa.2003.11.001. (PDF; 1,0 MB).
- Bundesinstitut für Risikobewertung: BfR empfiehlt die Ableitung eines europäischen Höchstwertes für Uran in Trink- und Mineralwasser, Gemeinsame Stellungnahme Nr. 20/2007 des BfS und des BfR vom 5. April 2007, S. 7 (Tabelle 1: Spezifische Aktivitäten von U 234, U 235 und U 238 bezogen auf 1 mg Natururan); abgerufen am 10. Februar 2020.
- C. Chan, T. S. Hughes, S. Muldoon, T. Aldrich, C. Rice, R. Hornung, G. Brion, D. J. Tollerud: Mortality patterns among Paducah Gaseous Diffusion Plant workers; in: J Occup Environ Med, 2010, 52 (7), S. 725–732 (PMID 20595915; PMC 2983475 (freier Volltext)).
- L. W. Figgs, H. Holsinger, S. J. Freitas, G. M. Brion, R. W. Hornung, C. H. Rice, D. Tollerud: Increased suicide risk among workers following toxic metal exposure at the Paducah gaseous diffusion plant from 1952 to 2003: a cohort study; in: Int J Occup Environ Med, 2011, 2 (4), S. 199–214 (PMID 23022839).
Weblinks
- Simon Cotton (Uppingham School, Rutland, UK): Uranium Hexafluoride; abgerufen am 10. Februar 2020.
- DUF6 Guide: Uranium Hexafluoride (UF6) – Physical and chemical properties of UF6, and its use in uranium processing – Uranium Hexafluoride and Its Properties (US Department of Energy); abgerufen am 10. Februar 2020.


