Urandicarbid
Urandicarbid ist eine chemische Verbindung aus der Gruppe der Urancarbide.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
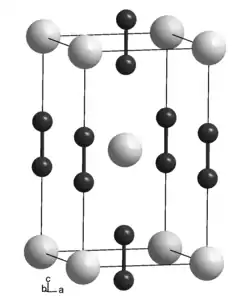 | ||||||||||
| _ U2+ _–_ C22− | ||||||||||
| Allgemeines | ||||||||||
| Name | Urandicarbid | |||||||||
| Andere Namen |
Uranacetylid | |||||||||
| Verhältnisformel | UC2 | |||||||||
| Kurzbeschreibung |
hellgrauer Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 262,05 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
11,68 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
4370 °C[3] | |||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||

Radioaktiv | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Urandicarbid kann durch Reaktion von reinstem Uran(IV)-oxid oder Uran(V,VI)-oxid mit reinstem Graphit im Vakuum bei Temperaturen zwischen 1800 °C[2] und 2400 °C gewonnen werden. Zur Herstellung keramischer Formkörper (z. B. Reaktorpellets) verpresst man die Ausgangsstoffe und sintert bei 2250 °C. Die stöchiometrische Zusammensetzung wird bei den Synthesen gewöhnlich nicht ganz erreicht. Normalerweise erhält man Präparate mit der Zusammensetzung UC1,85 bis UC1,9.[1]
Die Reaktion eines stöchiometrischen Gemisches von Uran und Kohlenstoff bei 2400 °C liefert nur ein Reaktionsprodukt mit der Zusammensetzung UC1,85 bis UC1,94. Die Stöchiometrie UC2 wird nicht erreicht.[1]
Bei der Herstellung ist zu beachten, dass Urancarbide häufig durch Sauerstoff verunreinigt werden, wodurch Uranoxidcarbid-Mischkristalle UC1−xOx entstehen.[7]
Eigenschaften
Urandicarbid liegt in Form einer hellgrauen, metallglänzenden kristallinen Masse vor.[1] Sie zerfällt bei Temperaturen unterhalb 1600 °C allmählich in Uranmonocarbid und Kohlenstoff.[8][9] Urandicarbid reagiert mit heißem Wasser unter Bildung von Wasserstoff, Methan, höheren Paraffinkohlenwasserstoffen und Spuren von Ethin, Kohlenmonoxid und Kohlendioxid.[1] Die Reaktion findet jedoch auch schon bei Raumtemperatur statt. Ähnliche Reaktionen kann man auch bei Reaktion mit Salz- und Schwefelsäure beobachten. Bei Reaktion mit Salpetersäure entstehen keine Kohlenwasserstoff-Verbindungen. Stattdessen wird ein Großteil des Kohlenstoffs in Kohlendioxid umgewandelt.[7] In Ethanol ist Urandicarbid wenig löslich.[3] In Luft oder Sauerstoff entzündet sich die Verbindung bei etwa 400 °C.[10] Ab 1100 °C reagiert sie mit Stickstoff.[11] Urandicarbid besitzt eine tetragonale Kristallstruktur mit der Raumgruppe I4/mmm (Raumgruppen-Nr. 139) und den Gitterparametern a = 352,7 pm und c = 600,2 pm. Diese Form existiert von Zimmertemperatur bis 1800 °C. Sie wandelt sich oberhalb von 1800 °C in eine kubische Form (a = 548,8 pm) mit der Raumgruppe Fm3m (Raumgruppen-Nr. 225) um.[1] In tetragonalen Urandicarbidkristallen wurde eine Bildung von Spiegelzwillingen beobachtet und als Zwillingsebene die {112}-Ebene gefunden.[12]
Verwendung
Urancarbide werden in Hochtemperatur- und Brutreaktoren verwendet.[13] Urandicarbid wurde als Reaktorbrennstoff im Block 1 des Kernkraftwerk Peach Bottom verwendet.[14][15] Auch beim Kernkraftwerk THTR-300 auch ein Gemisch aus Urandicarbid und Thoriumdicarbid als Brennstoff verwendet werden.[16]
Einzelnachweise
- Georg Brauer (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearb. Auflage. Band II. Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1240.
- Joseph Jacob Katz, Eugene Rabinowitch: Chemistry of Uranium - Collected Papers. United States Atomic Energy Commission, Technical Information Service Extension, 1958, S. 71 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2016, ISBN 978-1-4398-1462-8, S. 488 (eingeschränkte Vorschau in der Google-Buchsuche).
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Uranverbindungen, soweit in diesem Anhang nicht gesondert aufgeführt im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 3. November 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Uranverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. November 2021. (JavaScript erforderlich)
- Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.
- Dissertation Rocky-Pitua Sutanto: Das Verhalten der Urancarbide und -oxicarbide in endlagerrelevanten aquatischen Phasen.
- E. Rudy, F. Benesovsky: Zur Kenntnis der Stabilität des Urandicarbids und der Kohlenstoff-stabilen Bereiche in den Partialsystemen von UC mit ZrC, HfC, NbC und TaC. In: Monatshefte für Chemie. 94, 1963, S. 204, doi:10.1007/BF00900240.
- H. Holleck, H. Kleykamp: U Uranium Uranium Carbides. Springer Science & Business Media, 2013, ISBN 978-3-662-10716-4, S. 135 (eingeschränkte Vorschau in der Google-Buchsuche).
- L. Roth, U. Weller-Schäferbarthold: Gefährliche Chemische Reaktionen - Potentiell gefährliche chemische Reaktionen zu über 1750 Stoffen, Eintrag für Urandicarbid, CD-ROM Ausgabe 8/2021, ecomed Sicherheit Landsberg/Lech, ISBN 978-3-609-48040-4 .
- J.J. Katz, Eugene Rabinowitch: The Chemistry of Uranium. 1961, ISBN 5-88135-966-6, S. 224 (eingeschränkte Vorschau in der Google-Buchsuche).
- E.M. Hörl: Zwillingsbildung in urandikarbid kristallen. In: Journal of Nuclear Materials. 12, 1964, S. 193, doi:10.1016/0022-3115(64)90140-0.
- Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner: Industrielle Anorganische Chemie - Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner. John Wiley & Sons, 2013, ISBN 978-3-527-64959-4, S. 616 (eingeschränkte Vorschau in der Google-Buchsuche).
- United States. Office of Saline Water: Proceedings. U.S. Dept. of the Interior, Office of Saline Water; for sale by the Supt. of Docs., U.S. Govt. Print. Off., 1965, S. 91 (eingeschränkte Vorschau in der Google-Buchsuche).
- L. M. Ferris; M. J. Bradley; U.S. Atomic Energy Commission.; Oak Ridge National Laboratory; 1964. Off-gases from the reactions of uranium carbides with nitric acid at 90°C (Memento vom 26. Juli 2014 im Internet Archive), abgerufen am 19. Juli 2014.
- Manfred Grathwohl: Energieversorgung: Ressourcen, Technologien, Perspektiven. Walter de Gruyter, 1983, S. 206 (eingeschränkte Vorschau in der Google-Buchsuche).


