Brompentafluorid
Brompentafluorid ist eine anorganisch-chemische Verbindung aus der Stoffgruppe der Interhalogenverbindungen, die aus den Elementen Brom und Fluor besteht.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
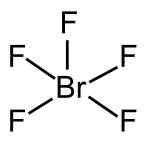 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Brompentafluorid | |||||||||||||||
| Andere Namen |
Brom(V)-fluorid | |||||||||||||||
| Summenformel | BrF5 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 174,896 g·mol−1 | |||||||||||||||
| Dichte |
2,46 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
40,8 °C[3] | |||||||||||||||
| Löslichkeit |
zersetzt sich in Wasser[2] | |||||||||||||||
| Brechungsindex |
1,3529 (25 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 0,1 ml·m−3 bzw. | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
Brompentafluorid kann durch Reaktion von Brom mit Fluor gewonnen werden.[6]
Eigenschaften
Brompentafluorid ist eine farblose, an der Luft stark rauchende, stechend riechende Flüssigkeit, die sich in Wasser zersetzt[2] und fast alle Materialien angreift. Mit organischen Verbindungen ist die Reaktion zum Teil sehr heftig, unter Umständen explosiv.[1] Der Stoff selbst ist zwar unbrennbar, reagiert jedoch derartig stark mit brennbaren Stoffen, dass eventuell keine Zündquelle für einen Brand benötigt wird, und bestehende Brände stark gefördert werden.[2] Trockenes Glas wird bei gewöhnlicher Temperatur langsam angegriffen, Quarzglas praktisch gar nicht.[6]
Molekülgeometrie
Brompentafluorid besitzt gemäß dem VSEPR-Modell eine quadratisch-pyramidale Molekülgeometrie. Die vier FBrF-Winkel betragen dabei 84,8°. Die axiale Br–F-Bindung, welche die Spitze der quadratischen Pyramide bildet, besitzt eine Länge von 168,9 pm. Die vier planaren Br–F-Bindungen, welche die quadratische Grundfläche der Pyramide bilden, haben eine Länge von 177,4 pm. Das freie Elektronenpaar am Brom-Atom ist dabei axial angeordnet, um einen möglichst großen Abstand zu den Fluor-Atomen zu gewährleisten.[7]
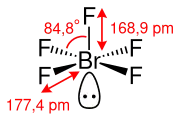
Brompentafluorid besitzt als Molekülsymmetrie die Punktgruppe C4v.[7]
Verwendung
Brompentafluorid wird in der anorganischen Chemie zur Fluorierung verwendet.[1]
Sicherheitshinweise
Brompentafluorid ist giftig, brandfördernd und verursacht Verätzungen, es sollte kühl und trocken gelagert werden.[2]
Einzelnachweise
- Eintrag zu Bromfluoride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- Eintrag zu Brompentafluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 57.–70. Auflage. Walter de Gruyter, Berlin 1964, S. 132.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Index of Refraction of Inorganic Liquids, S. 4-140.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7789-30-2 bzw. Brompentafluorid), abgerufen am 3. September 2020.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 170.
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 508–509 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche). (abgerufen über De Gruyter Online)


