Bromtrifluorid
Bromtrifluorid ist eine farblose bis gelbliche Flüssigkeit[1] die chemisch eine Verbindung zwischen den Halogenen Brom und Fluor darstellt. Sie wurde 1906 durch Paul Lebeau entdeckt.[6] Sie ist eine Interhalogenverbindung.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
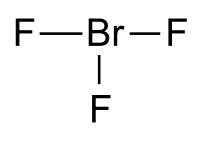 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bromtrifluorid | |||||||||||||||
| Andere Namen |
Brom(III)-fluorid | |||||||||||||||
| Summenformel | BrF3 | |||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 136,90 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
125,72 °C[2] | |||||||||||||||
| Löslichkeit |
Heftige Reaktion mit Wasser[3] | |||||||||||||||
| Brechungsindex |
1,4536 (25 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
Bromtrifluorid kann durch Reaktion von Brom mit Fluor erhalten werden.[7]
Auch die Darstellung durch Disproportionierung von Bromfluorid ist möglich.
Sehr reines Bromtrifluorid kann durch Direktfluorierung von Brom mit Trichlorfluormethan bei −40 °C gewonnen werden.[7]
Eigenschaften
Bromtrifluorid ist eine farblose, an der Luft rauchende Flüssigkeit. Es ist sehr reaktionsfähig und greift die Haut stark an. Selbst Quarz und andere Silicate werden bereits bei 30 °C merklich angegriffen.[3] In fester Form liegt es als lange Prismen vor.[7] Die kritische Temperatur liegt bei 327 °C.[3]
Ähnlich wie Chlortrifluorid und Iodtrifluorid ist Bromtrifluorid ein T-förmiges Molekül. Der Abstand zwischen Brom und dem axialen Fluor beträgt jeweils 181 pm, während der Abstand zu dem mittleren Fluor 172 pm beträgt. Der Winkel zwischen dem mittleren und dem axialen Fluor beträgt 86,2°.
Verwendung
Bromtrifluorid ist ein gutes Lösungsmittel für Reaktionen, die unter stark oxidierenden Bedingungen ablaufen. Es ist weiterhin ein starkes Fluorierungsmittel und kann zur Synthese entsprechender organischer und anorganischer Verbindungen eingesetzt werden.[8]
Einzelnachweise
- Eintrag zu Bromfluoride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- J. H. Simons: Bromine(III) fluoride. In: Ludwig F. Audrieth (Hrsg.): Inorganic Syntheses. Band 3. McGraw-Hill, Inc., 1950, S. 184–186 (englisch).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Index of Refraction of Inorganic Liquids, S. 4-140.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- P. Lebeau: The effect of fluorine on chloride and on bromine in Ann. Chim. Phys. 9 (1906) 241–263.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 169.
- Kirk-Othmer Encyclopedia of Chemical Technology: Bromine, Inorganic Compounds (Memento des Originals vom 30. September 2007 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..