Stickstofftrifluorid
Stickstofftrifluorid ist eine chemische Verbindung, die zur Gruppe der Stickstoffhalogenide gehört. Das Gas hat ein sehr hohes Treibhauspotential.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
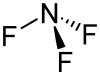 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Stickstofftrifluorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | NF3 | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit modrigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 71,00 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
1,89 g·cm−3 (−129 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−129 °C[1] | |||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (61 mg·l−1 bei 20 °C)[1] | |||||||||||||||
| Dipolmoment | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 10 ml·m−3 bzw. 30 mg·m−3[3] | |||||||||||||||
| Treibhauspotential |
19700 (bezogen auf 100 Jahre)[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Stickstofftrifluorid wurde 1928 von Otto Ruff (1871–1939) erstmals durch Elektrolyse von wasserfreiem Ammoniumhydrogendifluorid (NH4HF2) dargestellt.[5] Im Jahre 1957 gelang es Peter Sartori, das Verfahren wesentlich sicherer zu machen, indem er die als Nebenprodukte entstehenden instabilen und explosiven Stoffe Fluoramin NH2F und Difluoramin NHF2 durch bei der Reaktion eingebrachten Braunstein eliminierte.[6]
Gewinnung und Darstellung
Es kann durch katalytische Umsetzung von Ammoniak mit Fluor oder durch Elektrolyse geschmolzenen Ammoniumhydrogenfluorids hergestellt werden:[7]
Die Darstellung aus den Elementen ist dagegen nur unter ungewöhnlichen Bedingungen (d. h. elektrische Entladungen bei hohem Druck und hohen Temperaturen[8]) möglich.
Eigenschaften
Physikalische Eigenschaften
Stickstofftrifluorid ist trigonal-pyramidal aufgebaut, wobei das Stickstoffatom an der Spitze der Pyramide lokalisiert ist.[9] Die Bindungslängen und -winkel sind im Bild dargestellt.

Chemische Eigenschaften
Stickstofftrifluorid reagiert bei Raumtemperatur nicht mit Wasser und besitzt im Gegensatz zu Ammoniak nahezu keine basischen Eigenschaften. Es ist ein starkes Oxidationsmittel. Mit Aluminiumchlorid reagiert es zu Aluminiumfluorid:[10]
Umwelteigenschaften und Vorkommen
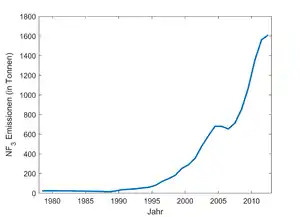
Stickstofftrifluorid hat als Treibhausgas auf einen Zeithorizont von 100 Jahren bezogen ein Treibhauspotential von 19.700. Ein Kilogramm Stickstofftrifluorid wärmt das Klima somit 19.700 mal so stark wie ein Kilogramm Kohlenstoffdioxid.[4] Stickstofftrifluorid hat eine atmosphärische Lebensdauer von 509 ± 21 Jahren. In der Atmosphäre wird es hauptsächlich durch Photolyse (zu ca. 70 %) und durch die Reaktion mit Sauerstoffradikalen (zu ca. 30 %) abgebaut.[4] Im Jahr 2008 lag die Stickstofftrifluorid-Konzentration in der Troposphäre bei 0,45 ppt (Teile pro Billion Luftteile),[12] 2011 bei 0,86 ppt[12] und 2016 bei knapp 1 ppt.[4] Die Konzentration liegt auf der nördlichen Hemisphäre signifikant höher als auf der südlichen. Dieses Ergebnis passt zur Lokalisation der hauptsächlichen Emittenden in den nördlichen Industriestaaten. Die Stickstofftrifluorid-Emissionen sind seit Ende der 1970er stark angestiegen. Lagen die jährlichen Emissionen in den 1980er bei etwa 20 Tonnen, waren es im Jahr 2000 bereits etwa 290 Tonnen und 2012 etwa 1610 Tonnen.[11] Die Stickstofftrifluorid-Emissionen aus dem Jahr 2012 entsprechen in ihrer Treibhauswirkung etwa 32 Millionen Tonnen Kohlenstoffdioxid.
Angesichts des hohen Treibhausgaspotentials wurde von Wissenschaftlern empfohlen, Stickstofftrifluorid auf die Liste der bedrohlichen Treibhausgase, deren Emissionen nach dem Kyoto-Protokoll überwacht werden, zu setzen.[13] In der UN-Klimakonferenz in Doha 2012 wurde in einem Zusatz zum Kyoto-Protokoll[14][15] die Chemikalie schließlich am 8. Dezember 2012 in die Liste der Treibhausgase aufgenommen. Diese Ergänzung gilt vom Beginn der zweiten Verpflichtungsperiode – Kyoto II – an bis zum Jahr 2020.
In Deutschland wird die Abgabe von Stickstofftrifluorid seit 2015 statistisch erfasst. Im Jahr 2016 wurden in Deutschland 38 Tonnen an Verwender abgegeben, das sind knapp 58 % weniger als im Vorjahr.[16]
Verwendung
Stickstofftrifluorid wird in der Halbleiter- und in sehr großer Menge in der Flüssigkristallbildschirm- und Solarindustrie zum Reinigen der PECVD-Beschichtungskammern von Siliciumdioxid, Siliciumoxidnitrid und Siliciumnitrid-Rückständen verwendet. Der starke Anstieg der Stickstofftrifluoridkonzentration in der Atmosphäre ist auf diese Anwendungen zurückzuführen.[17] Der Ersatz durch giftiges aber umweltschonenderes Fluor wird im technischen Maßstab erprobt.[18] Weiterhin kam es zeitweilig in militärischen Hochenergie-Fluorwasserstoff-Lasern (z. B. MIRACL) zum Einsatz, wurde als Oxidator in Raketentreibstoffen eingesetzt, als Zusatz zu Glühlampen-Gasfüllungen[10] erprobt und zur Herstellung von extrem giftigem Tetrafluorhydrazin (N2F4) – einer weiteren Raketentreibstoffkomponente und unerwünschtes Nebenprodukt der Stickstofftrifluoridherstellung – verwendet.
Produktion
Insgesamt wurden 2008 ungefähr 4000 Tonnen Stickstofftrifluorid produziert.[13] Der weltweit mit Abstand größte Hersteller ist das amerikanische Chemieunternehmen Air Products & Chemicals Inc. Würde die gesamte Stickstofftrifluoridjahresproduktion in die Erdatmosphäre entlassen, entspräche der hierdurch erzeugte Treibhauseffekt dem, der durch die Freisetzung von ungefähr 79 Mio. Tonnen CO2 erzeugt würde. Tatsächlich gelangen 2008 etwa 16 % der Jahresproduktion in die Atmosphäre.[13] Bis 2011 ist dieser Anteil auf etwa 10 % gesunken.[12]
Sicherheitshinweise
Stickstofftrifluorid ist nach EG-Richtlinien als brandfördernd und gesundheitsschädlich klassifiziert. Es zersetzt sich beim Erhitzen und reagiert heftig mit einigen organischen Verbindungen (z. B. brennbaren Stoffen).
Literatur
- O. Ruff, F. Luft, J. Fischer: Z. anorg. allg. Chem. 172, 1928, S. 417 ff.
- O. Ruff, Z. anorg. allg. Chem. 197, 1931, S. 273 ff.
- O. Ruff, L. Staub: Z. anorg. allg. Chem. 198, 1932, S. 32 ff.
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2. Auflage. Band 1, Academic Press 1963, ISBN 0-12-126601-X, S. 181–183.
Einzelnachweise
- Eintrag zu Stickstofftrifluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dipole Moments, S. 9-51.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7783-54-2 bzw. Stickstofftrifluorid), abgerufen am 2. November 2015.
- A. Totterdill, T. Kovács, W. Feng, S. Dhomse, C. J. Smith: Atmospheric lifetimes, infrared absorption spectra, radiative forcings and global warming potentials of NF3 and CF3CF2Cl (CFC-115). In: Atmos. Chem. Phys. Band 16, Nr. 17, 14. September 2016, ISSN 1680-7324, S. 11451–11463, doi:10.5194/acp-16-11451-2016.
- Patent EP1703001B1: Verwendung einer Anode für die elektrolytische Herstellung einer fluorhaltigen Substanz. Angemeldet am 14. März 2006, veröffentlicht am 4. September 2013, Anmelder: Permelec Electrode Ltd, Toyo Tanso Co, Erfinder: Tsuneto Furuta et al (Seite 3 Zeile 12).
- Vortrag für die Gruppe der Deutschen Fluorchemiker (PDF; 344 kB)
- H.P. Latscha, H.A. Klein: Anorganische Chemie, 2002, Springer, ISBN 3-540-42938-7, S. 312 ff.
- Oskar Glemser, Johann Schröder, Joachim Knaak: Notiz zur Darstellung von Stickstofftrifluorid durch Elektrolyse von geschmolzenem Ammoniumhydrogenfluorid. In: Chemische Berichte. Band 99, Nr. 1, S. 371–374, Januar 1966. doi:10.1002/cber.19660990157.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 695.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 697.
- M. Rigby, R. G. Prinn, S. O’Doherty, B. R. Miller, D. Ivy: Recent and future trends in synthetic greenhouse gas radiative forcing. In: Geophysical Research Letters. Band 41, Nr. 7, 16. April 2014, ISSN 1944-8007, S. 2013GL059099, doi:10.1002/2013GL059099.
- Tim Arnold, Christina M. Harth, Jens Mühle, Alistair J. Manning, Peter K. Salameh: Nitrogen trifluoride global emissions estimated from updated atmospheric measurements. In: Proceedings of the National Academy of Sciences. Band 110, Nr. 6, 5. Februar 2013, ISSN 0027-8424, S. 2029–2034, doi:10.1073/pnas.1212346110, PMID 23341630, PMC 3568375 (freier Volltext).
- Ray F. Weiss, Jens Mühle, Peter K. Salameh, Christina M. Harth: Nitrogen trifluoride in the global atmosphere. In: Geophysical Research Letters. Band 35, Nr. 20, 1. Oktober 2008, ISSN 1944-8007, S. L20821, doi:10.1029/2008GL035913.
- Doha Amendment to the Kyoto Protocol – Startseite. United Nations, Framework Convention on Climate Change.
- Doha Amendment to the Kyoto Protocol (PDF, Englisch; 120 kB). United Nations, Framework Convention on Climate Change. Abgerufen am 27. März 2013.
- Destatis: Abgabe von Schwefelhexafluorid 2016 gestiegen. In UmweltMagazin. 47, Nr. 6, 2017, ISSN 0173-363X, S. 12.
- Unterschätztes Treibhausgas. Wissenschaft.de, 3. Juli 2008, abgerufen am 8. September 2019.
- J. Oshinowo, A. Riva, M Pittroff, T. Schwarze and R. Wieland: Etch performance of Ar/N2/F2 for CVD/ALD chamber clean. In: Solid State Technology. 52, Nr. 2, 2009, S. 20–24.