Raubwürger
Der Raubwürger (Lanius excubitor), zuvor Nördlicher Raubwürger, ist eine etwa amselgroße Vogelart aus der Gattung Lanius innerhalb der Familie der Würger (Laniidae). Die Neubenennung wurde durch die taxonomische Revision notwendig, die 2016 den Taigaraubwürger (Lanius borealis) mit 6 Unterarten von L. excubitor abtrennte und in Artrang stellte; mit diesem dagegen wurden bis auf die Nominatform alle Unterarten des danach monotypischen Iberienraubwürgers (Lanius meridionalis) zusammengeführt. Mit Stand Ende 2018 ist der Raubwürger eine polytypische Art mit 11 oder nach anderer Einschätzung 12 Unterarten.[1][2]
| Raubwürger | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
.jpg.webp)
Raubwürger (Lanius excubitor) mit aufgespießter Beute | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Lanius excubitor | ||||||||||||
| Linnaeus, 1758 |
Der Raubwürger ist die größte und schwerste auch in Mitteleuropa vorkommende Art dieser Würgergattung. Raubwürger sind auffallende, vor allem grau, weiß und schwarz gefärbte Vögel. Männchen und Weibchen sind einander sehr ähnlich. Außer in Mittel-, Nord-, Ost- und Teilen Westeuropas ist die Art in Afrika von der Mittelmeerküste südwärts bis in den Savannengürtel nördlich des Äquators, im Nahen- und Mittleren Osten und in Zentralasien und Südasien, ostwärts bis zum Altai und Tien Shan und südwärts bis Zentralindien verbreitet. In Europa und Asien überschreiten die Brutgebiete von L. excubitor den Nördlichen Polarkreis deutlich. Er gehört damit zusammen mit Taigaraubwürger und Braunwürger zu den Vertretern der Gattung, die am weitesten nach Norden vorgedrungen sind. Diese nördlichsten Populationen des Raubwürgers sind Zugvögel; nach Süden hin nimmt die Zugbereitschaft kontinuierlich ab; die Vögel im südlichen und südöstlichen Verbreitungsbereich sind Standvögel. Raubwürger sind streng territorial und leben in saisonalen Paaren.
Wie die Mehrzahl der Echten Würger ist auch L. excubitor ein Ansitzjäger, der von einer erhöhten Warte aus die Umgebung beobachtet und geeignete Beutetiere nach einem kurzen Gleitflug meist am Boden schlägt. Die Art erbeutet Großinsekten und andere Wirbellose, sowie unterschiedliche kleine Wirbeltiere. Der Anteil an Wirbeltieren an der gesamten konsumierten Biomasse, insbesondere an Kleinnagern und Vögeln, wird nach Norden hin größer.
Der Gesamtbestand der Art ist gemäß der Einschätzungen von IUCN[3], HBW[2] und anderer Autoritäten ungefährdet (LC=least concern). Diese Bewertung erfolgt vor allem auf Grund des sehr großen Verbreitungsgebietes und des global noch immer sehr großen Bestandes. Dessen ungeachtet ist der Gesamtbestand rückläufig. In Mitteleuropa verschwand der Raubwürger aus sehr vielen Regionen. In Deutschland brüten noch maximal 2000 Paare, die meisten von ihnen in Niedersachsen und Sachsen[4], in Österreich bestehen zwei Restpopulationen im nördlichen Waldviertel mit einer stark schwankenden Anzahl von einigen 10 Brutpaaren[5], in der Schweiz brütet die einstmals regional nicht seltene Art seit 1986 nicht mehr.[6] In der Roten Liste der Brutvögel Deutschlands von 2020 wird die Art in der Kategorie 1 als vom Aussterben bedroht geführt.[7]
Merkmale
Allgemein

.jpg.webp)

Der Raubwürger ist ein gut amselgroßer, überwiegend grau wirkender, langschwänziger Vogel mit deutlichen schwarzen und – von Unterart zu Unterart unterschiedlich ausgeprägten – weißen Gefiederpartien.
Charakteristisch ist der graue Rumpf, wobei die Oberseite immer erheblich dunkler gefärbt ist als der Brust- und Bauchbereich, der bei einigen Unterarten fast weiß sein kann. Von der Basis des kräftigen, dunklen Hakenschnabels ausgehend, zieht sich ein rein schwarzes, schmales Band über die Augen bis zu den Ohrdecken, wo es sich leicht verbreitert. Die Stirn wird bei den meisten Unterarten von dieser Maske jedoch nicht erreicht. Bei der Mehrheit der Unterarten ist diese Gesichtsmaske von einem schmalen, weißen Brauenstreif begrenzt. Die relativ breiten und runden Flügel sind schwarz. Beim sitzenden Vogel erscheint immer ein kleines, weißes Flügelfeld, bei einigen Unterarten zwei, die gegeneinander verschoben sichtbar werden. Sie werden von der basalen Weißfärbung der Handschwingen und einer unterschiedlichen Anzahl der Armschwingen gebildet. Scharf kontrastieren die schwarzen Flügel mit einem hellen, manchmal reinweißen Gefiedersaum im Schulterbereich. Die Armschwingen sind immer deutlich reinweiß gesäumt. Der lange Schwanz ist abgerundet oder gestuft; er ist kontrastreich schwarz-weiß gefärbt, wobei die inneren Steuerfedern schwarz, die äußeren weiß sind; von unten wirkt der Schwanz fast reinweiß.
Im Flug wirkt der Raubwürger grau-schwarz-weiß. Charakteristisch in der Oberansicht sind das breite weiße Flügelfeld auf schwarzem Flügelgrund, die weiße Umsäumung der Armschwingen sowie der lange, meist abgerundete, weiß gerandete, schwarze Schwanz.
Die Geschlechter unterscheiden sich in der Größe nicht und in ihrer Färbung nur unwesentlich. Weibchen sind meist geringfügig weniger kontrastreich gezeichnet, häufig ist eine leichte Sperberung im Brust-, Flanken- und Nackenbereich erkennbar. Die weißen Gefiederanteile der Flügel und des Schwanzes sind beim Weibchen kleiner als beim Männchen und weniger scharf von den schwarzen abgesetzt. Die bei den Männchen tiefschwarzen Gefiederbereiche können bei den Weibchen ein sehr dunkles Braun aufweisen. Im Flug sind Männchen und Weibchen anhand der Flügelfärbung recht sicher unterscheidbar: Beim Männchen bleibt das weiße, sichelförmige Flügelfeld etwa gleich breit, beim Weibchen wird es zum Körper hin deutlich schmäler. Die Sperberung juveniler Individuen vor allem im Hals-, Brust-, Flanken- und Nackenbereich ist deutlich, aber nicht so markant wie bei einigen anderen Würgerarten; die Handschwingen der Jungvögel sind breiter weiß eingefasst, und der Schnabel ist nicht schwarz, sondern mittelbraun; am Unterschnabel weist er helle Ockertöne auf.
Flug
Der Flug von Ansitz zu Ansitz verläuft bogenförmig und erinnert etwas an einen Spechtflug, jedoch werden die Flügel niemals eng an den Körper angelegt. Kurz vor dem Erreichen einer neuen Ansitzwarte steilt der Vogel markant auf. Der kräftige und sehr schnelle Distanzflug dagegen ist geradlinig. Der Raubwürger segelt kurze Strecken und rüttelt häufig.
Im Flug sind die weißen Flügelabzeichen, der schmale weiße Schulterbereich sowie die schwarz-weiße Schwanzfärbung gute Identifizierungsmerkmale.
Lautäußerungen
Der Gesang des Raubwürgers, bei dem beide Geschlechter singen, besteht aus kurzen, wohltönend-flötend klingenden Strophen, die sehr variabel sind und in die häufig Elemente anderer Vogelgesänge und Rufe eingebettet werden. Meist beginnt der Gesang mit trrr- oder prrrr-Lautreihen, die später in relativ leise, auf der zweiten Silbe betonte tü-lick…prü-ii Elemente übergehen, die als eigentliche Kontaktrufe gedeutet werden. Dieser Gesang wird von exponierten Warten aus vorgetragen und ist von auffälligen Körperposen begleitet.[8]
Auch die Rufe sind sehr vielfältig. Am häufigsten ist der Wächterpfiff, ein scharfer Triller, der vor allem bei der Sichtung eines Flugfeindes zu hören ist. Daneben verfügt der Raubwürger über eine Vielfalt oft rau und heiser klingender Lautäußerungen. In Bedrohungs- oder aggressiv gestimmten Situationen sind aus der Nähe Instrumentallaute, vor allem Schnabelknappen, zu vernehmen.[9]
Verbreitung
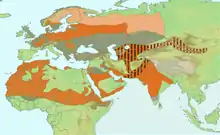
rot: Brut (ganzjährig)
rosa: Brut (Sommervogel)
grau schraffiert: Nichtbrüter und Wintergast
breit schwarz gestreift: Brutgebiet von L. (e.) pallidirostris
Trotz der Abtrennung der sechs in der borealen Nearktis und der borealen Ostpaläarktis beheimateten Unterarten und ihre Eingliederung in die neue Art Taigaraubwürger Lanius borealis ist das Verbreitungsgebiet des Raubwürgers in Hinblick auf Längen– und Breitenausdehnung enorm.
Schwerpunkt der Verbreitung liegt in der eurasischen borealen Zone, nordwärts bis etwa 70°N und ostwärts über den nördlichen Ural hinaus bis in das untere Flusssystem des Ob.[10] Im südwestlichen Randbereich der Verbreitung wird die Art in Zentraleuropa selten; aus vielen Gebieten Mitteleuropas ist sie im Verlauf der 2. Hälfte des 20. Jahrhunderts verschwunden oder kommt nur mehr in Restpopulationen vor. In Westeuropa liegt der Verbreitungsschwerpunkt in französischen Massif central mit einigen weiter westlich vorgeschobenen Verbreitungsinseln. In Großbritannien und Irland brütet die Art nicht. Ebenso fehlt sie auf der Apenninhalbinsel, weiten Teilen der Balkanhalbinsel und auf den großen Mittelmeerinseln.[11] Als Brutvogel verschwunden ist die Art auch aus der Türkei und dem Kaukasusgebiet. Die Iberische Halbinsel ist von der Schwesterart Lanius meridionalis besiedelt.
In noch größerer Dichte kommt der Raubwürger im Karpatenbogen und in Siebenbürgen und in angrenzenden Landschaften Rumäniens und Bulgariens vor. In Polen, Belarus und Teilen des Baltikums ist der Raubwürger trotz rückläufiger Brutdichte noch verbreiteter Brutvogel, ebenso im nördlichen und zentralen Teil der Ukraine und im europäischen Teil Nordrusslands, wo die Südgrenze etwa zwischen dem 50. und 54. Breitengrad schwankt.[10] Am südlichen und südöstlichen Verbreitungsrand ist die Brutdichte wieder gering. Seine größte Ostausbreitung erreicht Lanius excubitor im mongolischen Altai und im Tien Shan in Nordwestchina,[3] doch sind diese Regionen von L. pallidirostris bewohnt, dessen taxonomische Stellung unklar ist.
.jpg.webp)
Die Brutgebiete der 2016 neu hinzugekommenen Unterarten reichen von den Kanarische Inseln über die atlantischen Küstengebiete Marokkos, das Territorium Westsahara und Mauretanien entlang der Atlantikküste südwärts bis in den zentralen Senegal, südlich von Dakar. Nach Osten hin erstrecken sie sich vom Küstenland am Mittelmeer bis weit in die Vorberge des Atlas. In Zentrallibyen endet die flächendeckende Brutzone. Weiter ostwärts brütet die Art nur mehr in der küstennahen Kyrenaika, im unteren Niltal sowie an einigen Stellen an der Westküste des Rotes Meeres. In der Sahara sind die meisten größeren und kleineren Oasen besiedelt. Die südliche Verbreitungsgrenze verläuft im Übergangsbereich von Buschsavanne zur Baumsavanne in einer nicht einheitlichen Linie etwa von Dakar nach Djibuti. Weiters ist die Art in Israel und im Libanon Brutvogel und brütet in wenigen Paaren in Syrien und im Irak. Weiter verbreitet wieder ist der Raubwürger auf der Arabischen Halbinsel, auf Sokotra, in den südlichen Küstenregionen des Kaspischen Meeres, im östlichen Iran und im südöstlichen Zagrosgebirge. In Afghanistan kommt die Art nur im östlichen Grenzbereich zu Pakistan vor, Pakistan ist dagegen fast flächendeckend Brutgebiet; dies gilt auch für Indien, wo die Art von den Vorbergen des Himalayas im Norden, südwärts bis in die Bundesstaaten Karnataka und Andhra Pradesh als Brutvogel vorkommt. Die südöstlichsten Brutplätze liegen im westlichen Bangladesch.[3]
Wanderungen
Der Raubwürger ist sowohl Jahresvogel, fakultativer Kurzstreckenzieher als auch Langstreckenzieher, wobei sowohl die Anteile jener Vögel, die das Brutgebiet im Winter verlassen, als auch die Zugdistanzen von Süden nach Norden zunehmen. Die hochborealen Bereiche werden zur Gänze geräumt, die mittelborealen teilweise. In Norwegen überwintern einzelne Männchen bis etwa 67°N, in Schweden bis zum Polarkreis.[12] Die Winterquartiere der nordischen Vögel liegen meist in den Brutgebieten der etwas südlicher brütenden Populationen, während diese wiederum im weiteren Umkreis des Brutgebietes verharren oder in klimatisch und/oder nahrungsmäßig günstigere Gebiete ausweichen. Die Zugrichtungen sowohl der Unterarten als auch einzelner Populationen sind uneinheitlich: sie liegen im Sektor West-Südwest-Süd-Südost. Die Gebirgsrassen wandern vor allem altitudinal.


.jpg.webp)
Zugbewegungen der in gemäßigten Breiten brütenden Vögel werden meist durch Nahrungsengpässe ausgelöst, wobei die Weibchen eher das Brutgebiet verlassen als die Männchen. Skandinavische Vögel scheinen vor allem in Großbritannien zu überwintern, während mitteleuropäische hauptsächlich nach Süd- und Westfrankreich verstreichen. Die russischen Raubwürger überwintern unmittelbar südlich der Brutgebiete, einige Würger aus Osteuropa verstreichen nach Kleinasien oder in das Kaukasusgebiet. Von den in Zentraleuropa brütenden Vögeln verlassen etwa 50 % das Brutrevier.[13] Die zentralasiatischen Würger verbleiben im Brutgebiet oder überwintern südlich davon. Die meisten Populationen von L. (e.) pallidirostris dagegen sind Langstreckenzieher mit Winterquartieren auf der Arabischen Halbinsel oder in Ostafrika.[2]
Aufgrund der unterschiedlichen Zugstrategien können die Bestände des Raubwürgers in Mittel- und Westeuropa im Winterhalbjahr größer sein als während der Brutsaison.
Lebensraum
Aufgrund des sehr großen Verbreitungsgebietes der Art in ganz unterschiedlichen Klima- und Vegetationszonen differieren die bevorzugten Lebensräume in ihrer Detailausstattung, weisen aber wesentliche Gemeinsamkeiten auf: Immer handelt es sich um halboffene oder weitgehend offene, nach Möglichkeit kurzrasige Landschaftstypen mit verstreut stehenden Büschen und Bäumen. Ungefähr 5–15 Ansitze auf einen Hektar sollten vorhanden sein.[11] Wesentlich ist eine gute Rundumsicht, sowie eine möglichst unbehinderte Bodensicht. Eingestreute dichtere Gehölze als Ruhezonen, sowie Hecken und Dornengestrüpp als Versteck und Spießplatz sind weitere wesentliche Requisiten. Die Höhe der Bäume spielt keine Rolle, auch ihr Alter ist unwesentlich, da diese ohnehin meist nur in Höhen zwischen 4 und 6 Metern genutzt werden. Felder und andere landwirtschaftlich genutzte Flächen, sowie möglichst unbefestigte Wege werden durchaus toleriert, stark vom Menschen gestaltete Areale und intensiv genutzte Bereiche werden dagegen gemieden.[14]
In Mitteleuropa genügen ausgedehnte Streuobstwiesen, wenn sie zumindest in den Randbereichen Hecken und Gehölzgruppen aufweisen, Heidelandschaften mit Wacholder und anderen Busch- und Baumgruppen, Randbereiche von Mooren mit Busch- und Bruchwaldinseln diesen Habitatanforderungen. Besonders attraktiv werden diese Landschaften, wenn in ihnen Wanderviehwirtschaft betrieben wird, oder sie als Hüteweide genutzt werden.[15] Häufig dienen auch Sekundärlebensräume wie aufgelassene Tagebaugebiete oder Truppenübungsplätze als Lebensraum. Auch Dünenlandschaften und Randbereiche von Riedflächen können sich als Brutrevier eignen. In Nordeuropa und im östlich anschließenden Tundra/Taigagürtel bewohnt die Art noch mit Büschen und einzelnen Birkengruppen bestandenen Fjäll beziehungsweise arktische Tundra, solange sie noch Büsche und Bäume sowie Felsbuckel aufweist, die als Warte dienen können. Als Habitat dienen hier auch Randzonen von zusammenhängenden Wäldern, wenn sie an offene Landschaftsformen angrenzen, ausgedehnte Lichtungen in der ersten Phase der Verbuschung, sowie von Waldbränden heimgesuchte Gebiete, ebenfalls in früher Sukzession.[16] Weiter südlich brütet die Art in lichten Kiefernwäldern und in der dichteren Taiga vor allem in offenen Regionen entlang von Fließgewässern, zum Teil auch auf Rodungsflächen am Rande von Siedlungen.[17]
Völlig anders stellen sich die Habitatansprüche der Art in Afrika und im zentralen und südlichen Asien dar. Hier dominieren semiaride und aride Lebensräume mit entsprechender Vegetation. In Afrika (bis auf die Regionen am Mittelmeer, wo immergrüne Macchien als Lebensraum dienen) bewohnt die Art mit Büschen und einzelnen Bäumen bewachsene Halbwüsten und Savannengebiete. Besiedelt werden Regionen um Wasserstellen, Oasen, Senken, die eine dichtere Vegetation aufweisen, und Gehölze, die sich entlang von Trockenflüssen halten können.[18] In den Steppen Mittel- und Zentralasiens erscheint L. excubitor in Wermut- und Federgrasvegetation, die von Büschen und Sträuchern unterschiedlicher Art durchsetzt sind (Salzkräuter, Halostachys belangeriana, vor allem aber Saxaul und Pistazie).[18]
In den Vorgebirgen des Himalayas kommt die Unterart L. e. lahtora in aufgelockerten, halboffenen, baumbestandenen Habitaten vor, nach Süden zu bevorzugt sie trockene, halbwüstenähnliche Lebensräume.
In diesen unterschiedlichen Lebensräumen bewohnen L. e. excubitor, L. e. homeyeri und L. e. leucopterus vor allem die Niederungen und Mittelgebirgslagen bis etwa 1200 Meter. Bis in wesentlich größere Höhen kommen die afrikanischen- (bis 2000 Meter im Ahaggar und im nordäthiopischen Hochland) und die asiatischen Unterarten vor (2300 Meter im Zagrosgebirge und bis 2500 Meter im Altai).[18]
Raumbedarf
Für einen Vogel in der Größe einer Amsel ist der Raumbedarf außergewöhnlich groß. In Habitaten, die ein optimales Nahrungsangebot aufweisen, kann ein Brutrevier zwar nur an die 10 Hektar umfassen, doch in der Regel sind sie mit etwa 50 Hektar wesentlich größer. Eine noch größere Ausdehnung weisen die Winterreviere auf.[19] Raubwürger brüten bevorzugt in sogenannten Revierklumpen, deren Grenzen zum Teil recht weiträumig überlappen; exakte Angaben zu den Revierausmaßen sind deshalb problematisch.[20] Da zwischen den einzelnen Siedlungsklumpen größere Abstände bestehen (z. B. auf der Schwäbischen Alb 6,4 km), ist die Siedlungsdichte insgesamt gering.[20] In traditionell bewirtschafteten Agrargebieten Russlands wurden bis zu 33 Brutpaare auf 100 km² festgestellt.[2]
Nahrung und Nahrungserwerb
.jpg.webp)
Die Nahrung des Raubwürgers besteht fast ausschließlich aus Tieren, nur im Herbst werden in sehr geringen Mengen Früchte aufgenommen. Wühlmäuse, vor allem Arten der Gattung Microtus, Echte Mäuse sowie Spitzmäuse (Sorex sp.) überwiegen. Ihr Anteil an der Gesamtnahrungsmasse kann bis zu 90 % betragen. Daneben bilden verschiedene Kleinvogelarten einen weiteren wichtigen Nahrungsanteil. Bei hoher Schneelage können Kleinvögel zur Hauptbeute werden. Während der Jungenaufzucht, vor allem während der ersten Tage, werden verstärkt verschiedene Insektenarten, besonders Laufkäfer, Blatthornkäfer und Rüsselkäfer, aufgenommen, auch Ohrwürmer spielen in dieser Zeit eine Rolle. Selten erbeutet der Raubwürger Fledermäuse, Amphibien, Reptilien oder Fische und gelegentlich wurde die Art an Aas größerer Säugetiere beobachtet. Der Raubwürger ist in der Lage, Vögel bis zur Größe einer Wacholderdrossel und Säugetiere bis zur Größe eines Lemmings zu überwältigen und Beutetiere bis zum eigenen Gewicht im Fluge wegzutragen.
Der Raubwürger ist vor allem ein Wartenjäger, der von meist exponierten, mehrheitlich in Höhen zwischen drei und acht Metern liegenden Ansitzen aus insbesondere den Boden seiner Umgebung nach Nahrung absucht. Wird ein Beutetier entdeckt, gleitet er steil abwärts und versucht, es nach einem bodennahen Gleitflug zu schlagen. Die Warten werden häufig gewechselt. Neben dieser Hauptjagdmethode werden Beutetiere auch in einem langsamen Suchflug entdeckt, der häufig von kurzen, relativ bodennahen Rüttelphasen unterbrochen wird. Die Beute wird hauptsächlich am Boden geschlagen, doch wurden auch erfolgreiche Flugjagden auf Kleinvögel und Insekten beobachtet. Auch im Geäst sitzende Vögel werden in einem überraschenden, sperberartigen Angriffsflug erbeutet. Bei sehr schlechter Sicht sucht der Raubwürger auch am Boden hüpfend oder schreitend nach Nahrung. Es bestehen Hinweise, dass Raubwürger UV-Licht reflektierende Urinmarken von Wühlmäusen erkennen können.[2] Das Beutetier wird durch kräftige Schnabelhiebe oder durch einen Nackenbiss getötet und häufig auf Dornen aufgespießt oder in einer Astgabel eingeklemmt, was sowohl der Aufbewahrung und Vorratshaltung als auch der Fixierung der Beute dient, um bei ihrer stückweisen Zerlegung die ganze Kraft einsetzen zu können. Gefüllte Vorratskammern spielen auch bei der Partnerwahl eine Rolle. Eine polnische Untersuchung zeigte deutliche Veränderungen im Verhalten: In der Balz- und Vorbrutzeit wurden mehr Beutetiere aufgespießt und vor allem an den Reviergrenzen in gut sichtbarer Lage deponiert. Viele der Beutetiere wurden nicht gefressen. Während der Brutzeit und danach lagen die meisten Spießplätze relativ versteckt und nestnah und die Beutetiere wurden in der Regel verzehrt.[21]
Inwieweit den Gesangsimitationen eine Funktion beim Beuteerwerb zukommt, ist nicht erschöpfend erforscht. Möglicherweise könnten dadurch verschiedene Kleinvogelarten angelockt werden und so leichter zu erbeuten sein.
Verhalten
Allgemein
Der Raubwürger ist tagaktiv, auch in den nördlichsten, während der Sommermonate fast immer taghellen Brutgebieten hält er einen Tag-Nacht-Rhythmus ein. In der Brutzeit reicht die Aktivitätsphase in die Dämmerung, besonders bei der Jagd auf Fledermäuse oder wenn bestimmte Insektenarten schwärmen.
Den Tag verbringt er vor allem mit Ansitzjagd, wobei seine Körperhaltung meist etwas waagerechter ist als die anderer Würger. Während der Ruheperioden sucht er dichte Büsche oder junge Nadelbäume auf, oft deuten größere Gewölleansammlungen auf regelmäßig benutzte Schlafplätze hin. Wenn vorhanden, werden Wacholderbüsche (Juniperus communis), oder dichtes Dornengestrüpp als Schlafgehölze bevorzugt.
Raubwürger baden oft, wobei sie den Körper ganz unter Wasser tauchen. Anschließend wird das Gefieder mit leicht ausgebreiteten Schwingen getrocknet. Nach den Mahlzeiten reinigt er den Schnabel durch seitliches Reiben an einem Ast.
Sozialverhalten
Der Raubwürger ist während des gesamten Jahres territorial. Während der Brutzeit behauptet ein Brutpaar ein Territorium, außerhalb der Brutzeit besetzt jedes Individuum ein Revier für sich. Die Winterterritorien sind meist etwas größer als die der Brutsaison. Häufig bilden einige Brutpaare sogenannte Revierklumpen, die relativ weiträumig von Nachbarrevieren getrennt sind, gelegentlich aber auch mit ihnen überlappen. Auch in den Wintergebieten besteht ein loser sozialer Zusammenhang zwischen einzelnen Revieren. Die Bedeutung dieser sozialen Affinität zeigt sich darin, dass Einzelbrutplätze in optimalen Habitaten eher aufgegeben werden als Revierklumpen selbst in suboptimalen Lebensräumen. Die Reviergrenzen werden von den Revierinhabern regelmäßig inspiziert, häufig führen diese Markierungsflüge zu Gruppentreffen mit anderen Mitgliedern des Revierverbandes außerhalb der jeweiligen Reviergrenzen. Obwohl vorhanden, ist das Rivalitäts- und Aggressionsverhalten gegenüber Mitgliedern des Revierverbandes gemäßigter als das gegenüber fremden Artgenossen.
Feind- und Aggressionsverhalten
Sowohl gemeinsame Brutterritorien als auch außerbrutzeitliche Individualterritorien werden gegenüber Artgenossen energisch verteidigt, wobei es aber fast immer bei Drohgebärden bleibt. Dabei wird abhängig vom Aggressionsgrad der Schwanz gefächert, die Flügel zucken, und der Schnabel ist bei fast waagrechter, stark gebuckelter Körperhaltung vorgestreckt. Bei höchster Erregung ist das Nacken- und Kopfgefieder gesträubt. Begleitet werden diese Körperposen von rauen, kreischenden Rufen.
Auf Flugfeinde reagiert die Art sehr unterschiedlich. Naht ein Habicht oder Sperber oder eine bevorzugt Vögel jagende Vogelart (verschiedene Falkenarten, Eulen, Raubmöwen), warnt der Raubwürger intensiv und flieht in dichtes Gestrüpp. Mäusebussarde, Milane, Turmfalken, Raben, Krähen, Elstern und Häher werden während der Brut energisch attackiert und über die Reviergrenzen hinaus verfolgt. Außerhalb der Brutzeit warnt der Würger zwar, greift die Eindringlinge aber nur an, wenn sie einem Spießplatz zu nahe kommen. Vor nahenden Menschen wird während der Brut- und Nestlingszeit schon in Entfernungen von über 200 Metern gewarnt, im Winter kann die Fluchtdistanz unter 50 Meter sinken. Selten wurden auch direkte Angriffe auf Menschen beobachtet, die dem Brut- oder einem Spießplatz zu nahe kamen.
Gegenüber anderen Würgerarten besteht kein, oder nur ein mäßiges Rivalitätsverhältnis; Neuntöter brüten regelmäßig in Raubwürgerrevieren, ohne dass Aggressionsreaktionen beobachtet worden wären. Wacholderdrosseln suchen nicht selten die Nähe zu Raubwürgerrevieren und geben gelegentlich ihre Brutplätze auf, wenn die Raubwürger abziehen. Sie profitieren wahrscheinlich von der Luftraumüberwachung durch diese Würgerart. Welchen Nutzen der Raubwürger aus dieser Nähe zieht, ist nicht bekannt, doch ist auffällig, dass die im Revier brütenden Wacholderdrosseln von der Würgerart nicht angegriffen werden, und umgekehrt die Wacholderdrosseln die Würger auch nicht bekoten.
Brutbiologie
%252C_%22El_Jable%22_plains_near_Tao%252C_Lanzarote_(24513392094).jpg.webp)
Raubwürger werden gegen Ende des ersten Lebensjahres geschlechtsreif, viele der Vögel brüten aber erst im zweiten Lebensjahr zum ersten Mal. Sie führen eine monogame Brutsaisonehe; bei in einem Revierverband brütenden Paaren wurden jedoch gelegentliche Kopulationen verpaarter Weibchen mit Männchen aus Nachbarrevieren beobachtet.
Die Paarbildung der Standvögel beginnt schon Ende Februar, die der Zugvögel – abhängig von der geografischen Breite des Brutgebietes – wesentlich später. Sie dauert fast einen Monat und ist gekennzeichnet durch einen langsamen Abbau der innerartlichen Aggression. Während dieser Anpaarungszeit verliert das Weibchen mehr und mehr seine Selbstständigkeit, bis es zum Zeitpunkt der Eiablage vollständig vom Männchen mit Nahrung versorgt wird. Auch in der Auswahl der Wartenplätze wird diese Dominanzverschiebung deutlich: Bei verpaarten Raubwürgern sitzt das Männchen immer höher und weiter außen als das Weibchen, ein Verhalten, das Bauchzeigen genannt wird. Bei der Nahrungsübergabe zeigt das Weibchen Nestlings- und Beschwichtigungsverhalten: In geduckter Körperhaltung zittert es mit den Flügeln und stößt Bettelrufe aus.
In der Zeit der Hochbalz, in der auch mit dem Nestbau begonnen wird, vollführt das Männchen auffällige Hochflüge, aus denen es, langsam abwärts gleitend, zum Neststandort zurückkehrt. Den häufigen Kopulationen gehen meist solche Hochflüge sowie Futterübergaben voraus.
Neststandort und Nest
Der Neststandort wird vom Männchen ausgewählt. Meist liegt er in Bäumen oder in höheren, bevorzugt mit Dornen bewehrten Büschen. Die Art des Nistgehölzes ist sehr unterschiedlich, ebenso die Höhen, in denen das Nest errichtet wird. Nester können relativ bodennah (unter zwei Meter), aber auch in relativ großen Höhen von 20 Metern und mehr errichtet werden. Baumnester liegen meist in einer besonders dichten Stelle in der Krone, nach Möglichkeit sind sie sowohl von oben als auch von unten gegen Sicht gedeckt. Oft werden sie in Hexenbesen oder in Mistelbüsche gebaut. Der Nistplatz wird häufig von höheren Bäumen überragt, von denen aus das Männchen das Nest bewachen kann. Sonnenexponierte Lagen auf Hügelkuppen oder kleinen Erhebungen zeichnen viele Neststandorte aus.
Das Nest wird vom Paar gemeinsam gebaut, das Männchen schafft jedoch das meiste Material herbei. Das voluminöse Nest wirkt von außen unregelmäßig und etwas schlampig gebaut, ist jedoch eine stabile und festgefügte Konstruktion. Verbaut werden Stängel, Zweige, Grashalme und andere Materialien. In die Außenverkleidung werden häufig dornige Zweige eingearbeitet. Für die Nestmulde verwendet diese Würgerart vor allem Federn, Tierhaare oder weiche Pflanzenteile (zum Beispiel Wollgras). Gelegentlich werden Nester mehrmals ausgebessert und über mehrere Jahre hinweg benutzt.
Gelege, Brut und Nestlingszeit


Das Gelege besteht aus vier bis sieben, in Ausnahmefällen bis zu neun Eiern, die in ihrer Färbung recht variabel, meist aber grünlich- oder bläulichweiß sind und vermehrt am stumpfen Pol eine bräunliche oder purpurne Fleckung aufweisen. Ihre Größe beträgt im Mittel 26,5 × 19,5 Millimeter. Der Raubwürger brütet nur ein Mal im Jahr, nur bei frühem Gelegeverlust kommt es fast immer zu einer Zweitbrut, meist mit geringerer Eianzahl. Die Eiablage der westeuropäischen Standvögel beginnt frühestens Ende März, die der hochnordischen Populationen wesentlich später; afrikanische Brutvögel beginnen zu Beginn der jeweiligen Hauptregenzeit mit der Brut, die Brutperiode der innerasiatischen Populationen liegt zwischen April und Juni. Vollgelege können bis in den Juni hinein gefunden werden. Die Eier werden im Abstand von 24 Stunden in den Vormittagsstunden gelegt, das Weibchen beginnt erst nach der Ablage des vorletzten Eies zu brüten. Die Brutdauer liegt – abhängig von der Witterung – zwischen 15 und 17 Tagen. Die Jungen schlüpfen im Abstand von zwei Tagen, nackt und blind. In den ersten Tagen versorgt das Männchen Weibchen und Brut mit Nahrung, nach etwa einer Woche beteiligt sich das Weibchen an der Nahrungsbeschaffung, verbringt die meiste Zeit jedoch noch immer am Nest. Gelegentlich wurden sowohl unverpaarte Männchen als auch Weibchen als Bruthelfer beobachtet. Die Jungen sind nach durchschnittlich 19 Tagen flügge; sie werden noch mindestens weitere vier Wochen von den Eltern betreut, bevor sich der Familienverband nach und nach auflöst und die Jungen dismigrieren. Die Zerstreuungswanderungen sind relativ weiträumig. Wiederansiedlungen in 200 km Entfernung vom Brutgebiet wurden festgestellt.[2] Die Paarbindung erlischt bald nach dem Wegfliegen der Jungvögel, und die Eltern wechseln in die getrennten Winterreviere oder verlassen gänzlich das Brutgebiet.
Der Bruterfolg ist insgesamt niedrig. Nur aus 32,6 % der Eier werden flügge Junge.[22], bei optimalen Bedingungen kann die Ausfliegerate auf etwas über 50 % ansteigen.[2] Häufigste Ursachen für Brutverluste sind klimatische Einflüsse gefolgt von Prädation, vor allem durch Krähen und Elstern, Habicht, Waldkauz und Mardern.[23]
Nicht selten wird der Raubwürger vom Kuckuck (Cuculus canorus) parasitiert, auch intraspezifischer Brutparasitismus kommt vor.
Systematik
L. excubitor wurde 1758 von Carl von Linné erstbeschrieben. Lanius stellte er gemeinsam mit den Geiern, den Falken und den Eulen zu den Habichtartigen (Accipitres).[24] Bis auf den ostasiatischen Keilschwanzwürger und den schon von Linné erstbeschriebenen Louisianawürger wurden nach und nach alle neu wissenschaftlich beschriebenen holarktischen großen, grauen, Würger als Unterarten L. excubitor zugezählt, sodass eine extrem polytypische Spezies mit mehr als 20 Unterarten und einem riesigen Verbreitungsgebiet entstand. Trotz erheblicher Färbungsunterschiede, unterschiedlicher Habitatpräferenzen und unterschiedlicher Verhaltensdetails zwischen den einzelnen Unterarten, hatte diese systematische Einschätzung bis in die 90er Jahre des vorigen Jahrhunderts Bestand. Zweifel an ihrer Validität kamen jedoch schon auf, als Charles Vaurie 1959 vorschlug,[25] den Gesamtkomplex in eine Nord- und in eine Südgruppe zu unterteilen. Dieser Ansatz wurde 1990 von Siegfried Eck[26] in seinem Konzept der Geospezies[25] wieder aufgenommen und 1993 im HBV[27] und 1997 von Lefranc[28] konkretisiert. Vor allem die Tatsache, dass die Brutgebiete von L. excubitor und L. (e). meridionalis in Südfrankreich einander bis auf 30 Kilometer nahe kommen, ohne dass Hybride bekannt geworden wären, nährte Überlegungen, dass es sich um selbständige Arten handeln müsste.[25] Taxonomische Konsequenzen folgten jedoch erst im Jahre 2000, als die südlichen und südöstlichen 8 Unterarten von L. excubitor mit Lanius meridionalis als nominotypischem Taxon in Artrang gestellt wurden. Diese Einschätzung wurde 2016 wieder aufgegeben. Ausgelöst wurde die nun folgende, umfangreiche taxonomische Neubewertung durch die Arbeit von Urban Olsson et al. The Lanius excubitor conundrum, deren Ergebnisse zum Teil zwar nicht eindeutig waren, trotzdem jedoch die bisherige Systematik im Artenkreis der Großen Grauen Würger weitgehend umgestaltete.[29] Bis auf Lanius meridionalis kamen die verbleibenden 7 Unterarten zu L. excubitor, von dem wieder 6 in der nördlichen Nearktis und der nordöstlichen Paläarktis verbreitete Unterarten abgetrennt wurden und mit dem namengebenden Taxon Lanius borealis (Taigaraubwürger) Artrang erhielten. So stellt sich zurzeit (Ende 2018) L. excubitor als polytypische Art mit 11 Unterarten dar,[1] eine Einschätzung, die von allen Autoritäten einhellig als vorläufig bezeichnet wird.[2]
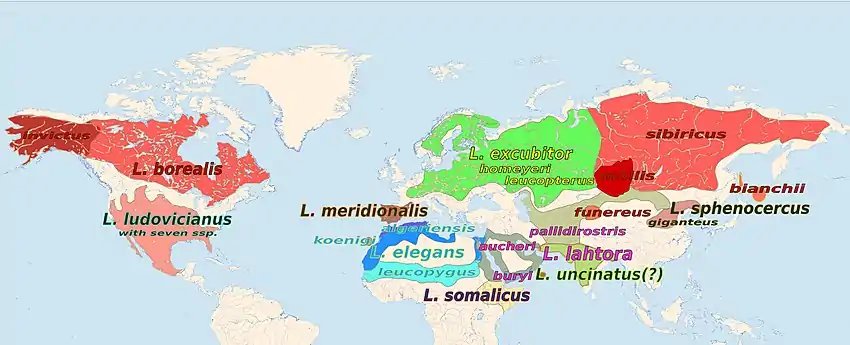
Legende: Große, mit L. beginnende Namen bezeichnen die Arten; kleingeschriebene Namen bezeichnen die Unterarten; gleiche Farben entsprechen gleichen Arten
Die Unterarten unterscheiden sich sowohl in ihrer Größe als auch in der Färbung des Gefieders, insbesondere in der Ausdehnung und Anzahl der Weißzeichnungen auf den Flügeln und am Schwanz, sowie im Vorhandensein oder Fehlen einer Wellenzeichnung auf Brust und Bauch. Die zwei ersten Unterarten zählten auch vor der taxonomischen Revision 2016 zu L. excubitor. Kennzeichnend ist, dass bei Vögeln in der Reihe excubitor > homeyeri > (leucopterus) das Ober- und Untergefieder heller wird, die Weißabzeichen in der Flügel- bzw. Schwanzfärbung ausgedehnter werden und die Flügellänge zunimmt.[32] Das schmutzigweiße Unterseitengefieder weist weder bei adulten Männchen noch bei adulten Weibchen eine Wellenzeichnung oder Sperberung auf.
- Lanius e. excubitor Linnaeus, 1758: Das Vorkommen dieser Unterart erstreckt sich über West-, Mittel- und Nordeuropa bis in den nördlichen Teil Westsibiriens. Nord-, Zentral- und Nordosteuropa, ostwärts bis zum Mündungsbereich des Ob, südwärts bis in das Wolgagebiet in Tatarstan; außerbrutzeitlich in Südskandinavien, Großbritannien, Westfrankreich, Kleinasien, dem Kaukasusgebiet und Transkaspien. In diesem Taxon sind die nicht mehr anerkannten Unterarten L. e. galliae und L. e. melanopterus enthalten. Dunkle, bräunliche Vögel, die früher L. e. melanopterus zugeschrieben wurden, erscheinen vor allem im Winter in Teilen des Brutareals von L. e. excubitor.[33] Die Kennzeichen von L. e. excubitor werden im Beschreibungsabschnitt behandelt.[32][34]
- L. e. homeyeri Cabanis, 1873: Teile Südosteuropas (Bulgarien, Südrumänien, Ukraine ostwärts bis zu den westlichen Vorgebirgen des Urals) außerdem Südwestsibirien ostwärts bis Zentralkirgisien bis an den Fluss Naryn. Sie ist heller als die Nominatform mit ausgedehnteren Weißzeichnungen im Flügel. Die sehr hellen Vögel vom Oberen Naryn, die häufig einer Unterart L. e. leucopterus Severtsov, 1875 zugerechnet wurden, werden hier als klinale Variante von L. e. homeyeri aufgefasst.[2][32]
_(5252094684).jpg.webp)

Bis auf L. e. theresae zählten die folgenden Unterarten bis 2016 zu Lanius meridionalis. Die nordafrikanischen Rassen algeriensis > elegans > leucopygos werden von West nach Ost heller.[35]
- L. e. koenigi Hartert, 1901 ist die Inselrasse der Kanarischen Inseln. Sie kommt auf allen größeren Inseln dieser Inselgruppe vor. Ihr Bestand wird auf etwa 1000–1500 Brutpaare geschätzt.[2] Genetische Untersuchungen vor allem zu dieser Inselrasse zeigten, dass sie verwandtschaftlich vergleichsweise weit von L. meridionalis entfernt ist, der benachbarten Festlandrasse (L. e. algeriensis) genetisch aber sehr nahesteht. Durch diese Erkenntnis wurde die Diskussion zum L. meridionalis s.lat. wieder entfacht.[36] Blassgrau auf der Oberseite, sehr hellgrau auf der Unterseite; schlanker, jedoch stark gekrümmter Schnabel, sonst weitgehend gleich mit algeriensis.
- L. e. algeriensis Lesson, 1839: Das Verbreitungsgebiet dieser Unterart liegt an der Atlantikküste Nordwestafrikas, in Marokko, Westsahara und Westmauretanien, sowie an der Mittelmeerküste Marokkos, Algeriens Tunesiens, ostwärts bis Westlibyen. Wie koenigi, aber mit kräftigerem Schnabel und kaum erkennbarem weißen Überaugenstreif[37][2]
- L. e. elegans Swainson, 1832: In der Sahara vom nordöstlichen Mauretanien ostwärts über Nordwestmali, Südtunesien, Zentral- und Südlibyen, bis nach Ägypten und den Sudan südwärts bis etwa Port Sudan. Außerdem bewohnt die Art die meisten Oasen der Sahara, das südwestliche Israel und die Sinaihalbinsel. Ob elegans im nordöstlichen Niger Brutvogel ist, ist unklar. Entsprechend der steilen Kline der afrikanischen Vögel von West nach Ost ist diese Art wesentlich heller als algeriensis. Große Teile des Schultergefieders, der Flügel und des Schwanzes sind weiß, die Unterseite ist zeichnungslos reinweiß.[37][2]
- L. e. leucopygus Ehrenberg, 1833: (inklusive der nicht allgemein anerkannten Unterart jebelmarrae aus dem südwestlichen Sudan). Die südlichste Art in Afrika: Zentral- und Südmauretanien, Zentralmali, Zentral- und Südniger, Nordostnigeria, Südtschad und Südsudan (Darfur);[2] vermutet werden auch Brutgebiete im äußersten Norden Kameruns und im Norden der Zentralafrikanischen Republik.[3] Etwas kurzflügeliger als elegans; Bürzel und Oberschwanzdecken sind noch ausgedehnter weiß und zuweilen auch leicht gelblich behaucht.[37]
Eine umgekehrte, eher schwache Kline mit dunkler werdenden Vögeln beginnt mit L. e. aucheri im Nordosten Afrikas und setzt sich mit den Unterarten Zentral- und Südasiens fort.[37][38]
- L. e. aucheri Bonaparte, 1853: Ostsudan südlich von Port Sudan, Eritrea, Nordäthiopien und Nordwestsomalia; nach Osten über Syrien, Südostisrael, den östlichen Teil der Sinaihalbinsel, große Teile der Arabischen Halbinsel (außer dem Südwesten), Teile Iraks und dem Süden Irans. Die Unterart ist auf der Unterseite geringfügig dunkler, eher grau und nicht weißlich wie elegans und hat weniger Weiß im Flügel. Die schwarze Gesichtsmaske verläuft als schmales Band über den frontalen Schnabelansatz.[2][35]
- L. e. theresae Meinertzhagen, 1953: Oft zu aucheri gestellt und nicht von allen Autoritäten anerkannte Unterart[35] aus dem Südlibanon und aus Nordisrael. Die Unterart ähnelt aucheri sehr stark, ist aber im Durchschnitt dunkler als diese.[2]
- L. e. lahtora (Sykes, 1832): Weite Südostausbreitung umfasst große Teile Pakistans und Indiens ostwärts bis in das zentrale Bangladesch. Gleicht weitgehend aucheri, weist aber ausgedehntere Weißanteile in den Flügeln und auf dem Schwanz auf; der Schnabel ist auffallend mächtig; die Gesichtsmaske verläuft relativ breit über den frontalen Schnabelansatz und zieht sich weit hinter die Ohrdecken. Ältere Männchen mit leicht gelblicher Brust.[35][2][39]
Außerhalb dieser beiden Klinen stehen zwei Rassen mit kleinen Verbreitungsgebieten im südarabischen Raum. Beide sind auf der Oberseite dunkel schiefergrau, auf der Unterseite deutlich grau behaucht.
- L. e. buryi Lorenz-Liburnau & Hellmayr, 1901: Jemen
- L. e. uncinatus Sclater & Hartlaub, 1881: auf Sokotra offenbar sehr häufig (26.000 Individuen); wie buryi jedoch mit längerem Schnabel und eher weißgrauen Schulterfedern.[35]
Nicht in diese Unterartenliste aufgenommen ist L. pallidirostris, der von der IOU als Steppe Grey Shrike – Steppenraubwürger Artrang erhielt.[1]; mit Einschränkungen unterstützt auch Panov diese Einschätzung.[40] Nicht unwesentliche Argumente belegen jedoch auch die Nähe zu L. e. lahtora.[31] beziehungsweise L. e. aucheri. Das HBW behandelt 2018 L. e. pallidirostris noch als Unterart von L. excubitor, betont aber seine Sonderstellung.
Bestand und Bedrohung
Der Bestand der Art ist gemäß einer Neueinschätzung von 2017 nicht gefährdet. Er wird von der IUCN mit LC (=least concern) bewertet. Die Bestandsentwicklung ist uneinheitlich: Die Art verschwand etwa ab den 1950er Jahren sukzessiv aus vielen Gebieten Mitteleuropas, wie zum Beispiel fast flächendeckend aus Baden-Württemberg, aus den Vorarlberger Brutgebieten und der Schweiz, und wurde auch in Tschechien, der Slowakei sowie in Belgien und den Niederlanden sehr selten. Mit Stand 2019 geht der Bestand in Deutschland weiter stark zurück.[41] In Rheinland-Pfalz gab es 2019 nur noch fünf Brutpaare und fünf Reviere mit Beobachtungen, wobei sich alle Reviere auf wieder zuwachsenden Windwurfflächen befanden.[42] Dagegen konnte die Art ihr Brutgebiet in Dänemark, Finnland und zum Teil in Nordwestrussland nicht unbeträchtlich ausdehnen.[41] In den Schwerpunktbereichen der Brutverbreitung in Fennoskandien und im europäischen Teil Russlands brüten zumindest 330.000 Brutpaare[2]. Ein großräumiges Monitoring in Polen 2010 ergab einen Brutbestand von 22.000–25.000 Paaren. Der gesamte europäische Bestand (ohne Russland und Fennoskandien) wird auf 69.000–160.000 Brutpaare geschätzt, davon brüten in Zentral- und Osteuropa (außer Polen) noch etwa 13.000 Paare, in Frankreich an die 1000.[2]
Für die Bestandseinbußen verantwortlich gemacht werden sowohl stärker atlantisch beeinflusste Großwetterlagen (die sich bei dieser Art jedoch weniger gravierend auszuwirken scheinen als etwa bei Schwarzstirnwürger, Rotkopfwürger und anderen wärmeliebenden Großinsektenjägern), die Kältewinter am Anfang der 1960er und gegen Ende der 1970er Jahre, auf Pestizideintrag zurückzuführender Mangel an Beutetieren sowie Habitatverluste durch großräumige Intensivierung der Landwirtschaft. Besonders negativ wirkte sich das Verschwinden von Randstrukturen (Hecken, Raine, Gehölzinseln) aus. Für die Bestandszunahmen in einigen nordischen Brutbereichen wurde die Kahlschlagwirtschaft ausgemacht, die in diesen Regionen praktiziert wird; die dadurch entstandenen Offenflächen bieten dem Raubwürger geeignete Lebensräume.[41]
Namensherleitung
Der Gattungsname Lanius ist lateinisch und bedeutet Fleischer. Im Englischen werden die Würger unter anderem auch Butcher-birds genannt. Die deutsche Übersetzung des ebenfalls lateinischen excubitor ist Wächter und betont die Eigenschaft des Raubwürgers, seine Umgebung sehr sorgfältig zu beobachten und vor herannahenden, als Bedrohung empfundenen Eindringlingen zu warnen.
Trivia
Der Asteroid des äußeren Hauptgürtels (8591) Excubitor ist nach dem Raubwürger benannt (wissenschaftlicher Name: Lanius excubitor). Zum Zeitpunkt der Benennung des Asteroiden am 2. Februar 1999 befand sich der Nördliche Raubwürger auf der niederländischen Roten Liste gefährdeter Arten.[43]
Literatur
- Tony Harris, Kim Franklin: Shrikes & Bush-Shrikes. Including wood-shrikes, helmet-shrikes, flycather-shrikes, philentomas, batises and wattle-eyes. Christopher Helm, London 2000, ISBN 0-7136-3861-3.
- Norbert Lefranc, Tim Worfolk: Shrikes. A Guide to the Shrikes of the World. Pica Press, 1997, ISBN 1-4081-3505-1.
- Reuven Yosef & International Shrike Working Group (2018): Great Grey Shrike (Lanius excubitor). In: del Hoyo, J., Elliott, A., Sargatal, J., Christie, D.A. & de Juana, E. (eds.). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. Hochgeladen von https://birdsoftheworld.org/bow/species/norshr1/cur/introduction am 4. September 2018.
- Evgenij N. Panov: The True Shrikes (Laniidae) of the World – Ecology, Behavior and Evolution. Pensoft Publishers, Sofia 2011, ISBN 978-954-642-576-8.
- Urs N. Glutz von Blotzheim (Hrsg.): Handbuch der Vögel Mitteleuropas. Bearb. u. a. von Kurt M. Bauer und Urs N. Glutz von Blotzheim. Aula-Verlag, Wiesbaden 1985 ff. (2. Aufl.), Teilband 13/2, ISBN 3-89104-535-2, S. 1262–1328.
- Jürgen Haffer: Passeriformes. Sittidae, Laniidae. Handbuch der Vögel Mitteleuropas. Bd. 13,2. Hrsg. von Kurt M. Bauer und Urs N. Glutz von Blotzheim. Aula, Wiesbaden 1993 (2. Aufl.), S. 1262–1328, ISBN 3-89104-535-2.
- Jochen Hölzinger (Hrsg.): Die Vögel Baden-Württembergs. Band 3.2 Singvögel 2. Eugen Ulmer, Stuttgart 1997, S. 289–321, ISBN 3-8001-3483-7.
- Viktor Wember: Die Namen der Vögel Europas. Bedeutung der deutschen und wissenschaftlichen Namen. AULA, Wiebelsheim 2005, S. 145, ISBN 3-89104-678-2.
- Tom J. Cade, Eric C. Atkinson: Northern Shrike (Lanius excubitor). In: The Birds of North America. Bd. 17. Hrsg. v. A. Poole u. F. Gill. The Birds of North America, Philadelphia PA 17.2002,671. ISSN 1061-5466.
Weblinks
Einzelnachweise
- IOU 8.2 World Bird names Juni 2018
- Reuven Yosef & International Shrike Working Group, C.J Sharpe, J.S. Marks und G.M. Kirwan: Great Grey Shrike (Lanius excubitor). In: del Hoyo, J., Elliott, A., Sargatal, J., Christie, D.A. & de Juana, E. (eds.). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. (heruntergeladen von https://birdsoftheworld.org/bow/species/norshr1/cur/introduction am 4. September 2018).
- Lanius excubitor in der Roten Liste gefährdeter Arten der IUCN 2018.1. Eingestellt von: BirdLife International, 2018. Abgerufen am 4. September 2018.
- Kai Gedeon, Christoph Grüneberg, Alexander Mitschke, Christoph Sudfeldt und Mitarbeiter: Atlas Deutscher Brutvogelarten.Stiftung Vogelmonitoring Deutschland und Dachverband Deutscher Avifaunisten, Münster 2015; ISBN 978-3-9815543-3-5
- Leopold Sachslehner (Hrsg.): Der Raubwürger in Österreich. Forschungsgemeinschaft Wilhelminenberg Dezember 2008, ISBN 978-3-200-01389-6 pdf engl.
- Datenblatt Raubwürger der Schweizerischen Vogelwarte in Sempach
- Torsten Ryslavy, Hans-Günther Bauer, Bettina Gerlach, Ommo Hüppop, Jasmina Stahmer, Peter Südbeck & Christoph Sudfeldt: Rote Liste der Brutvögel Deutschlands, 6 Fassung. In: Deutscher Rat für Vogelschutz (Hrsg.): Berichte zum Vogelschutz. Band 57, 30. September 2020.
- Gesang
- Alarmrufe, Schnabelkappen
- Urs N. Glutz von Blotzheim (Hrsg.): Handbuch der Vögel Mitteleuropas. Bearb. u. a. von Kurt M. Bauer und Urs N. Glutz von Blotzheim. Aula-Verlag, Wiesbaden 1972 ff. (2. Aufl.). Teilband 13/2, S. 1272 ff, ISBN 3-89104-535-2
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes… 2000, S. 152.
- Urs N. Glutz von Blotzheim (Hrsg.): Handbuch der Vögel Mitteleuropas. Bearb. u. a. von Kurt M. Bauer und Urs N. Glutz von Blotzheim. Aula-Verlag, Wiesbaden 1985 ff. (2. Aufl.). Teilband 13/2, S. 1284, ISBN 3-89104-535-2
- Urs N. Glutz von Blotzheim (Hrsg.): Handbuch der Vögel Mitteleuropas. Bearb. u. a. von Kurt M. Bauer und Urs N. Glutz von Blotzheim. Aula-Verlag, Wiesbaden 1985 ff. (2. Aufl.). Teilband 13/2, S. 1284 f., ISBN 3-89104-535-2
- Jochen Hölzinger (Hrsg.): Die Vögel Baden-Württembergs. Band 3.2 Singvögel 2. Eugen Ulmer, Stuttgart 1997, S. 295–302, ISBN 3-8001-3483-7.
- Jochen Hölzinger (Hrsg.): Die Vögel Baden-Württembergs. Band 3.2 Singvögel 2. Eugen Ulmer, Stuttgart 1997, S. 295; ISBN 3-8001-3483-7.
- Urs N. Glutz von Blotzheim (Hrsg.): Handbuch der Vögel Mitteleuropas. Bearb. u. a. von Kurt M. Bauer und Urs N. Glutz von Blotzheim. Aula-Verlag, Wiesbaden 1985 ff. (2. Aufl.). Teilband 13/2, S. 1289ff, ISBN 3-89104-535-2
- Evgenij N. Panov: The True Shrikes (Laniidae) of the World – Ecology, Behavior and Evolution. Pensoft Publishers, Sofia 2011, S. 352–358; ISBN 978-954-642-576-8.
- Evgenij N. Panov: The True Shrikes (Laniidae) of the World – Ecology, Behavior and Evolution. Pensoft Publishers, Sofia 2011, S. 243 ISBN 978-954-642-576-8.
- Jochen Hölzinger (Hrsg.): Die Vögel Baden-Württembergs. Band 3.2 Singvögel 2. Eugen Ulmer, Stuttgart 1997, S. 302; ISBN 3-8001-3483-7.
- Urs N. Glutz von Blotzheim (Hrsg.): Handbuch der Vögel Mitteleuropas. Bearb. u. a. von Kurt M. Bauer und Urs N. Glutz von Blotzheim. Aula-Verlag, Wiesbaden 1985 ff. (2. Aufl.). Teilband 13/2, S. 1291ff, ISBN 3-89104-535-2
- Marcin Antczak, Martin Hromada, Piotr Tryjanowski: Spatio-temporal changes in Great Grey Shrike Lanius excubitor impaling behaviour: from food caching to communication signs. In: ARDEA 93 (1), S. 101–107.
- Jochen Hölzinger (Hrsg.): Die Vögel Baden-Württembergs. Band 3.2 Singvögel 2. Eugen Ulmer, Stuttgart 1997, S. 307; ISBN 3-8001-3483-7.
- Jochen Hölzinger (Hrsg.): Die Vögel Baden-Württembergs. Band 3.2 Singvögel 2. Eugen Ulmer, Stuttgart 1997, S. 309; ISBN 3-8001-3483-7.
- Caroli Linnaei: Systema naturae. Regnum Animale. Editio Dezima 1758; S. 93–94 pdf
- Evgenij N. Panov: The True Shrikes (Laniidae) of the World – Ecology, Behavior and Evolution. Pensoft Publishers, Sofia 2011, S. 344 ISBN 978-954-642-576-8.
- J. Martens: Nachruf auf Dr. h. c. Siegfried Eck. In: Zoologische Abhandlungen (Dresden) 55 (2006) pdf engl.
- Urs N. Glutz von Blotzheim (Hrsg.): Handbuch der Vögel Mitteleuropas. Bearb. u. a. von Kurt M. Bauer und Urs N. Glutz von Blotzheim. Aula-Verlag, Wiesbaden 1985 ff. (2. Aufl.). Teilband 13/2, S. 1262–1266, ISBN 3-89104-535-2
- Norbert Lefranc, Tim Worfolk: Shrikes. A Guide to the Shrikes of the World. Pica Press, 1997, ISBN 1-4081-3505-1.
- Urban Olsson, Per Alström, Lars Svensson, Mansour Aliabadian, Per Sundberg: The Lanius excubitor (Aves, Passeriformes) conundrum—Taxonomic dilemma when molecular and non-molecular data tell different stories. In: Molecular Phylogenetics and Evolution. (2010) Vol. 55/2, S. 347–357
- Jelmer Poelstra: Speciation in shades of grey: the great grey shrike complex. In: Dutch Birding 32: 229–250, 2010
- Yaroslav A. Red’kin, Vladimir Yu. Arkhipov, Sergej V. Volkov, Aleksej A. Mosalov und Evgenij A. Kobli: Art oder keine Art? Strittige taxonomische Ansichten zu den Vögeln Nord-Eurasiens. In: Ornithologische Mitteilungen Jahrgang 68 (2016) Nr. 11/12: 327 – 354.
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes… 2000, S. 151.
- Jochen Hölzinger (Hrsg.): Die Vögel Baden-Württembergs. Band 3.2 Singvögel 2. Eugen Ulmer, Stuttgart 1997, S. 292, ISBN 3-8001-3483-7.
- Evgenij N. Panov: The True Shrikes (Laniidae) of the World – Ecology, Behavior and Evolution. Pensoft Publishers, Sofia 2011, S. 346ff ISBN 978-954-642-576-8.
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes… 2000, S. 156.
- Javier Gonzalez, Michael Wink, Eduardo Garcia-del-Rey und Guillermo Delgado Castro: Evidence from DNA nucleotide sequences and ISSR profiles indicates paraphyly in subspecies of the Southern Grey Shrike (Lanius meridionalis). In: J. Ornithol. (2008) 149:495. doi:10.1007/s10336-008-0293-y
- Urs N. Glutz von Blotzheim (Hrsg.): Handbuch der Vögel Mitteleuropas. Bearb. u. a. von Kurt M. Bauer und Urs N. Glutz von Blotzheim. Aula-Verlag, Wiesbaden 1985 ff. (2. Aufl.). Teilband 13/2, S. 1265, ISBN 3-89104-535-2
- Evgenij N. Panov: The True Shrikes (Laniidae) of the World – Ecology, Behavior and Evolution. Pensoft Publishers, Sofia 2011, S. 237 ISBN 978-954-642-576-8.
- Foto: L. e. lahtora adultes Männchen
- Evgenij N. Panov: The True Shrikes (Laniidae) of the World – Ecology, Behavior and Evolution. Pensoft Publishers, Sofia 2011, S. 240ff ISBN 978-954-642-576-8.
- Urs N. Glutz von Blotzheim (Hrsg.): Handbuch der Vögel Mitteleuropas. Bearb. u. a. von Kurt M. Bauer und Urs N. Glutz von Blotzheim. Aula-Verlag, Wiesbaden 1972 ff. (2. Aufl.). Teilband 13/2, S. 1282ff, ISBN 3-89104-535-2
- Christian Dietzen, Franz-Josef Fuchs: Raubwürger in Rheinland-Pfalz weiter im Sinkflug. GNOR Info 2019: 18-19.
- Lutz D. Schmadel: Dictionary of Minor Planet Names. Fifth Revised and Enlarged Edition. Hrsg.: Lutz D. Schmadel. 5. Auflage. Springer Verlag, Berlin, Heidelberg 2003, ISBN 978-3-540-29925-7, S. 186 (englisch, 992 S., link.springer.com [ONLINE; abgerufen am 21. Juli 2021] Originaltitel: Dictionary of Minor Planet Names. Erstausgabe: Springer Verlag, Berlin, Heidelberg 1992): “6543 P-L. Discovered 1960 Sept. 24 by C. J. van Houten and I. van Houten-Groeneveld at Palomar.”