Echte Würger
Die Echten Würger (Lanius) sind eine Gattung von Sperlingsvögeln innerhalb der Familie der Würger (Laniidae). Die Gattung wurde 1758 von Carl von Linné erstbeschrieben. Das lateinische Lanius bedeutet „Metzger, Fleischer“ und verweist auf die überwiegend carnivore Ernährungsweise der Arten und auf die Eigenschaft einiger Vertreter, Beutetiere aufzuspießen oder in Zweiggabelungen einzuklemmen.[1] Der deutsche Name Würger, sowie die gelegentliche englische Bezeichnung Butcherbird[2] stehen im gleichen Kontext, ebenso Fiscal, der englische Namensteil einiger afrikanischer Vertreter.[3] Der englische Hauptname Shrike bezieht sich auf die rauen, harschen Rufe vieler Würgerarten. (engl. shriek = schreien, kreischen)
| Echte Würger | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
.jpg.webp)
Nördlicher Raubwürger (Lanius excubitor) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Lanius | ||||||||||||
| Linnaeus, 1758 |
Die Anzahl der Arten innerhalb der Gattung schwankt je nach wissenschaftlicher Auffassung zwischen 25 und über 30.[4] Von ihnen sind die meisten zurzeit nicht gefährdet, obwohl für einige Arten gerade in Mitteleuropa erhebliche Bestandsrückgänge zu verzeichnen waren, die zum Teil noch immer anhalten. Der Philippinenwürger ist potentiell gefährdet,[5] der São-Tomé-Würger, ein Inselendemit auf São Tomé, ist vom Aussterben bedroht.[6]
Die meisten der sperlings- bis gut amselgroßen Vögel zeigen die typisch langschwänzige und relativ großköpfige Würgergestalt mit dunklem Hakenschnabel und schwarzer Gesichtsmaske. Schwarze, graue, weiße und rötlich braune Gefiederfarben dominieren. Würger ernähren sich vornehmlich von großen Insekten und kleinen Wirbeltieren, mit denen sie auch ihre Jungen großziehen. Die Arten der nördlichen gemäßigten Zone sind vielfach Zugvögel, zum Teil extreme Langstreckenzieher, die meisten afrikanischen und die Arten des südlichen und südöstlichen Asiens sind Standvögel.
Die Gattung ist in Europa, Asien, Nordamerika, Afrika und mit einer Unterart auf Neuguinea vertreten. Die Afrotropis und die Paläarktis weisen die größte Artenvielfalt auf.
Merkmale

Im Vordergrund: fliegend adultes Männchen; sitzend adultes Weibchen. Im Hintergrund sitzend Jungvogel
_in_Delhi_W2_Pix_051.jpg.webp)
Sehr langschwänzige Art mit lachsroten Gefiederanteilen. Deutlich die vorne liegende und leicht vorgewölbte Augenposition

Bei dieser ostasiatischen Art wurde der große Kopf namensgebend

_female_-_Flickr_-_Lip_Kee.jpg.webp)
deutlich das gesperberte Gefieder und der mächtige Schnabel – engl. Thick-billed-Shrike
Bei dieser Art ist der Färbungsdimorphismus relativ deutlich
.jpg.webp)
Die Gattung umfasst kleine bis gut mittelgroße Sperlingsvögel, deren wesentlichsten gemeinsamen Merkmale die dunkle Gesichtsmaske und der mächtige, nicht sehr lange Hakenschnabel sind. Einige Vertreter der Gattung haben eine schwarze Oberkopffärbung; bei ihnen ist die Gesichtsmaske kaum erkennbar. Der Schnabel weist einen sogenannten Falkenzahn auf, einen spitzen Zacken im Oberschnabel nahe der Endkrümmung, der bei einigen Arten mit einer leichten, besonders scharfkantigen Einbuchtung im Unterschnabel korrespondiert. Diese Anpassung an die vorwiegend carnivore Ernährungsweise ermöglicht einen effektiven Tötungsbiss. Die Arten sind relativ langschwänzig, bei einigen ist der Schwanz besonders verlängert, was gelegentlich in einem Trivialnamen zum Ausdruck kommt. (Langschwanzwürger, Schachwürger engl. Long-tailed Shrike) Würger wirken großköpfig, dies ist zum Teil der stark entwickelten Kiefermuskulatur geschuldet.[7] Auch diese Großköpfigkeit kann wie beim Büffelkopfwürger oder beim Louisianawürger, engl. Loggerhead Shrike namensgebend werden.
Die kleinste Art, der Rotbürzelwürger ist mit 15 Zentimetern Körperlänge und einem Gewicht von 20–25 Gramm etwa so groß wie ein Haussperling, jedoch wesentlich leichter als dieser, die größte Art, der Keilschwanzwürger (vor allem die Hochlandunterart L. sphenocercus giganteus) ist 32 Zentimeter groß und bis 100 Gramm schwer. Er erreicht damit bei etwas geringerem Gewicht fast die Größe eines Kuckucks.
In der Gefiederfärbung herrschen vier Farben vor: weiß, schwarz, grau (in vielen Schattierungen) und rötlich braun in verschiedenen Abstufungen. Gelbliche (Maskenwürger und São-Tomé-Würger) rosa und lachsrote Farbtöne (Südlicher Raubwürger, Louisianawürger, Schachwürger, insbesondere die Unterart Lanius schach erythronotus) kommen vereinzelt im Bauch- und Flankenbereich einiger Arten vor, einige Weibchen afrikanischer schwarz-weißer Würgerarten, wie Fiskalwürger, Langschwanzwürger oder Mackinnonwürger weisen dunkel rötlich braune, verlängerte Flankenfedern auf. Die Färbung ist zumindest bei den Männchen intensiv und kontrastreich. Die Gesichtsmaske ist bei allen Arten, bei denen sie nicht durch die dunkle Oberkopffärbung wie etwa beim Taitawürger unsichtbar wird, sehr markant. Sie erstreckt sich vom Schnabelansatz über die Ohrdecken meist bis zum Nacken. Bei einigen Arten (Louisianawürger, Tigerwürger) bedeckt sie auch einen schmalen Stirnstreifen über dem Schnabel, bei anderen (Schachwürger, Schwarzstirnwürger) fast die gesamte Stirn. Häufig ist die Maske durch einen hellen, feinen Überaugenstreif zusätzlich akzentuiert. Sehr viele Arten weisen weiße Flügelfelder auf, die vor allem im Flug auffällig sind, nur wenige (Neuntöter, Tigerwürger, Braunwürger) sind völlig ohne Weißzeichnung auf der Oberseite der Flügel. Melanistische, seltener leuzistische Morphen kommen vor, in manchen Regionen gehäuft. In Ostchina hat die melanistische Form des Schachwürgers zur Aufstellung einer Unterart (fälschlich L. schach fuscatus – eigentlich melanistische Morphe von L. schach schach) geführt.[8] Der Schwanz ist bei allen Arten abgestuft (besonders deutlich und namensgebend beim Keilschwanzwürger) bei wenigen (Rotkopfwürger, Neuntöter) auch löffelförmig gerundet. Bei einigen der rötlich braunen Arten ist er rötlich braun oder schwarz, bei den grauen Arten meist schwarz. Die kürzeren Außenfedern sind oft heller oder weiß. Die leicht hervortretenden, relativ weit vorne liegenden Augen sind bei allen Arten schwarz, ebenso ist der Schnabel adulter Vögel gefärbt. Die recht langen Beine sind grau braun, grau oder dunkelgrau, ebenso wie die vier scharf bekrallten Zehen.
Ein Größen- oder Gewichtsdimorphismus ist, wenn überhaupt vorhanden, nur schwach ausgeprägt und zwischen den Arten nicht einheitlich. Auch der Färbungsdimorphismus ist meist geringfügig, nur bei wenigen Arten, wie etwa dem Isabellwürger, dem Büffelkopfwürger oder dem Rotbürzelwürger ist er deutlich, beim Neuntöter sehr deutlich. Weibchen vieler Arten sind weniger kontrastreich gefärbt, die Gesichtsmaske ist kürzer und schmaler, das Brust- und Oberseitengefieder weist eine leichte, dunkle Wellung auf, wie sie das Jugendgefieder beinahe aller Arten kennzeichnet. Häufig ist der Schnabel etwas heller, vor allem der Unterschnabel kann an der Schnabelbasis hell bräunliche oder fleischfarbene Farbtöne aufweisen. Bei einigen schwarz-weißen, afrikanischen Arten unterscheiden sich die Geschlechter durch ein verlängertes, rötlich braunes Flankengefieder, das nur die Weibchen tragen. Dieses Merkmal tritt auch beim Gelbschnabelwürger (Corvinella corvina) auf. Ältere Weibchen vieler Arten gleichen sich in ihrer Gefiederfärbung zunehmend den Männchen an.
Vögel im ersten Jugendkleid unterscheiden sich immer deutlich von Adulten. Sie weisen zwar meistens bereits die Grundelemente der Gefiederfärbung adulter Vögel auf, doch sind die Farben blasser, meist zu Grau oder Graubraun hin abgeschwächt. Starke Kontraste fehlen. Die Gesichtsmaske ist zwar häufig (vor allem im Bereich hinter den Augen) angedeutet, aber nie durchgezeichnet. Bei fast allen Arten ist das Jugendgefieder dunkel gewellt, geflockt oder gesperbert, manchmal fein gestrichelt; Merkmale, die das Gefieder vieler weiblicher Lanius–Vertreter ebenfalls kennzeichnen. Bei adulten Weibchen verblassen diese Merkmale zunehmend mit den aufeinander folgenden Mausern. Keine oder eine nur angedeutete Sperberung weisen die Jugendkleider des Südlichen Raubwürgers und des Keilschwanzwürgers auf.[9]
Morphologische Merkmale
Der Hakenschnabel ist die deutlichste Adaption der Lanius-Arten an eine Lebensweise als Prädator. Der Schnabel ist hoch, nicht besonders lang und wirkt seitlich zusammengedrückt; er weist einen Falkenzahn auf, einen scharfen Hornzacken im Oberschnabel, der in eine Einkerbung im Unterschnabel einpasst; er erleichtert das schnelle Töten von Beutetieren, insbesondere das Durchtrennen der Wirbelsäule kleiner Wirbeltiere. Der Falkenzahn ist nicht wie bei den Falken (Falco sp.) schon embryonal angelegt, sondern entwickelt sich erst bei etwa vier Wochen alten Jungvögeln.[10] Die Kau- und Kiefermuskulatur ist sehr kräftig dimensioniert, wodurch einige Arten im Verhältnis zum Rumpf großköpfig erscheinen. Die Laufbeine sind kräftig, verhältnismäßig lang, auf der Vorderseite getäfelt (mit Hornschuppen bedeckt) auf der Hinterseite eher kleiner geschuppt. Die Zehenanordnung ist wie bei fast allen Sperlingsvögeln anisodactyl. Die basalen Glieder der Mittelzehe und der 4. Zehe (Außenzehe) sind verwachsen. Die Krallen sind stark gekurvt, lang und spitz. Die 1. und die 3. Zehe sind gleich lang, was bei geschlossenem Fuß im Zusammenspiel mit den geriffelten Zehenballen einen zangenartigen, festen Griff ermöglicht. Die leicht vorstehenden Augen sind im Kopf relativ weit vorne positioniert, wodurch räumliches Sehen unterstützt wird.[11] Die bei allen Arten vorhandene, aber bei jenen mit schwarzer Oberkopffärbung kaum erkennbare Gesichtsmaske hilft möglicherweise die Blendwirkung des Sonnenlichtes zu reduzieren.[12] Die meisten Arten haben 10 Handschwingen, einige, wie viele Krähenarten auch, eine verkümmerte 11.
Mauser
Art und Umfang der Mauser unterscheiden sich wesentlich zwischen Zugvögeln und Standvögeln. Auch zwischen Langstrecken-, Kurz- oder Mittelstreckenziehern sind Unterschiede festzustellen. Dies gilt auch innerhalb einer Art, wenn, wie zum Beispiel beim Nördlichen Raubwürger oder beim Louisianawürger, nördliche Populationen Zugvögel sind, südliche dagegen ganzjährig im Brutgebiet verbleiben. Die Mausersequenzen entsprechen im Wesentlichen jenen der meisten Sperlingsvögel.[13]
Jungvögel verlassen weitgehend ins erste Jugendkleid vermausert das Nest. Bei ziehenden Arten beginnt die Mauser des Kleingefieders, bevor Schwingen und Schwanzfedern des 1. Jugendkleides ihre volle Länge erreicht haben. Danach wird die Mauser für die Zeit des Zuges unterbrochen. Im Winterquartier wird anschließend bis in den Spätwinter das Großgefieder erneuert. Bei Standvögeln beginnt die Mauser des Kleingefieders etwa einen Monat nach dem Ausfliegen und setzt sich mit dem Wechsel des Großgefieders bis in den frühen Frühling hinein fort. Ähnlich ist die Mauserabfolge bei Adulten: Standvögel beginnen mit der Mauser nach der Brut und setzen sie meist mit Pausen beim Wechsel des Großgefieders bis in den Spätwinter fort; Zugvögel unterbrechen die Mauser nach dem Wechsel des Kleingefieders und wechseln das Großgefieder in den Überwinterungsgebieten.[14]
Der Tigerwürger und der Braunwürger, beide ostasiatische Mittel- bis Langstreckenzieher, scheinen zweimal im Jahr das gesamte Gefieder zu wechseln, einmal kurz vor dem Wegzug noch im Brutgebiet und danach im Winterquartier.[15]
Lautäußerungen
Würger sind für ihre lauten, rauen und krächzenden Lautäußerungen bekannt. Dies gilt jedoch nur für ihre einsilbigen oder mehrfach gereihten Rufe, deren Äußerung fast immer in einem territorialen und/oder antagonistischen Kontext steht. Der eigentliche Gesang der meisten Würgerarten dagegen ist relativ leise und nur in der Paarbildungsperiode und Vorbrutzeit zu hören. Er besteht aus kurzen modulierten Trillern und klaren, zum Teil gepfiffenen, melodiösen Tonfolgen, die, zuweilen leise dahin schwatzend, unterschiedlich variiert und wiederholt werden. Beide Geschlechter singen, das Männchen jedoch ausdauernder und häufiger. Viele Arten bauen in ihren Gesang Gesangselemente anderer Vogelarten mit ein. Mit Brutbeginn sind nur mehr die grellen Signallaute der verschiedenen Arten zu hören. Dazu kommen eine Reihe von kurzen, scharfen Rufen, die vor Feinden warnen; diese sind oft nach Art der Bedrohung differenziert. Stimmimitationen werden von einigen Arten offenbar auch zum Anlocken potentieller Beutetiere eingesetzt.[16][17]
Verbreitung, Lebensraum und Wanderungen
Verbreitung

.jpg.webp)
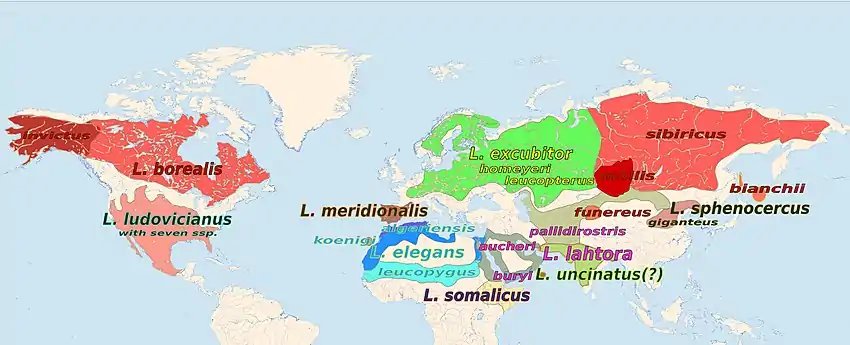
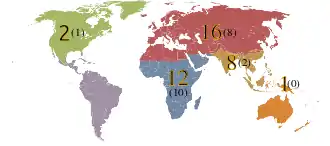
Die Gattung ist bis auf die Polar- und Subpolargebiete sowie die Neotropis weltweit verbreitet. Die Australis wird mit einer Unterart des Schachwürgers (L. schach stresemanni) auf Neuguinea erreicht, L. ludovicianus mexicanus, eine Unterart des Lousianawürgers, brütet in Südmexiko im Grenzbereich zur Neotropis. Die größte Artenvielfalt besteht in der Afrotropis und in der Paläarktis. 10 Arten brüten ausschließlich in der Afrotropis, 8 Arten nur in der Paläarktis. Eine große Artenkonzentration besteht auch im südostasiatischen Grenzbereich zwischen Paläarktis und Orientalis. 2 Arten (São-Tomé-Würger und Philippinenwürger) sind Inselendemiten (São Tomé beziehungsweise Philippinen). 6 Arten brüten in 2 Faunenreichen, 2 Arten (Südlicher Raubwürger und Schachwürger) in drei.
In Europa ist die Gattung mit 6 Arten vertreten, in Mitteleuropa mit 4, von denen nur der Neuntöter eine weitgehend geschlossene Verbreitung in dieser Region aufweist. Die anderen Würgerarten sind in Mitteleuropa sehr selten und ihre Vorkommen stark fragmentiert.
Nach Klimazonen ist die Gattung vor allem in den gemäßigten- und subtropischen Zonen sowie in den Tropen vertreten. Einige Arten sind sehr klimatolerant und bewohnen unterschiedliche Klimabereiche. Dies gilt vor allem für die Zugvögel unter den Lanius–Arten. So liegen die nördlichsten Brutvorkommen des Nördlichen Raubwürgers in Alaska nahe am nördlichen Polarkreis, die südlichsten in den sommerheißen Steppengebieten des südlichen Zentralasiens.
Vertikal kommen Vertreter der Gattung vom Meeresniveau bis in Höhen von über 4000 Metern vor. Vor allem Arten, die in den zentralasiatischen Gebirgen (Tian Shan, Alai-Gebirge, Altai und Pamir-Gebirge), sowie in der Himalaya–Region beheimatet sind, wurden in Höhen zwischen 3000 und 4000 Metern als Brutvögel nachgewiesen, der Tibetwürger ist in Nepal erst ab 2700 Metern allgemein verbreitet und steigt zumindest bis 4500 Meter auf.[18] Ausschließlich in großen Höhen lebt auch die Unterart des Keilschwanzwürgers (Lanius sphenocercus giganteus). Aber auch afrikanische Arten, wie etwa der Fiskalwürger, sind in Höhen von über 3000 Metern zu finden.[19] Die meisten Arten bewohnen jedoch colline und submontane Höhenstufen.
Lebensraum
Entsprechend dem großen und klimatisch stark differenzierten Verbreitungsgebiet der Gattung kommen Würger in sehr unterschiedlichen Lebensräumen vor. Die meisten Arten bevorzugen jedoch trockene, wärmeexponierte, offene oder halboffene Landschaftsstrukturen mit möglichst vielfältiger, mosaikartiger Vegetationszusammensetzung. Bei einigen Arten differieren die Habitatpräferenzen zwischen Brutzeit und Außerbrutzeit deutlich, im Besonderen natürlich bei den Zugvögeln. Immer müssen kurzrasige oder überhaupt unbewachsene Flächen, Büsche, vereinzelte Bäume, Hecken, in baumlosen Steppengebieten Telegraphenmasten und Stromleitungen als Ansitz und dichte, bevorzugt dornige Büsche als Brutplatz und Ort, Beutetiere aufzuspießen, vorhanden sein. Da von einer einzelnen Warte, abhängig vom Bewuchs und vom Bodenrelief nur ein Areal von 10–15 Meter im Umkreis intensiv nach Beutetieren abgesucht werden kann, sind Anzahl, Position und Art der Ansitze wesentliche Indikatoren für die Habitatqualität. Diese wird zusätzlich durch Weideflächen oder regelmäßig gemähte Areale ebenso verbessert, wie durch gut besonnte, warme Abschnitte, wie zum Beispiel durch Weingärten. Im Präriegürtel der USA bevorzugt der Louisianawürger Abschnitte mit möglichst großen Anteilen an steinigem, unbewachsenem Boden. Auch die Vielfalt und Zusammensetzung der Buschvegetation spielt für die Häufigkeit der Art eine Rolle. Viele Arten haben sich an die Nähe des Menschen gewöhnt und besiedeln bebautes, nach Möglichkeit jedoch extensiv genutztes Agrarland, Weideland, Obstgärten, Olivenhaine und große Parks. Bebuschte Straßenränder, Ruderalflächen entlang von Bahnlinien oder auf Truppenübungsplätzen, Rodungs- oder Brandflächen in Wäldern können ebenso geeignete Habitate darstellen wie Heide- oder Marschland. In zentralasiatischen Steppengebieten werden locker mit Saxaul bewachsene Regionen oder flussbegleitende Gehölze bevorzugt, im Nahen- und Mittleren Osten dienen Pistazien- oder Tamariskenbüsche häufig als Brutplatz. Die Hochgebirgsarten Zentralasiens und der Himalayaregion kommen häufig in der stark sonnenexponierten Rhododendronwildnis oder in Wacholderbeständen nahe oder oberhalb der Baumgrenze vor. Bis in hohe Breiten vordringende Würger besiedeln dort vor allem große Lichtungen innerhalb der Taiga oder die Übergangszone zwischen Taiga und Tundra. Die in Afrika beheimateten Arten leben in unterschiedlichen, meist trockenen bis fast halbwüstenhaften Habitaten, in Trocken- und Feuchtsavannen sowie am Rande von Waldgebieten, beziehungsweise auf großen Rodungsflächen oder ausgedehnten Lichtungen. Sie besiedeln vielfach agrarisch genutztes Land und kommen auch an Plantagenrändern oder innerhalb von Plantagen vor. Der São-Tomé-Würger, der offenbar ausschließlich die Reste des Primärwaldes auf São Tomé besiedelt, scheint der einzige obligate Waldbewohner zu sein. Vergleichsweise dichten Baumbestand bevorzugen auch Maskenwürger, Tigerwürger, Rostmantelwürger und der Philippinenwürger.[20][21] Vielfach haben Würgerarten vor allem in westafrikanischen und südostasiatischen Verbreitungsgebieten ihre Brutareale wesentlich erweitern können, weil Abholzung, Plantagenwirtschaft und Urbanisierung neue Lebensräume schufen.
Der Raumbedarf der einzelnen Arten ist sehr unterschiedlich; er hängt von vielen Faktoren ab, besonders wesentlich sind die allgemeine Habitatqualität (Anzahl der Warten, Beutetierdichte, Bodenbedeckung), sowie der Konkurrenzdruck durch die gleiche, beziehungsweise wie zum Beispiel bei den in manchen Regionen Japans sympatrisch vorkommenden Büffelkopfwürger und Braunwürger, durch die verwandte Art. Unterschiede sowohl in der Größe als auch in der Struktur bestehen auch zwischen Brutrevieren und den außerbrutzeitlich genutzten Territorien. Kleine und mittelgroße Arten wie etwa der Neuntöter beanspruchen bei guter Habitatqualität Reviere von einem halben Hektar[22] oder 100–150 Meter nutzbares Gelände bei einer linearen Ausdehnung des Reviers (Isabellwürger in einem Buschstreifen entlang eines Trockentales.[23]) Große und sehr große Arten, insbesondere solche, die sich überwiegend von Säugetieren und Vögeln ernähren, benötigen entsprechend mehr Lebensraum; so können sich die Territorien des Nördlichen Raubwürgers über 30–40 Hektar erstrecken und bei nicht optimaler Habitatqualität an die 100 Hektar groß werden.[24]
Wanderungen
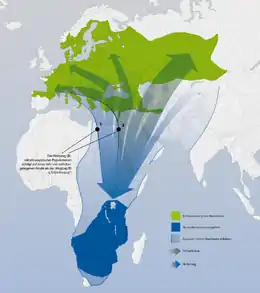

Vereinfacht lässt sich sagen, dass die Arten der Subtropen und Tropen während des gesamten Jahres in ihren jeweiligen Brutgebieten verbleiben; dies gilt für alle afrikanischen Vertreter der Gattung sowie für die süd- und südostasiatischen Arten. Manche von ihnen, vor allem Jungvögel, streifen außerbrutzeitlich kleinräumig umher, bei einigen wenigen sind zumindest in Teilpopulationen Wanderbewegungen festgestellt worden (Graumantelwürger, Rostmantelwürger). Die zentral- und ostasiatischen Arten der Hochgebirge unternehmen, sofern sie nicht überhaupt Zugvögel sind, vertikale Wanderungen. Die Würger der nördlichen gemäßigten Zone sind zum Teil Zugvögel. Da viele von ihnen in mehreren Klimabereichen beheimatet sind, können innerhalb einer Art im Extrem Langstreckenzieher und Standvögel vorkommen, mit allen Abstufungen, die dazwischen liegen. Nicht nur die geographische Breite des Brutgebietes, auch die vorherrschenden Ernährungsgewohnheiten beeinflussen den Grad der Migrationsbereitschaft. Große Arten, etwa der Nördliche Raubwürger, ernähren sich überwiegend von kleinen Wirbeltieren wie kleinen Nagern und Kleinvögeln. Diese sind das ganze Jahr über verfügbar, ein Verlassen der Brutgebiete ist also nicht zwingend notwendig und wird erst erforderlich, wenn die Beutetiere den Lebensraum verlassen oder durch Wetterbedingungen nicht mehr erreichbar sind.
Von den 29 hier berücksichtigten Arten sind 18 zumindest in Teilpopulationen Zugvögel; diese Anzahl entspricht jenen Arten, die in der Holarktis brüten. Die in Europa vorkommenden Würger sind bis auf den Südlichen Raubwürger, der auf der Iberischen Halbinsel weitgehend resident ist, obligate, oder im Falle des Nördlichen Raubwürgers fakultative Zugvögel. Der Neuntöter und der Schwarzstirnwürger sind extreme Langstreckenzieher, die von ihren Brutgebieten bis in die Überwinterungsgebiete im südlichen Afrika 10.000 und mehr Kilometer zurücklegen, Rotkopfwürger und Maskenwürger ziehen meist über mittlere Distanzen bis 6000 Kilometer. In Ostasien sind manche Populationen des Braunwürgers Langstreckenzieher, die von den nördlichsten Brutgebieten am Polarkreis in Sibirien bis zu den Überwinterungsgebieten in Süd- und Südostasien ebenfalls Distanzen um die 8.0000 Kilometer zurücklegen. Die anderen zentral- und ostasiatischen Würgerarten sind Mittel- oder Kurzstreckenzieher beziehungsweise fakultative Zugvögel, die ihr Brutgebiet nur verlassen, wenn es die Nahrungssituation erfordert.
Soweit bekannt ziehen die meisten Arten einzeln oder in kleinen Gruppen und während der Nacht, fraglich sind nächtliche Zugbewegungen für den Louisianawürger.[25] Würger scheinen vor dem Zug keine oder nur unwesentliche Fettreserven anzulegen. Offenbar können sie sich auf dem Zug ausreichend, möglicherweise mit erschöpften, ziehenden Kleinvögeln ernähren. Sie selbst werden ebenfalls häufig Beute von Greifvögeln, insbesondere solchen, die ihre Brutzeiten mit den Zugzeiten der paläarktischen Sperlingsvögel synchronisiert haben, wie dies für Schieferfalke und Eleonorenfalke der Fall ist.[26]
Nahrung- und Nahrungserwerb
Nahrung

Die Nahrung der Würger besteht aus Gliederfüßern und anderen Wirbellosen sowie kleinen Wirbeltieren. Die überwiegende Mehrzahl der erbeuteten Gliederfüßer sind Insekten und unter diesen vor allem Käfer, Heuschrecken, Grillen und Bienen, insbesondere größere Arten wie etwa Hummeln. Mittelgroße und große Insektenbeute wird deutlich bevorzugt, doch nehmen selbst sehr große Würgerarten Beutetiere unter einem Zentimeter Körperlänge auf, wenn diese überreichlich vorhanden sind. Mengenmäßig weniger bedeutend, aber saisonal und artspezifisch nicht unwichtig sind Spinnen, Hundert- und Tausendfüßer, sowie Schnecken und Würmer.[27] Unter den Wirbeltieren überwiegen Mäuse, Wühlmäuse und Spitzmäuse sowie kleine Sperlingsvögel und Reptilien wie Schlangen, Eidechsen und Geckos, gelegentlich auch Fledermäuse. Einige Arten fischen aus Tümpeln Kaulquappen und Fischbrut. Auch Frösche und Kröten gehören zu den zwar seltenen, jedoch regelmäßig aufgenommenen Beutetieren. Gelegentlich gehen Würger an Aas oder nehmen geeignete Nahrung an Futterstellen zu sich. Früchte und Beeren bilden eine saisonale, mengenmäßig nicht sehr bedeutende Beikost. Bei fast allen Arten bestehen zwischen der Brutzeit und dem übrigen Jahr wesentliche Unterschiede in der Nahrungszusammensetzung.
Nach Anzahl der Beutetiere überwiegen für die meisten Arten Gliederfüßer. Einige, vor allem kleinere und mittelgroße Würgerarten, ernähren sich fast ausschließlich von ihnen. Bei größeren spielen Wirbeltiere eine bedeutendere Rolle. Sie übertreffen Gliederfüßer in der aufgenommenen Biomasse immer und werden in den Wintermonaten, wenn Insekten nicht verfügbar sind, zur Nahrungsgrundlage. Für die in der Südpaläarktis, in der Afrotropis und in der Orientalis beheimateten Würger spielen Reptilien, zum Teil auch Froschlurche eine besondere Rolle.
Würger sind imstande, Wirbeltiere, die ihre eigene Körpergröße nicht unwesentlich übertreffen, zu schlagen, meist jedoch sind die Beutetiere kleine Nager, kleine Eidechsen oder Geckos, junge Schlangen oder kleine Sperlingsvögel. Kranke oder verletzte Tiere werden besonders oft erbeutet.
Der Nördliche Raubwürger, eine sehr große Art, benötigt eine tägliche Futtermenge von 44,1–62,6 Gramm, kleinere Arten entsprechend weniger.[28] Unverdauliche Nahrungsreste werden in Speiballen ausgewürgt.
Nahrungserwerb
Würger sind keine Nahrungsspezialisten, sondern ernähren sich von solchen Beutetieren, die in ausreichender Menge vorhanden sind und sich ohne zu großen Energieaufwand erbeuten lassen. Nur während der Brutzeit wird die Auswahl der Beutetiere den Erfordernissen der Jungenaufzucht angepasst.

Würger sind vor allem Ansitzjäger, doch sind alle Arten dazu imstande, die Jagdmethode auf die jeweilige Situation abzustimmen. Sie erspähen meist in sehr aufrechter Körperhaltung und gut sichtbar von einer niedrigen Warte aus das Beutetier und schlagen es am Boden. Diese Jagdmethode ist mit Abstand die energieeffizienteste. Von verborgenen Ansitzen aus jagen jene Arten, die sich zeitweise auf die Erbeutung von Nestlingen spezialisieren, wie etwa der Fiskalwürger.[29] In von Art zu Art unterschiedlichem Ausmaß erbeuten Würger ihre Beutetiere im Flug, vor allem dann, wenn zu hohe Bodenbedeckung eine ausreichende Bodensicht verhindert. Vögel werden meist in der Luft gejagt und dabei auch über längere Strecken verfolgt, wenn der erste Angriff nicht erfolgreich war. Gelegentlich werden Beutetiere vom Substrat (Rinde, Blätter, Äste) abgelesen – vor allem der Tigerwürger bevorzugt diese Methode des Nahrungserwerbs; nur bei wenigen Würgern, wie etwa dem Südlichen Raubwürger, spielt auch Bodenjagd zu Fuß eine größere Rolle. Einige Arten suchen den Boden im Rüttelflug nach potentieller Beute ab. Obwohl offenbar die meisten Arten den Rüttelflug beherrschen, wird diese energieaufwändige Jagdmethode nur dann häufiger eingesetzt, wenn Ansitze fehlen oder weit voneinander entfernt sind.
Einige Würger erbeuten und verzehren regelmäßig giftige Arten. Der Louisianawürger frisst häufig die nicht unerheblich giftige Schreckenart Romalea microptera, die von anderen Vögeln gemieden wird; die erbeuteten Tiere werden aufgespießt und erst nach einer gewissen Zeit gefressen, nachdem das offenbar zeitlich instabile Gift seine Wirksamkeit verloren hat.[30] Einzelne Individuen des Makinnonwürgers häuten giftige Kröten, bevor sie sie verzehren; dieses Verhalten scheint erworben zu sein, da es nur einzelne Vögel innerhalb einer Population zeigen.[31] Stechenden Bienen und Wespen wird entweder vor dem Fressen nach Art der Bienenfresser durch Schlagen gegen einen harten Untergrund oder durch Manipulation mit dem Schnabel die Giftblase ausgedrückt, oder Stachel und Giftblase werden mit dem Schnabel zur Gänze entfernt.[32]
Das Aufspießen von Beutetieren

Das Aufspießen von Beutetieren ist die bekannteste Verhaltensweise dieser Vogelgattung. Sie dient wahrscheinlich sowohl der Fixierung der Beutetiere, um beim Verzehr kleine Stücke aus ihnen herausreißen zu können, als auch der Vorratshaltung. Sie wurde außer bei Lanius bei der in Australien verbreiteten Gattung Cracticus,[33] sowie bei einigen Vertretern der Buschwürger festgestellt. Es kommen zwei Methoden zur Anwendung: das Aufspießen von Beutetieren, insbesondere von Wirbeltieren, an Dornen oder spitzen Zweigen und das Einklemmen in Zweiggabelungen. Nicht alle Arten wenden diese Methoden an. Bei hauptsächlich von Insekten lebenden Würgern wird das Aufspießen und Einklemmen seltener oder gar nicht beobachtet, zum Beispiel beim Rotkopfwürger. Wenn es vorkommt, dient es vor allem der Vorratshaltung. Größere Arten wie die Raubwürger, der Keilschwanzwürger, der Fiskalwürger oder der Louisianawürger spießen ihre Beutetiere häufig auf. Beide Geschlechter zeigen diese Verhaltensweise; gut gefüllte Spießplätze eines Männchens scheinen für Weibchen eine nicht unwesentliche Rolle bei der Partnerwahl zu spielen. Nach der Balzzeit, während der Spießplätze oft recht gut sichtbar an den Reviergrenzen positioniert sind und die Beutetiere nicht immer zur Gänze verzehrt werden, liegt der Hauptspießplatz später meist sehr verborgen in der Nähe des Brutplatzes, jedoch gewöhnlich nicht im selben Busch, einige weitere verteilt im Territorium.[34]
Verhalten
Würger sind tagaktive, ganzjährig im unterschiedlichen Ausmaß territoriale Vögel. Ihre Aktivitätsphase beginnt deutlich vor Sonnenaufgang und endet in der Abenddämmerung. Auch nahe am nördlichen Polarkreis lebende Arten (Braunwürger, Nördlicher Raubwürger) halten während der Sommermonate einen virtuellen Tag-Nacht-Rhythmus ein. Die Nacht verbringen sie im Inneren eines dichten, nach Möglichkeit dornigen Busches, der sowohl Schutz vor nächtlichen Prädatoren als auch vor Witterungseinflüssen bietet. Die meisten Arten leben in saisonalen Brutpartnerschaften und etablieren Brutterritorien, die mit Überflügen, Rufen und Drohgesten (geduckte Körperhaltung, lang vorgestreckter Schnabel, gefächerter Schwanz und Flügelschlagen) gegenüber Artgenossen und Nahrungskonkurrenten verteidigt werden. Berührungskämpfe sind selten. Das Ausmaß der Territorialität ist unterschiedlich, bei einigen Arten wird nur die unmittelbare Umgebung der Spießplätze und des Nestes intensiv beansprucht und gegebenenfalls verteidigt. Einige Würgerarten neigen zu einer aufgelockerten Koloniebildung, zur Bildung sogenannter Revierklumpen (Cluster), wobei sich Nachbarreviere vielfach überschneiden, ohne dass es zu Feindseligkeiten kommt. Regelmäßig versammeln sich Vögel eines solchen Clusters an den Reviergrenzen. Dieses Verhalten ist beim Schwarzstirnwürger besonders deutlich ausgeprägt, wurde aber auch bei Neuntöter, Louisianawürger, Braunwürger und Büffelkopfwürger festgestellt.[35] Eine Art, der Graumantelwürger, brütet in einem sozialen Verband mit nur einem dominanten Brutpaar und einigen Gruppenmitgliedern als Helfern. Ähnlich ist die soziale Organisation bei L. cabanisi und bei den verwandten Gattungen Eurocephalus und Corvinella. Kooperatives Brüten wird auch beim Rotbürzelwürger vermutet. Einige Arten leben häufig in besonderer Nähe zu anderen Sperlingsvögeln (Isabellwürger, Neuntöter – Sperbergrasmücke; Rotkopfwürger – Orpheusgrasmücke; Nördlicher Raubwürger – Wacholderdrossel; Langschwanzwürger – Büffelweber); diese mutualistischen Beziehungen sind jedoch noch nicht ausreichend erforscht.
Vor Feinden warnen Würger mit Rufen und Drohgesten. Vor gewandten Flugjägern fliehen sie üblicherweise in sichere Deckung, während andere Prädatoren auch angeflogen und gemobbt werden. In Revierclustern beteiligen sich die Paare gemeinschaftlich an dieser Feindabwehr. Während der Brutzeit verhalten sich Würger sehr verborgen und still. Nähert sich ein Eindringling dem Nest, bleibt das Weibchen sehr lange sitzen, während das Männchen die Annäherung aus einer gewissen Distanz, ebenfalls ohne Warnrufe, verfolgt. Erst bei unmittelbarer Gefahr stoßen beide Partner laute, grelle Panikrufe aus, und fliegen den Feind direkt an. In solchen Situationen sind auch Übersprungsreaktionen wie Scheinputzen oder Bettelrufe zu beobachten. Ist die Gefahr vorbei, nähert sich das Weibchen häufig aus entgegengesetzter Richtung wieder dem Nest.[36]
Würger nehmen sowohl Staubbäder als auch Wasserbäder. Untertauchen des gesamten Körpers wurde beobachtet. In den Ruhepausen pflegen sie ihr Gefieder sehr gründlich, nach den Mahlzeiten wird der Schnabel durch seitliches Abreiben an einer Unterlage gereinigt.
Brutbiologie
Paarbildung
Bis auf den Graumantelwürger, der ein Gemeinschaftsbrüter mit einem dominanten Brutpaar ist, führen alle anderen Vertreter der Gattung Lanius eine weitgehend monogame Saisonpartnerschaft. Wiederverpaarungen letztjähriger Brutpartner kommen vor, auch über mehrere Jahre hinweg. Diese sind in residenten Populationen naturgemäß häufiger als bei ziehenden Arten. Polygynie scheint insgesamt selten zu sein; sie wurde bisher gelegentlich beim Südlichen Raubwürger, Nördlichen Raubwürger, Neuntöter und Louisianawürger festgestellt.[37] Außer Paar-Kopulationen dagegen wurden bei einigen Arten regelmäßig beobachtet, besonders häufig bei Schwarzstirnwürger und Louisianawürger. Eine Untersuchung von 44 Bruten des Louisianawürgers in Oklahoma ergab, dass 4 % der Nestlinge nicht den Partner zum Vater hatten.[38] Um solche Vorfälle zu verhindern, ist das Aggressionsverhalten der Männchen während der fruchtbaren Tage der Weibchen wesentlich gesteigert.[39] Die Rituale der Paarbildung unterscheiden sich von Art zu Art in ihren einzelnen Elementen und differieren auch etwas zwischen migrierenden und residenten Populationen, sind einander in ihrem Ablauf jedoch sehr ähnlich. Immer etabliert das Männchen zuerst ein Territorium und macht durch aufrechtes Sitzen an exponierten Stellen, Schauflüge, auffällig platzierte Spießplätze sowie durch Rufreihen auf seine Anwesenheit aufmerksam. Erscheint ein Weibchen, nähert es sich sofort und vollführt in seiner unmittelbaren Nähe die artspezifischen Balztänze, deren Elemente vor allem aus Kopfnicken, Spreizen oder Stelzen des Schwanzes, Flügelschlagen und Körperwendungen bestehen und die für gewöhnlich von einem leisen, murmelnden Gesang begleitet werden. Das Weibchen verhält sich in dieser Phase meist passiv. Inspizieren von Spießplätzen und Futterübergaben, sowie gemeinsames Überfliegen des Territoriums bekräftigen die Paarbildung und leiten zur Nistplatzsuche und zum Nestbau über.
Nistplatz und Nest

Würger nisten entweder in geringer Höhe über dem Erdboden in einem dichten, im Idealfall dornigen Busch, oder meist etwas höher in den Außenzweigen von randständigen Bäumen. Für die unterschiedlichen Arten sind Präferenzen für die eine oder andere Brutplatzoption feststellbar. Viele der Würger der Superspezies um L. collurio nisten vor allem in Büschen, während die Raubwürger, der Rotkopfwürger oder der Schwarzstirnwürger Bäume bevorzugen. Selten kommen Bodenbruten vor oder Nistplätze auf Telegraphenmasten oder anderen erhöhten Warten anthropogenen Ursprungs, vor allem dann, wenn natürliche Nistmöglichkeiten in Büschen oder Bäumen fehlen. Einige ostasiatische Arten bevorzugen Randzonen von Bambusbeständen. In Mittelasien sind Pistazienbüsche und Saxaulsträucher häufige Nestträger, in den ariden Zonen Nordamerikas der Wüsten-Beifuß.[40]
Das Nest wird meist in 4–12 Tagen errichtet, in seltenen Einzelfällen auch in nur einem oder zwei Tagen.[41] Die Beteiligung der Partner am Nestbau ist von Art zu Art verschieden, meist jedoch relativ äquivalent. Panov unterscheidet zwei Grundschemata: den dreischichtigen, außen unverkleideten Nesttyp und den zweischichtigen, der außen mit unterschiedlichen Materialien verkleidet und getarnt wird. Die Außenschicht des ersten Typs besteht aus groben Zweiglein, die ein lose ineinandergestecktes Gerüst bilden und die zweite Schicht sowie den eigentlichen Nestnapf tragen. Nester dieses Typs wirken schlampig zusammengefügt, sind aber meist sehr stabile Konstruktionen. Nester des zweiten Typs unterscheiden sich vom ersten nur im Fehlen der ersten Gerüstschicht.[42] Der eigentliche Nestnapf ist sehr dicht aus Grashalmen, feinen Wurzeln, Tier- und Pflanzenwolle, Moos und verschiedenen anderen Materialien verwoben und außen mit Spinnweben, Moos, Blattrippen, trockenen Blättern und Flechten verkleidet und getarnt. Bei der locker aufliegenden Innenverkleidung überwiegen Federn sowie Tier- und Pflanzenwolle. Die beiden Konstruktionstypen sind insgesamt einheitlich, die dabei verwendeten Materialien naturgemäß sehr unterschiedlich. Nester des ersten Typs bauen vor allem die Raubwürger, der Keilschwanzwürger, die Vertreter des L. collurio-Artenkreises, der Louisianawürger und der Büffelkopfwürger, während Maskenwürger, Rotkopfwürger, Schwarzstirnwürger, Tigerwürger sowie die meisten afrikanischen Arten Nester des zweiten Konstruktionstyps errichten.[43] Einen Sonderfall stellt vielleicht das Nest des Rostmantelwürgers dar, das ein kleiner, sehr fein verarbeiteter, kompakter, außen dicht mit Spinnweben verkleideter Napf ist, sehr ähnlich den Nestern von Eurocephalus sp. oder Prionops sp.[44]

Meist errichten Würger für jede Brut ein neues Nest, auch bei Ausfall einer Erstbrut. Häufig wird das zweite Nest am selben Neststandort, jedoch etwas höher, unter Mitverwendung von Materialien des ersten Nestes gebaut. Wiederverwendungen alter Nester kommen ebenfalls vor, häufig wurden sie beim Fiskalwürger festgestellt.[45]
Gelege und Brut

%252C_Sourbrodt%252C_Belgium.jpg.webp)
Würgergelege bestehen aus 1–9 Eiern. Arten bzw. Populationen höherer Breiten legen signifikant mehr Eier als solche der Tropen. Diese Unterschiede bestehen auch innerhalb einer Art: Die Gelege des Schachwürgers (Unterart L. s. stresemanni) auf Neuguinea umfassen immer 2 Eier, während dieselbe Art (Unterart L. s. tricolor) in den gemäßigten Zonen Mittelasiens im Durchschnitt 5 Eier legt. Gelege des Nördlichen Raubwürgers mit 8 oder 9 Eiern sind in Finnland und Alaska häufig, während die des Südlichen Raubwürgers im Maghreb selten mehr als 5 Eier umfassen. Die Gelege der meisten afrikanischen Arten umfassen zwei oder drei Eier.[46] Die Anzahl der Bruten variiert ebenfalls mit der geographischen Breite. Arten der gemäßigten Zonen brüten nur einmal im Jahr, während jene der Subtropen und Tropen regelmäßig zwei Bruten, gelegentlich auch drei hochziehen. Meist kleinere Ersatzgelege wurden bei frühem Gelegeverlust bei allen Arten festgestellt.[47]
Die Eiablage erfolgt im Tagesrhythmus in den frühen Morgenstunden. Die Eier sind meist spitzoval, bei einigen Arten (Rotkopfwürger, Nördlicher Raubwürger, Louisianawürger) auch annähernd rundoval, in ihrer Grundfärbung oft cremeweiß, insgesamt jedoch farblich recht variabel und meist zum stumpfen Ende hin unregelmäßig und farblich unterschiedlich getupft und gefleckt. Es brütet fast ausschließlich das Weibchen, nur selten und für kurze Zeit löst das Männchen das Weibchen ab.[48] Die Brutzeit beträgt 15–20 Tage; sie ist von der Art, der Gelegegröße und von klimatischen Faktoren abhängig. Das Weibchen wird während der Brutzeit vom Männchen mit Futter versorgt. Wenn die intensive Brut erst mit dem vorletzten oder letzten Ei beginnt, schlüpfen die Jungen innerhalb einer relativ kurzen Zeitspanne und weisen nur geringe Entwicklungsunterschiede auf. Bei gelegentlich vorkommenden früherem Brutbeginn sterben die schwächeren Letztgeschlüpften häufig. Ihre Kadaver werden entfernt, häufiger jedoch verfüttert.[49] Die Küken schlüpfen nackt und blind. Um den vierten Tag beginnen sie die Augen zu öffnen, etwas später öffnen sich die ersten Federfahnen, meist im Brustbereich. Mit etwa 16 Tagen ist das erste Jugendkleid weitgehend ausgebildet und die Steuerfedern haben etwa die Hälfte ihrer endgültigen Länge erreicht. Zu dieser Zeit verlassen auch die ersten halbflüggen Jungvögel das Nest. Sie verbleiben die erste Zeit in unmittelbarer Nestumgebung und werden dort von ihren Eltern weiter betreut. Die Führungszeit, in der sie nach und nach ihren Aktionsradius ausdehnen, dauert mindestens 40 Tage, bei einigen Arten auch länger. Bei Arten mit zwei Jahresbruten, beginnt das Weibchen etwa eineinhalb bis zwei Wochen nach dem Ausfliegen des letzten Jungen mit der Errichtung eines neuen Nestes, während das Männchen die Jungen, später auch das wieder brütende Weibchen weiter versorgt. Nach Erlangen der Selbständigkeit verlassen die Jungvögel das Revier der Eltern und schließen sich zu lockeren Jugendgruppen zusammen.
Bruterfolg
Zum Bruterfolg liegen nicht für alle Arten Angaben vor. Die vorhandenen Daten weisen auf eher hohe Brutverluste hin. Nasskaltes Wetter während der Brutzeit sowie eine hohe Dichte potentieller Nestprädatoren verringern den Bruterfolg, auch die Lage des Nestes, insbesondere seine Höhe über dem Boden beeinflusst die Ausfliegerate. Bei Arten, die bevorzugt in Revierklumpen brüten, erhöht sich der Bruterfolg bis zu einem gewissen Maße mit der Anzahl der Brutpaare eines solchen Clusters. Insgesamt sind jedoch alle Angaben vorsichtig zu interpretieren, da sie von einigen Variablen beeinflusst werden und somit erheblichen Schwankungen unterliegen.
Für Louisianawürger aus 11 Bundesstaaten der USA wurde eine Ausfliegerate von 56 % errechnet, das heißt, von allen gelegten Eiern erreichten 56 % der Nestlinge das Ausfliegealter.[50] Um die 50 % beträgt sie bei Braunwürger und Büffelkopfwürger, etwas weniger beim Neuntöter und den Raubwürgern. Sehr gering scheint der durchschnittliche Bruterfolg bei einigen afrikanischen Arten zu sein, doch beruhen die Angaben nur auf einer kleinen Anzahl untersuchter Nester. Mit 36 % ausgeflogener Jungvögel weisen auch Rotkopfwürger einer spanischen Population eine sehr niedrige Ausfliegerate auf.[51]
Systematik
Äußere Systematik
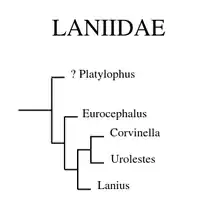
Der Ursprung der Familie wird in Afrika vermutet. Corvidae und Laniidae sind wahrscheinlich Schwesterfamilien und bilden mit den Monarchidae eine Klade[53][54] Die beiden Eurocephalus-Arten gelten als die ursprünglichsten Würger,[55] ihre Zuordnung zu diesen ist Gegenstand wissenschaftlicher Diskussion.[56] Unklar ist auch, ob die monotypische Gattung Platylophus den Laniidae oder den Corvidae zuzuordnen ist.[57] Gegenwärtig werden in dieser Familie mit Lanius, Eurocephalus, Urolestes und Corvinella vier Gattungen vereint, von denen Eurocephalus zwei Arten aufweist und die beiden letzteren monotypisch sind.
Innere Systematik
Die Gattung Lanius wurde 1758 von Carl von Linné anhand eines Balges des Nördlichen Raubwürgers erstbeschrieben. In der 10. Ausgabe der Systema naturae beschreibt er einige Lanius-Arten (darunter 5 heute gültige und 5 Arten aus anderen Familien), unter ihnen den Seidenschwanz (Bombycilla garrulus). Er stellte die Gattung gemeinsam mit Geiern, Falken und Eulen zu den Greifvögeln (Accipitres).[58] 1815 wurde die Gattung von Constantine Samuel Rafinesque-Schmaltz in die von ihm definierte Familie Laniidae gestellt. Lanius stellt in anatomischer, morphologischer und verhaltensbiologischer Hinsicht eine sehr homogene Gattung dar. Dennoch sind auf Gattungsebene viele Fragen – vor allem in Bezug auf die generellen Verwandtschaftsverhältnisse innerhalb der Gattung sowie in Bezug auf Radiation, Artenanzahl und Anzahl und Zuordnung der Unterarten – ungeklärt. Innerhalb der Gattung bestehen einige Artenkreise, die sehr nahe verwandte Arten aufweisen. Vielfach überlappen die Verbreitungsgebiete, sodass Hybridpopulationen entstehen, die zum Teil als selbständige Arten angesehen wurden oder als Rassen betrachtet werden, die auf dem Weg zur Artbildung sehr weit fortgeschritten sind. So scheint es sich zum Beispiel bei L. tephronotus lahulensis, einer Unterart des Tibetwürgers, um eine stabilisierte Hybride zwischen dem Schachwürger und dem Tibetwürger zu handeln.[59] Ähnliche Abgrenzungsunschärfen bestehen in den anderen Artenkreisen, vornehmlich im L. collurio-L. phoenicuroides-L. isabellinus-Komplex in der Gruppe der großen, grauen paläarktischen und holarktischen Würger sowie im Artenkreis um L. collaris.[60][61][62] Verstärkt wird die schwierige Definitionslage noch dadurch, dass einige Arten in ihren ausgedehnten Verbreitungsgebieten eine große Anzahl von Unterarten mit oft sehr deutlicher Differenzierung aufweisen.
Auch molekulargenetische Untersuchungsmethoden haben nur bedingt dazu beigetragen, offene Fragen zu beantworten. So ergaben zum Beispiel die Untersuchungen von Olsson u. a., dass die zurzeit geltende Trennung von L. excubitor in eine nördliche- (Nördlicher Raubwürger) und eine südliche Art (Südlicher Raubwürger) molekulargenetisch nicht unterstützt wird, und der L. excubitor-Komplex nach Ansicht der Autoren aus zumindest 6 Arten bestehen müsste. Sie fügen jedoch an, dass auch andere Interpretationen ihrer Ergebnisse denkbar seien.[65] Davon zum Teil abweichend fordern Peer et al. Artrang für die nearktischen Unterarten von L. excubitor und der Nominatform von L. meridionalis.[66] Aber auch sie raten dazu, weitere Ergebnisse abzuwarten. Insgesamt ist zu erwarten, dass die Anzahl der Arten anwachsen wird, vor allem in der Gruppe der Grauwürger werden einige – jetzt noch als Unterarten behandelte Taxa – Artrang erhalten.[67]
Entsprechend der Artenliste des IOC[68] und den Neubewertungen, die seit dem Erscheinen der Arbeiten von Olsson, Alström, Peer und anderen vorgenommen wurden,[69][70] wurden in der folgenden Artenliste 30 Arten aufgenommen. Im Wesentlichen entspricht diese jenen bei Harris und Franklin, Panov und der bei Josep del Hoyo u. a. In seiner letzten taxonomischen Revision (2017) führt das HBW L. giganteus mit dem deutschen Namen Sichuanwürger als eigenständige Art.[71] IOU und andere Autoritäten sind dieser Einschätzung mit Stand September 2018 noch nicht gefolgt. Unübersichtlich ist auch mit Stand Ende 2018 die taxonomische Situation innerhalb des L. excubitor/L.meridionalis-Komplexes. In Folge der Arbeit von Alström et al. wurden die in der holarktischen Taigazone beheimateten Würger als L. borealis in den Artrang gestellt; die 8 oder mehr Unterarten von L. meridionalis wurden zu L. excubitor gestellt, sodass L. meridonalis zur Zeit monotypisch und auf die Iberische Halbinsel und Südfrankreich beschränkt ist, während L. excubitor zu einer auf drei Kontinenten vorkommenden, mindestens 12 Unterarten umfassenden Riesenart wurde.[72] Es muss aber angenommen werden, dass die Systematik dieses Artenkreises weiteren Revisionen unterzogen wird; so wird mit Stand Ende 2018 die Stellung der Unterarten in der Gruppe um L. e. elegans und um L. e. lahorta besonders diskutiert.
| Deutscher Name | Wissenschaftlicher Name | Verbreitung | Gefährdungsstufe Rote Liste der IUCN |
Anmerkungen | Bild |
|---|---|---|---|---|---|
| Tigerwürger | Lanius tigrinus Linnaeus, 1758 |
Äußerstes Südostrussland, Nordost- und Ostchina, Korea, Japan | monotypisch – Wahrscheinlich nahe mit der Superspezies aus L. collurio, L. cristatus und L. isabellinus verwandt. | %252C_Hindhede_Nature_Park%252C_Singapore_-_20060921.jpg.webp) | |
| Büffelkopfwürger | Lanius bucephalus Temminck & Schlegel, 1845 |
Südostrussland, Nordost-, Südost und Zentralchina, Korea, Japan, Sachalin, Kurilen, Ryūkyū-Inseln, Daitō-Inseln, Ogasawara-Inseln | 2 Unterarten |  | |
| Neuntöter | Lanius collurio Linnaeus, 1758 |
Europa bis auf SW und höherem Norden, Kleinasien, ostwärts bis Zentralasien | mindestens drei Unterarten – Bildet eine Superspezies mit L. cristatus und L. isabellinus |  | |
| Isabellwürger | Lanius isabellinus Hemprich & Ehrenberg, 1833 |
Östlich des Kaspischen Meeres von Kasachstan bis NW Pakistan, nordwärts bis NW China und NW Mongolei. | zumindest 4 Unterarten. Unterart L. i. phoenicuroides mehrheitlich als eigenständige Art angesehen – Bildet eine Superspezies mit L. cristatus und L. collurio |  | |
| Rotschwanzwürger | Lanius phoenicuroides (Schalow, 1875) |
Ostiran, Zentral- und Nordafghanistan, Nordwestpakistan, Turkmenistan, Usbekistan, Kirgisistan und Zentral- und Südkasachstan | monotypisch – Frühere Unterart L. isabellinus phoenicuroides 2005 in Artrang gestellt – nicht allgemein anerkannt.[73] | .JPG.webp) | |
| Braunwürger | Lanius cristatus Linnaeus, 1758 |
Zentralasien ostwärts bis zum Pazifik, nordwärts bis zum Polarkreis und südostwärts bis Korea. Kamtschatka, Sachalin und Japan. | 4 Unterarten – Bildet eine Superspezies mit L. tigrinus, L. isabellinus und L. collurio | -_Immature_in_Kolkata_I_IMG_0147.jpg.webp) | |
| Burmawürger | Lanius collurioides Lesson, 1831 |
Nicht ausreichend bekannt. Nordostindien und Festland – Südostasien (außer Malaiische Halbinsel) | 2 Unterarten – Vermutlich Superspezies mit L. vittatus. |  | |
| Rotbürzelwürger | Lanius gubernator Hartlaub, 1882 |
Sehr lokal südlich der Sahara und nördlich des Äquators von Südmali ostwärts bis in den südlichen Südsudan. | monotypisch – Bildet vermutlich eine Superspezies mit L. souzae. | ||
| Rostmantelwürger | Lanius souzae Bocage, 1878 |
Westliches und zentrales Afrika südlich des Regenwaldgürtels. südwestwärts bis Südangola, südostwärts bis Nordmosambik. | 3 Unterarten – Bildet vermutlich eine Superspezies mit L. gubernator | _(8077352625)~crop.jpg.webp) | |
| Rotschulterwürger | Lanius vittatus Valenciennes, 1826 |
Fragmentierte Verbreitung von Süd- und Zentralturkmenistan, Iran, Afghanistan, bis Nepal und Indien. | 2 Unterarten – Vermutlich Superspezies mit L. collurioides, doch insgesamt ungeklärte Verwandtschaftsverhältnisse. | _at_Sultanpur_I_Picture_052.jpg.webp) | |
| Schachwürger | Lanius schach Linnaeus, 1758 |
Sehr ausgedehntes Verbreitungsgebiet von SW Iran über Indien bis Südostasien, Taiwan, Hainan, Sumatra, Java und einige kleine Sundainseln, Neuguinea. | 9 Unterarten – Superspezies mit L. tephronotus – von einigen Autoren als conspezifisch betrachtet. | _in_Kolkata_W_IMG_3434.jpg.webp) | |
| Tibetwürger | Lanius tephronotus (Vigors, 1831) |
Himalayagebiet von Kaschmir ostwärts bis Südchina. | 2 Unterarten – Superspezies mit L. schach, zuweilen als conspezifisch mit diesem betrachtet. | .jpg.webp) | |
| Philippinenwürger | Lanius validirostris Olgivie-Grant, 1894 |
Endemisch auf den Philippinen. Luzon, Mindanao und Mindoro. | 3 oder 4 Unterarten | ||
| Schwarzstirnwürger | Lanius minor Gmelin, 1788 |
Lückenhaft in Europa, nach Osten und Südosten hin geschlossener. Ostwärts bis NW China, im Südosten Kleinasien, Syrien, Irak, Afghanistan. | 2 Unterarten |  | |
| Louisianawürger | Lanius ludovicianus Linnaeus, 1766 |
Kanada südwärts bis Mexiko (Oaxaca) | 7 Unterarten – Bildet eine Superspezies mit L. excubitor, L. meridionalis und L. sphenocercus, L. borealis und L. giganteus. |  | |
| Raubwürger zuvor Nördlicher Raubwürger |
Lanius excubitor Linnaeus, 1758 |
fragmentiert Mitteleuropa und Westeuropa. Kleinasien, Kaukasus; Afrika bis 15°N, Arabische Halbinsel, Zentralasien, N und Zentralindien, Mongolei, NW China | Geographische Variation und Stellung der Unterarten nicht klar. 2016 neu bewertet; mit den Unterarten von meridionalis verbunden; bildet eine Superspezies mit L. ludovicianus, L. meridionalis, L. sphenocercus, L. borealis und L. giganteus | .jpg.webp) | |
| Taigaraubwürger zuvor Nördlicher Raubwürger |
Lanius borealis Vieillot, 1808 |
Holarktischer Nadelwaldgürtel von Alaska bis Westmongolei | Geographische Variation und Stellung der Unterarten nicht klar. 2016 neu bewertet; 6 Unterarten; bildet eine Superspezies mit L. ludovicianus, L. meridionalis, L. sphenocercus, L. excubitor und L. giganteus |  | |
| Iberienraubwürger zuvor Südlicher Raubwürger |
Lanius meridionalis Temminck, 1820 |
Iberische Halbinsel; Mittelmeerküste und Hinterland in Südfrankreich | monotypisch; 2016 neu bewertet; bisherige Unterarten zu excubitor gestellt. Bildet eine Superspezies mit L. ludovicianus, L. excubitor und L. sphenocercus |  | |
| Keilschwanzwürger | Lanius sphenocercus Cabanis, 1873 |
Verbreitungsgrenzen nicht ganz klar: Südostrussland, S- und südliches Zentralchina; nördliches Nordkorea (?) | 1 Unterart oder monotypisch. L. s. giganteus wird oft als Art (L. giganteus – Sichuanwürger) aufgefasst – Bildet eine Superspezies mit L. ludovicianus, L. excubitor und L. meridionalis | .jpg.webp) | |
| Sichuanwürger | Lanius giganteus Przevalski, 1887 |
Verbreitungsgrenzen nicht ganz klar: Hochgebirgsart Zentralchina (östliches Qinghai, südwestliches Gansu, östliches Xizang, nördliches und westliches Sichuan) | monotypisch. 2016 von L. sphenocercus abgetrennt und in Artrang gestellt Superspezies mit L. sphenocercus, L. ludovicianus, L. excubitor und L. meridionalis | ||
| Graumantelwürger | Lanius excubitoroides Prévost & Des Murs, 1847 Syn.: Lanius excubitorius |
Sahelzone südlich der Sahara, ostwärts bis Tansania, Ruanda und Burundi. | 3 Unterarten – Die Erstbeschreiber nannten die Art L. excubitoroides, änderten den Artnamen jedoch in exbubitorius, da sie fälschlich annahmen, excubitoroides sei bereits vergeben.[74] |  | |
| Langschwanzwürger | Lanius cabanisi Hartert, 1906 |
Südsomalia, Zentral- und Südostkenia, Nordosttansania bis Dar es Salaam | monotypisch |  | |
| Taitawürger | Lanius dorsalis Cabanis, 1878 |
Östliches Afrika vom südöstlichen Südsudan südwärts bis Nordosttansania. | monotypisch |  | |
| Somaliwürger | Lanius somalicus Hartlaub & Heuglin, 1859 |
Südliches Südsudan, Äthiopien, Somalia und Kenia | monotypisch |  | |
| Mackinnonwürger | Lanius mackinnoni Sharpe, 1891 |
Wahrscheinlich fragmentiert – Westteil von Südkamerun bis Nordangola, Ostteil östliche Demokratische Republik Kongo, Uganda, Nordwestkenia. | monotypisch |  | |
| Nördlicher Fiskalwürger | Lanius humeralis Stanley, 1814 |
Westliches Afrika von Südmauretanien ostwärts Zentraleritrea südostwärts bis Nordmosambik, südöstlich bis NO Sambia, südwestlich bis Sierra Leone und Liberia. | 3 Unterarten. Zuvor Unterart von Lanius collaris, 2012 in Artrang erhoben.[75][76] Die Unterart L. humeralis marwitzi Reichenow, 1901 wird von einigen Autoren als Art betrachtet.[77] |  | |
| Südlicher Fiskalwürger | Lanius collaris Linnaeus, 1766 |
Großteil Afrikas südlich des Äquators | 4 Unterarten. Lanius collaris humeralis (mit zwei weiteren Unterarten) 2012 in Artrang gestellt[78] |  | |
| São-Tomé-Würger | Lanius newtoni Bocage, 1891 |
Endemisch auf São Tomé | monotypisch – Gelegentlich als conspezifisch mit L. collaris betrachtet. |  | |
| Rotkopfwürger | Lanius senator Linnaeus, 1758 |
Mittelmeergebiet, ostwärts bis Irak und Westiran. | 4 Unterarten. | _(8587246504)_(2).jpg.webp) | |
| Maskenwürger | Lanius nubicus Lichtenstein, 1823 |
Balkan, Levante, ostwärts bis Irak und Westiran. Östliche und nordöstliche Verbreitungsgrenze unklar. | monotypisch |  |
Bestand und Gefährdung
Der IUCN führt nur zwei Arten als weltweit gefährdet auf: Den Philippinenwürger und São-Tomé-Würger, beides Inselendemiten, die naturgemäß sensibel auf Eingriffe in ihren meist räumlich beschränkten Lebensraum reagieren. Der Philippinenwürger ist potentiell gefährdet (NT = near threatened), vor allem deshalb, weil sein Lebensraum auf den drei philippinischen Inseln Luzon, Mindanao und Mindoro vor allem in den Tieflandgebieten starken menschlichen Eingriffen ausgesetzt ist. Neuere Untersuchungen zeigen jedoch, dass die Art in mittleren- und höheren Lagen durchaus häufig ist.[79][80] Wesentlich kritischer ist die Bestandssituation des São-Tomé-Würgers. Die Art galt als ausgestorben, bis sie 1990 wiederentdeckt wurde. Seitdem gelangen weitere Beobachtungen, der Bestand wird aber auf unter 50 Individuen geschätzt. Maßgebend für diese Entwicklung ist die Lebensraumzerstörung, vor allem die Umwandlung des Primärwaldes in Kakaoplantagen, sowie die Verbreitung invasiver Tierarten, wie der Hausratte (Rattus rattus) und der Monameerkatze (Cercopithecus mona).[81]

Alle anderen Arten gelten global als ungefährdet (LC = least concern). Dennoch sind einige, insbesondere früher in Mitteleuropa durchaus verbreitete Arten wie Schwarzstirnwürger, Rotkopfwürger und Nördlicher Raubwürger in diesem Bereich seltener geworden oder überhaupt verschwunden. Der gravierende Bestandsrückgang dieser Würgerarten steht im Zusammenhang mit dem starken Rückgang oder regionalen Erlöschen anderer thermophiler Großinsektenjäger wie Wiedehopf, Blauracke, Rötelfalke oder Steinkauz. Stärker atlantisch geprägte Klimaverhältnisse sowie starke Eingriffe in die Lebensräume der verschiedenen Arten, wie Flurbereinigung, Vernichtung der Nischen- und Saumhabitate, Umwandlung kleinräumiger Bebauungsstrukturen in großräumige Monokulturen sowie intensivierter Dünger- und Pestizideinsatz werden als Ursachen diskutiert. Die Bestandseinbrüche setzten in den 1960er Jahren ein und verstärkten sich bis zum Ausgang des Jahrhunderts. Zurzeit ist für die erwähnten Arten, sofern sie nicht völlig verschwunden sind, eine Stabilisierung auf niedrigem Niveau festzustellen.[82] Auch der Neuntöter hat Bestands- und Arealeinbußen erlitten, vor allem ist die Art aus vielen Tiefland-Brutgebieten verschwunden.

Starke Bestandseinbußen wurden in diesem Zeitraum auch für den Büffelkopfwürger und einige andere asiatische Arten festgestellt.[83]
In der Nearktis sind für den Louisianawürger ernstzunehmende Bestandsrückgänge zu verzeichnen. Die Art ist zwar ebenfalls in ihrem Gesamtbestand ungefährdet, in einzelnen Regionen jedoch selten geworden. In Kanada und 14 Bundesstaaten der USA wird die Unterart L. ludovicianus migrans als gefährdet geführt, vom Aussterben bedroht war die Unterart L. ludovicianus mearnsi, die nur auf San Clemente vorkommt; umfangreiche Schutzmaßnahmen ließen den Bestand jedoch wieder auf über 200 Individuen anwachsen.[84]
Der Status der meisten afrikanischen und einiger ostasiatischer Arten ist nicht sehr gut erforscht. Vielfach sind ihre Lebensräume bedroht. Vor allem Rotbürzelwürger (L. gubernator) und Rostmantelwürger (L. souzae) scheinen nicht häufig zu sein.[85]
Die wesentlichsten Gefährdungsursachen sind anthropogener Natur. Lebensraumzerstörung und Pestizideintrag stehen hier an erster Stelle. In einigen Regionen, insbesondere in Ostasien, werden Würger gejagt oder in Netzen gefangen; obwohl dies zunehmend verboten ist und unter Strafe gestellt wird, sind die dadurch entstehenden Verluste noch immer beträchtlich.
Würger haben, wie andere kleine Singvögel auch, sehr viele natürliche Feinde. Vor allem Greifvögel wie Sperber und Habichte sowie unterschiedliche Falkenarten, schlagen adulte Würger; eine Reihe von Krähenarten zerstören Gelege und erbeuten Nestlinge und Jungvögel. Verschiedene Schlangenarten, sowie Marder und Füchse spielen als Nesträuber ebenfalls eine Rolle. Insgesamt 9 Kuckucksarten[86] sowie der Braunkopf-Kuhstärling verringern als Brutparasiten den Bruterfolg, doch ist die Fähigkeit, Fremdeier zu erkennen und zu entfernen bei vielen Würgerarten sehr hoch entwickelt.[87]
Würgerarten werden von einer Reihe von Ekto- und Endoparasiten befallen. Häufig finden sich Zecken an ihnen, die für Menschen gefährliche Erkrankungen, wie FSME, Omsker Fieber und Kyasanur-Wald-Fieber übertragen sowie bei Pferden Babesiose hervorrufen können.[88]
Literatur
- Josep del Hoyo, Andrew Elliot, Jordi Sargatal (Hrsg.): Handbook of the Birds of the World. Band 13: Penduline-Tits to Shrikes. Lynx Edicions, Barcelona 2008, ISBN 978-84-96553-45-3.
- Urs N. Glutz von Blotzheim (Hrsg.): Handbuch der Vögel Mitteleuropas. Band 13: Passeriformes. 4. Teil: Sittidae – Laniidae. Bearb. u. a. von Kurt M. Bauer und Urs N. Glutz von Blotzheim. Band 13/2, Akademische Verlagsgesellschaft, Frankfurt am Main 1993; Aula-Verlag, Wiesbaden 1993, ISBN 3-89104-535-2.
- Tony Harris, Kim Franklin: Shrikes & Bush-Shrikes. Including wood-shrikes, helmet-shrikes, flycather-shrikes, philentomas, batises and wattle-eyes. Christopher Helm, London 2000, ISBN 0-7136-3861-3, S. 21, 56–57, 139–142.
- Norbert Lefranc, Tim Worfolk: Shrikes A Guide to the Shrikes of the World. Pica Press, 1997, ISBN 1-4081-3505-1.
- Evgenij N. Panov: The True Shrikes (Laniidae) of the World – Ecology, Behavior and Evolution. Pensoft Publishers, Sofia 2011, ISBN 978-954-642-576-8.
Einzelnachweise
- James A. Jobling: Helm Dictionary of Scientific Bird Names. Helm, London 2011, ISBN 978-1-4081-2501-4, S. 153.
- Anm.: Würger werden im Englischen gelegentlich als Butcherbird bezeichnet. Hauptsächlich wird dieser Name jedoch für Vögel der vor allem in Australien verbreiteten Gattung Cracticus verwendet, die wahrscheinlich mit Lanius verwandt sind, und einige Verhaltensweisen, wie das Aufspießen von Beutetieren, mit diesen teilen.
- Anm.: Der Fiscal (afrikaans) ist ein südafrikanischer Beamter, der auch die Rolle des Scharfrichters innehatte und eine schwarz-weiße Uniform trug
- Datenblatt ITIS – Lanius
- Datenblatt IUCN Lanius validirostris
- Datenblatt IUCN Lanius newtoni
- N. Lefranc, T. Worfolk: Shrikes. A Guide to... 1997, S. 17.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 739.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 71.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 43.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 45.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 737.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 71.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 71–73.
- N. Lefranc, T. Worfolk: Shrikes. A Guide to... 1997, S. 18.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 746.
- Stimmdateien bei xeno-canto
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 782.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 792.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 739–744.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 75–78.
- v. Blotzheim (Hrsg.): Sittidae – Laniidae. 1993 Band 13/2 (1993) S. 1180 ff.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 559.
- v. Blotzheim (Hrsg.): Sittidae – Laniidae. 1993 Band 13/2 (1993) S. 1291.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 82.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 763–766.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 113.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 748.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 114.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 113.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 751.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 117.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 119 (Anmerkung)
- v. Blotzheim (Hrsg.): Sittidae – Laniidae. 1993 Band 13/2 (1992) S. 1305 ff.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 756.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 95.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 85 und 86
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 754.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 754.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 88.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 725.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 88–93.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 88–93.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 758.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 92.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 93 und 94
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 95.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 95 und 96
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 99.
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 293.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 761–763.
- TiF Checklist (2014)
- Knud A. Jønsson, Jon Fjeldså: A Phylogenetic Supertree of Oscine Passerine Birds (Aves: Passeri). In: Zoologica Scripta. Band 35, 2006, S. 149–186.
- TiF Checklist
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes. 2000, S. 21.
- E. N. Panov: The True Shrikes (Laniidae). 2011, S. 155–166.
- Marie Aggerbeck, Jon Fjeldså, Les Christidis, Pierre-Henri Fabre, Knud Andreas Jønsson: Resolving deep lineage divergences in core corvoid passerine birds supports a proto-Papuan island origin. In: Molecular Phylogenetics and Evolution 70 (Jan. 2014) S. 272–285.
- William Turton (Übers.): A General System of Nature (…) by Sir Charles Linné. London 1806, S. 177–181. Das Werk Turtons ist eine Übersetzung und starke Erweiterung der Systema naturae
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 734.
- E. N. Panov: The True Shrikes (Laniidae). 2011, S. 37–43; 153 ff.
- TiF Checklist – CORVIDAE
- Anm.: Die Artenkreise, also Gruppen sehr nahe verwandter Arten, die zum Teil auch hybridisieren, sind in der Tabelle als Superspezies erwähnt.
- Urban Olsson, Per Alström, Lars Svensson, Mansour Aliabadian, Per Sundberg: The Lanius excubitor (Aves, Passeriformes) conundrum—Taxonomic dilemma when molecular and non-molecular data tell different stories. In: Molecular Phylogenetics and Evolution. (2010) Vol. 55/2, S. 347–357.
- Jelmer Poelstra: Speciation in shades of grey: the great grey shrike complex. In: Dutch Birding 32, 2010, S. 229–250.
- Urban Olsson, Per Alström, Lars Svensson, Mansour Aliabadian, Per Sundberg: The Lanius excubitor (Aves, Passeriformes) conundrum—Taxonomic dilemma when molecular and non-molecular data tell different stories. In: Molecular Phylogenetics and Evolution. (2010) Vol. 55/2, S. 347–357.
- Brian D. Peer, Carl E. Mc Intosh, Michael J. Kuehn, Stephen I. Rothstein und Robert C. Fleischer: Complex biogeographic History of Lanius Shrikes and its Implication for the Evolution of Defenses of Avian Brood Parasitism. In: The Condor 113(2):385–394 (2011)
- TiF Checklist – CORVIDAE
- IOC Checklist 8.2 (Juni 2018)
- Urban Olsson, Per Alström, Lars Svensson, Mansour Aliabadian, Per Sundberg: The Lanius excubitor (Aves, Passeriformes) conundrum—Taxonomic dilemma when molecular and non-molecular data tell different stories. In: Molecular Phylogenetics and Evolution. (2010) Vol. 55/2, S. 347–357.
- Brian D. Peer, Carl E. Mc Intosh, Michael J. Kuehn, Stephen I. Rothstein und Robert C. Fleischer: Complex biogeographic History of Lanius Shrikes and its Implication for the Evolution of Defenses of Avian Brood Parasitism. In: The Condor 113(2):385–394 (2011)
- J. del Hoyo, N. Collar & G. M. Kirwan (2018). Giant Grey Shrike (Lanius giganteus). In: J. del Hoyo, A. Elliott, J. Sargatal, D. A. Christie & E. de Juana (Hrsg.). Handbook of the Birds of the World Alive. Lynx Edicions, Barcelona. (abgerufen auf https://www.hbw.com/node/1343839 am 30. August 2018).
- IOC-Liste Juni 2018
- Clements checklist 6.8 (August 2013) S. 570.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 788.
- Clements checklist – Revision 6.7 Sept. 2012
- Jérôme Fuchs, Timothy M. Crowe und Rauri C. K. Bowie: Phylogeography of the fiscal shrike (Lanius collaris): a novel pattern of genetic structure across the arid zones and savannas of Africa. In: Journal of Biogeography (J. Biogeogr.) (2011) S. 1–13.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 793.
- Clements checklist – Revision 6.7 Sept. 2012
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes... 2000, S. 212.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 768.
- Josep del Hoyo u. a.: Penduline-Tits to Shrikes. 2008, S. 767–768.
- Vergl.: Bestandsentwicklung der erwähnten Arten in Baden-Württemberg. In: Jochen Hölzinger (Bearb.): Die Vögel Baden-Württembergs. Band 3: Singvögel. Teilband 2, Ulmer, Stuttgart 1997, ISBN 3-8001-3483-7, S. 242–330.
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes... 2000, S. 185.
- San Clemente Loggerhead Shrike (Lanius ludovicianus mearnsi). 5-Year Review: Summary and Evaluation. U.S. Fish and Wildlife Service, Carlsbad Fish and Wildlife Office. Carlsbad, CA, June 17, 2009.
- T. Harris, K. Franklin: Shrikes & Bush-Shrikes... 2000, S. 146–212.
- Peter E. Lowther: Host List of Avian Brood Parasites – 2 – CUCULIFORMES – Old World Cuckoos Field Museum 2013.
- Brian D. Peer, Carl E. Mc Intosh, Michael J. Kuehn, Stephen I. Rothstein und Robert C. Fleischer: Complex biogeographic History of Lanius Shrikes and its Implication for the Evolution of Defenses of Avian Brood Parasitism. In: The Condor 113(2):385–394 (2011)
- E. N. Panov: The True Shrikes (Laniidae)... 2011, S. 134–139.